Rakukultuur
Rakukultuur on toimingute kogum, mis võimaldab kasvatada elusorganismide rakke väljaspool organismi ehk in vitro. Tüüpiliselt kasvatatakse inimese eri kudedest eraldatud rakke, kuid on üsna levinud ka rakud muudest organismidest, sh imetajad (nt hiina hamster, rohepärdik, kodukoer) kui loomad üldisemalt (nt uitöölane). Taime-, seene- ja bakterirakkude kasvatamise kohta kasutatakse enamasti täpsustavaid mõisteid (nt bakterikultuur).[1][2][3]
Enamasti kasvavad ühes kultuuris ühte tüüpi rakud, nii algse elundi (nt kopsud, nahk) kui ka rakutüübi (nt fibroblastid või epiteelirakud) mõistes. Samas kuulub rakukultuuri arengusuundade hulka ka rakkude nn kooskultiveerimine (inglise keeles co-culturing).[4] Rakukultuur loob väärtuslikke mudelsüsteeme, milles on võimalik läbi viia teaduslikke uuringuid: näiteks mõõta ravimikandidaatide omadusi,[5][6][7] teha kindlaks teatud valgu rolli elusrakus,[8][9] jäljendada füsioloogilisi protsesse[10][11] või toota terapeutilisi antikehi või vaktsiine.[12][13]

Rakkude üldised kasvutingimused
[muuda | muuda lähteteksti]Rakukultuuris on oluline tagada rakkudele kasvutingimused, mis võimaldaksid neil võimalikult kestvalt kasvada ja jaguneda. Seejuures mängivad rolli paljud tegurid, millest olulisimad on kasvukeskkonna temperatuur ja pH ning toitainete ja hapniku olemasolu.
Temperatuur ja valgustus
[muuda | muuda lähteteksti]

Rakukultuuri korduvaid toiminguid teostatakse enamasti toatemperatuuril ja kunstliku valgustuse käes, bioohutuskapi ehk laminaari all. Muul ajal kasvavad aga rakud inkubaatoris, kus on pime, niiske ja soe atmosfäär. Suuremat osa inimorganismist pärit rakkudest kasvatatakse 37 °C juures,[14] kuid teiste organismide rakud võivad vajada normaalseks talitluseks teistsuguseid temperatuure: näiteks uitöölasest (Spodoptera frugiperda) pärit rakuliin Sf9 kasvab eelistatult 24–28 °C juures.[15]
Toitained
[muuda | muuda lähteteksti]Rakkude kasvatamine teostatakse viisil, kus rakke ümbritseb toitev veepõhine keskkond (nn rakusööde). Rakusööde sisaldab süsivesikuid (nt glükoos), aminohappeid (nt glutamiin), valgulisi lisandeid (nt kasvufaktoreid sisaldav veise looteseerum (FBS), ioontugevust kindlustavaid ja vajalikke metalliioone sisaldavaid soolasid (nt NaCl, KCl, CaCl2), vitamiine ja muid koostisaineid.[16] Erinevad rakud vajavad optimaalseks kasvuks erinevaid söötmeid ja täiendavaid lisandeid (nt insuliin, östradiool vms).[17][18] Söötme koostis võib mõjutada ka rakkudega tehtavate katsete tulemusi (nt teatud metallisoolade kontsentratsioon võib mõjutada rakkude plasmamembraanil paiknevate retseptorite omadusi[19]). Rakusöötme kasutamisel on oluline jälgida ka veesisaldust, kuna soolade suur kontsentratsioon võib viia rakud osmootse šokini; inkubaatori niiskusrežiim tagab rakusöötmes sisalduva vee minimaalset aurustumist.[20]
pH
[muuda | muuda lähteteksti]Samuti sisaldab rakusööde koostisaineid, mis vastutavad pH puhverdamise eest. Kuna vere normaalne pH organismis on ligi 7,4, siis see on ka optimaalne pH paljude rakukultuuris kasvavate rakkude jaoks.[21] Kuivõrd rakud võivad aga olla tundlikud puhvri komponentide suhtes (nt vähendab mõningate rakkude elumust oluliselt HEPES, mis on tüüpiliseks pH-puhverdamist tagavaks komponendiks paljudes biokeemilistes katsetes[22][23]), siis kasutatakse sageli nn karbonaatpuhvrit. Karbonaatpuhver vajab toimimiseks kindlat süsihappegaasi sisaldust (enamasti 5% ruumala järgi ning ülejäänud 95% on õhk) rakusöötme kohal ehk rakkude kasvatamiseks kasutatava inkubaatori atmosfääris.

Sageli lisatakse rakusöötme koostisse sageli pH indikaatorit (fenoolpunane), mille värvuse alusel saab otsustada, kas rakkude kasvutingimused on sobilikud. Tüüpiliselt omab fenoolpunane olenevalt konkreetsest söötmest ja kasvatatavatest rakkudest värvust õrnroosast kuni oranžini. Rakkude tiheduse suurenemisel (millega kaasneb keskkonna happelisuse tõus rakkude hingamise käigus) või saastatuse tekkimisel muutub indikaatori värvus kollaseks. Kui aga sööde muutub liialt aluseliseks (nt juhul, kui rakke hoitakse pikka aega väljaspool inkubaatorit või kui inkubaatori CO2 sensor ei toimi normaalselt), omandab fenoolpunane lillakat varjundit.
Hapnik
[muuda | muuda lähteteksti]Hapniku juurdepääsu tagamiseks rakkudele on määravaks mitu tegurit: rakusöötme hulk rakkude kohal/ümber, rakkude kasvatamiseks kasutatava nõu avatus, hapnikusisaldus inkubaatori atmosfääris ja kasvavate rakkude hapniku tarbimine. Iga rakunõu tüübi puhul (nt Petri tass, kolb, kuue süvendiga plaat vms) tuleb arvestada tootja soovitatud rakusöötme ruumalaga,[24][25] mis tagab rakkudele optimaalsed kasvutingimused nii hapniku kui ka toitainetega varustatuse seisukohalt.
Viimastel aastatel on teadlaste seas elavnenud arutelu mõistete "hüpoksia" ja "normoksia" üle rakukultuuri kontekstis.[26] Hüpoksiaks nimetatakse üldistatult olukorda, kus keskkonna hapnikusisaldus on väiksem kui tavaolukorras (ehk normoksias). Tavaolukorra defineerimisel tuleb aga arvestada sellega, et organismi sees ei ole hapniku osarõhk nii suur kui õhus. Normaalrõhul (760 mmHg) on hapniku osarõhk atmosfääris ligi 150 mmHg; terve inimese arteriaalses veres on aga hapniku osarõhk 100 mHg ja perifeersetes kudedes on see veelgi madalam, keskmiselt 40 mmHg.[27] Mõnedes vähkkasvajates võib hapniku osarõhk olla isegi 3 mmHg. Seega on pakutud välja uus mõiste, füsoksia või füsioksia,[27] kus hapniku osarõhk kasutatavas gaasisegus on 38 mmHg (vastab 5% sisaldusele ruumala järgi). Siiski toimub enamikus laborites rakkude rutiinne kasvatamine atmosfääris, mille hapnikusisaldus on ligi 19%[26]; vähendatud hapnikusisaldust kasutatakse küll paljudes rakkudega tehtavates teaduskatsetes.[28][29][7]
Antibiootikumid
[muuda | muuda lähteteksti]Vältimaks bakteriaalse või seenelise saastatuse teket toitvas rakusöötmes ja/või imetajate rakukultuuris, lisatakse söötmele sageli antibiootikume (nt penitsilliin, streptomütsiin) ja antimükootikume (nt amfoteritsiin B). Kuna on näidatud, et selliste lisandite kasutamine võib mõjutada rakkude kasvu, geenide avaldumist ja rakkude diferentseerumist, soovitavad mitmed protokollid vältida antibiootikumide ja antimükootikumide pidevat kasutamist rakukultuuris.[30][31]
Rakkude kasvatamise viisid
[muuda | muuda lähteteksti]Kaks põhilist rakkude kasvatamise viisi rakukultuuris on suspensioonikultuur (vabalt hõljuvana kasvatamine) ja kinnituv kultuur (monokihina kasvatamine). Viimase aastakümne jooksul on rakkude kasvatamisel kogunud populaarsust ka nn 3D-rakukultuur (mis mõnevõrra vastandab ennast tüüpilisele pinnale kinnituvale ja seega kahemõõtmelisele rakukultuurile).
Suspensioonikultuur
[muuda | muuda lähteteksti]Suspensioonikultuuri puhul kasvavad rakud üle terve söötme ruumala, kinnitumata pindadele.[32] Vältimaks rakkude väljasadenemist raskusjõu toimel ning tagamaks toitainete ja hapniku juurdepääsu võrdselt kõigile rakkudele, tuleb suspensioonikultuuris rakke pidevalt segada. Tehniliselt lahendatakse see kas spetsiaalsete magnetsegajate kasutamisega, kus rakkudega kolvi/pudeli sees pöörleb magnetsegajapulk, või nn orbitaalloksutite kasutamisega, kus liigub terve kolb/pudel koos selle sisuga. Suspensioonis kasvatatakse näiteks mitmeid vereloomega seotud rakke.
Kinnituv kultuur
[muuda | muuda lähteteksti]
Kinnituva rakukultuuri puhul kasutatakse nõusid (nt Petri tassid või kindla mahuga horisontaalselt asetatavad kolvid), mille sisepind on kaetud spetsiaalse kihiga, kuhu rakud kinnituvad hästi. Rakkude kinnitumiseks sobivad enamasti hüdrofiilsed kihid, mida saavutatakse pinna töötlemisel polülüsiini, kollageeni või laminiiniga.[33] Näiteks polülüsiin on rakusöötme pH juures positiivselt laetud ning rakud kinnituvad sellele põhiliselt tänu laeng-laeng vastastikmõjudele (kuna rakumembraani välisküljel paiknevad fosfolipiidide negatiivselt laetud rühmad). Mõned rakuliinid on võimelised kohanduma nii suspensioonikultuuris kui ka kinnituvas kultuuris kasvamisega.[34]
3D-rakukultuur
[muuda | muuda lähteteksti]3D-rakukultuuri puhul püütakse kasvatada rakud ruumilise tihedama kogumina, mis peaks paremini jäljendama kehasisest olukorda (kuigi ka see mudel süsteem ei ole täiuslik: näiteks paiknevad organismis ühe koe rakkude lähinaabruses sageli ka teiste kudede rakud, on toimiv immuunsüsteem ja hormonaalne regulatsioon jms). 3D-rakukultuuris eristatakse omakorda ankurdatud, ankurdamata ning mikrovedelikundust (mikrofluiidikat) kasutavaid süsteeme.[35]

Ankurdatud süsteemide korral kasvatatakse rakud 3D-võrgustikku (st toestavat struktuuri) moodustavas materjalis, mis võib olla kas bioloogilise (nt alginaat, želatiin jt) või sünteetilise päritoluga (nt polüetüleenglükoolil põhinev hüdrogeel). Ankurdamata süsteemides toimub rakkude omavahelisel kleepumisel tekkinud klastrite (nn sferoidide) kasvatamine suhteliselt väikeses rakusöötme ruumalas. Tehniliste lahendustena kasutatakse näiteks hüdrofoobse pinnaga mikrotiiterplaate, millele rakud ei kinnitu, või rakkude kasvatamist rippuva tilga meetodil. Mikrovedelikundusega seotud lähenemiste puhul kasvatatakse rakud mikrokiibi süvendites, milleni viib kapillaaride võrgustik. Sel viisil püütakse jäljendada füsioloogilist vereringet ja veresoonte võrgustikku, mille kaudu nii toitained kui ka hapnik jõuavad elundite sisemusse (organismi kontekstis) või kiipelundi (inglise keeles organ-on-a-chip) puhul sferoidi sisemusse.
Rakkude kooskultiveerimine
[muuda | muuda lähteteksti]Mitmed hiljutised baasteaduslikud ja rakenduslikud uuringud rakukultuuris on näidanud ka rakkude kooskultiveerimise vajadust, mida on hakatud mõnedes teaduslaborites ka ellu viima. Näiteks on rõhutatud kooskultiveerimise relevantsust organismi immuunvastuse uuringute[36] ja sünteetilise bioloogia tehnikate[37] puhul. Tehniliselt teostatakse kooskultiveerimine kas rakkude n-ö kokkusegamisel ühes kasvatamisnõus või rakkudevahelise kontakti tagamisega söötme kaudu.[4] Viimasel juhul kasutatakse kas spetsiaalseid nõusid, mille puhul on kaks kultiveeritavat rakutüüpi eraldatud membraaniga (see laseb läbi vaid teatud rakusöötmesse sekreteeritavaid komponente, kuid mitte rakke), või söötmete ülekandmist eraldatud kasvatamisanumate vahel. Kooskultiveerimine on kombineeritav muude rakukultuuris kasutatavate võtetega[36] (nt vaata eespool alapealkiri 3D-rakukultuur).
Olulisemad toimingud rakukultuuris
[muuda | muuda lähteteksti]Rakukultuurile on omane rakkude (eriti rakuliinide) passeerimine ehk edasitõstmine, mille käigus hõrendatakse rakkude arv pindala- või ruumalaühiku kohta. Passeerimise tulemusena tekib ka genotüübi (kromosoomide komplekti) ja fenotüübi (välimuse ja funktsiooni) poolest ühtlasem ehk homogeensem rakkude kogum.[38]
Teadusharidusega seotud platvormid ja ka mitmed firmad, mille toodete kataloogis on tooted rakukultuuri jaoks, pakuvad virtuaalseid koolitusi rakukultuuri rutiinsete toimingute treenimiseks online-režiimis.[39][40]
Passeerimine
[muuda | muuda lähteteksti]
Suspensioonikultuuri hõrendamiseks teostatakse olemasoleva suspensiooni lahjendus värskesse rakusöötmesse uues kolvis/pudelis. Kinnituva kultuuri puhul tuleb rakud võta pinna küljest lahti (polü-L-lüsiiniga kaetud pindade puhul kasutatakse selleks trüpsiini), lahjendada saadud suspensioon samuti värskesse söötmesse ning kanda rakud üle kasutamata nõusse, mille pinnale saavad rakud ajapikku taas kinnituda.

Passeerimisel on kombeks üles märkida passaaži number (ehk mitmel korral on rakke hõrendatud) ja lahjendusfaktor (ehk passeeritava suspensiooni ruumala ja värske söötme ruumala suhe). Rakkude passeerimise sagedus oleneb rakkude jagunemise kiirusest: mida kiiremini rakud jagunevad, seda sagedamini tuleb neid passeerida. Lahjendusfaktori valikul tuleb silmas pidada, et rakkude liiga suure ruumilise tiheduse või pinnatiheduse puhul kuluvad toitained kiiresti ära ning rakkudel võib esineda ka nn kontaktinhibeerimist.[41] Samas liiga suure lahjenduse korral rakkudevaheline "suhtlus"[42] (nt kasvufaktorite ja muude signaalide vahetamine lähinaabritega) häirub, mis viib samuti rakkude kasvutempo aeglustumiseni.
Külmutamine
[muuda | muuda lähteteksti]
Kui rakke ei soovita aktiivselt kultuuris hoida, kuid neid plaanitakse kasutada tulevikus, siis saab rakke külmutada spetsiaalses söötmes ning säilitada temperatuuridel –80 °C või alla selle (nt vedelas lämmastikus).[43][44][45] Külmutussööde kaitseb rakke jääkristallide tekke eest, mis lõhuksid rakkude plasmamembraani ja sisemust mehaaniliselt ära. Enamasti koosneb külmutussööde rakkude kasvusöötmest, milles suurendatakse toitainete hulka (nt veise looteseerumi lisamise kaudu) ja millele lisatakse ruumala järgi 5–10% dimetüülsulfoksiidi (rakukultuuri puhtusega). Rakkude töötlemisel külmutussöötmega tuleb silmas pidada, et dimetüülsulfoksiid võib toatemperatuuril põhjustada rakumembraani komponentide lahustumist. Kirjanduses leidub vasturääkivat infot rakkude külmutamise mõjust rakkude passaažinumbrile, kuid igal juhul on soovitatav külmutada võimalikult madala passaažinumbriga rakke.
Rakutüübid päritolu ja modifitseerimise alusel
[muuda | muuda lähteteksti]Rakukultuuris võivad kasvada nii primaarsed rakud kui ka rakuliinid:
- Primaarsed rakud on rakud, mida ei ole varem kultuuris pikaaegselt hoitud, ehk mis on organismist saadud proovist suhteliselt värskelt eraldatud. Värskuse suhtelisus tähendab antud juhul seda, et koeproove võib enne primaarrakkude eraldamist säilitada üsna pikka aega (aastate skaalal) külmutatud kujul, sarnaselt eespool rakkude jaoks kirjeldatud protseduuriga.
- Rakuliinide rakud on algselt samuti pärit elusorganismidest saadud koeproovidest, kuid neid rakke on juba pikemalt kultiveeritud. Enamasti tähendab see, et rakud on ka lähtematerjaliga võrreldes geneetiliselt muundatud, kindlustamaks nende pidevat jagunemist. Sellist protsessi nimetatakse immortaliseerimiseks (immortalization).
Primaarsed rakud
[muuda | muuda lähteteksti]Inimese primaarrakkude allikaks on enamasti kas luuüdi proov või mõne operatsiooni (nt vähkkasvaja kirurgiline eemaldamine, aga ka laparoskoopia) või lahkamise käigus saadud koetükk.
Luuüdi proovist eraldatakse huvipakkuvad rakud näiteks voolutsütomeetria abiga.[46] Primaarrakkude saamiseks koetükist tuleb seda töödelda viisil, mis lagundab ekstratsellulaarse maatriksi tihedat võrgustikku.[47] Selleks kasutatakse nii mehaanilist lagundamist (nt skalpelliga), ensümaatilist lagundamist (nt kollagenaasiga), keemilist töötlust (nt etüleendiamiintetraatsetaadiga) kui ka nende kombinatsioone. Kuna tahked koeproovid sisaldavad sageli mitmesuguseid rakutüüpe, tuleb rakkude kindla populatsiooni eraldamiseks rakendada sageli lisavõtteid, mis mõnevõrra sarnanevad afiinsuskromatograafiaga. Näiteks saab kasutada magnetosakesi,[48] mille pinnale on kinnitatud selektiivsust sidumist tagavad molekulid (nt antikehad): need seostuvad vaid teatud rakkude pinnal esinevate retseptorite külge, võimaldades just selliste rakkude "väljapüüdmist" proovist.
Primaarsete rakkude kultuuri puhul tuleb enamasti arvestada asjaoluga, et need rakud ei jagune piiramatult: juba mõne passaaži järel toimub rakkude kasvu ja jagunemise kiiruse järsk langus. Erandiks on mõned vähirakud, näiteks sellised, kus on ekspresseerunud ensüüm telomeraas. Telomeraas hoiab ära telomeeride lühenemise (see on vaikimisi rakkudesse programmeeritud mehhanism, mis on seotud normaalse vananemisega ja mida nimetatakse ka bioloogiliseks kellaks). Täiskasvanud organismi enamiku kudede terved rakud ei ekspresseeri telomeraasi, kuid seda leidub embrüonaalsetes tüvirakkudes ja ka mõningates vähirakkudes.[49]

Primaarseid rakke peetakse füsioloogiliselt relevantsemaks mudelsüsteemiks kui rakuliine, sest primaarrakud säilitavad rohkem elusorganismis kasvavatele rakkudele omaseid jooni (nt östradiooli tootmise võime munasarja granuloosarakkude puhul[50] või detsidualiseerumise võime endomeetriumist eraldatud stroomarakkude puhul[11]). Samas tuleb primaarsete rakkudega töötamisel arvestada tulemuste suurema varieeruvusega, mis on tingitud rakkude doonorispetsiifilistest erinevustest.[11][51]
Rakuliinid
[muuda | muuda lähteteksti]Immortaliseerimiseks[52] viiakse rakkude genoomi püsivalt sisse (nn püsitransfektsiooni tehnikaga[53]) kas telomeraasi katalüütilise alaühiku geen (hTERT) või Polyomaviridae perekonna viiruseliigi ahviviiruse 40 (SV40) T-antigeen. hTERT toimemehhanism on kirjeldatud eespool (vt alapealkiri Primaarsed rakud). SV40 T-antigeeni toimemehhanism on lõplikult ebaselge, kuid selles mängib rolli SV40 T-antigeeni seostumine kasvajate supressorvalkude p53 ja Rb külge, millega kaasneb rakkude programmeeritud surma ehk apoptoosi mahasurumine.[54]

Suur osa kommertsiaalselt kättesaadavatest rakuliinidest ei pärine tervetest kudedest, vaid vähkkasvajatest. Sellest tingituna esineb nendel rakkudel sageli polüploidia, anomaalne kasvajate supressorvalkude ja onkogeensete valkude ekspressioonitase ja muud vähirakkudele omased tunnused.[55][56] Seepärast ei sobi sellised rakuliinid üldjuhul terve koe rakkude mudeliks.
Vaatamata sellele, et rakuliinide hoidmisel kultuuris on neid teoreetiliselt võimalik passeerida piiramatu arv kordi, eelistatakse siiski töötada rakkudega, mille passaažinumber on võimalikult madal. Mõnikord kasutatakse piiranguna 20 passeerimist, kuigi selle piirangu jälgimine ei ole alati tehniliselt võimalik (eriti kommertsiaalselt kättesaadavate rakuliinide puhul). Näiteks vähirakkudele omane DNA parandusmehhanismide ja rakutsükli kontrollpunktide vigasus[57][58] tingib rakkude genoomi ebapüsivust, mistõttu ühes laboris korduvalt passeeritud rakud võivad oluliselt erineda teise labori omadest või algsest rakuliinist. Samuti on näidatud, et sama rakuliini hilisem passaaž võib varasema passaažiga võrreldes omada teistsugust kasvutempot ning madalamat tundlikkust rakutsükliga seotud bioloogiliste sihtmärkide inhibiitorite suhtes.[7]
Mitmetes teadusajakirjades on autoritele suunatud avaldamisnõuete seas mainitud vajadus käsikirjas kasutatud rakuliine autentida,[59] näitamaks rakuliini päritolu kehtivust ja saastatuse puudumist. Enamasti pakuvad rakuliinide autentimist kommertsiaalse teenusena samad firmad, kust on võimalik rakuliine teadustöö tarbeks ka osta: näiteks American Type Culture Collection (ATCC), The Leibniz Institute DSMZ - German Collection of Microorganisms and Cell Cultures GmbH (DSMZ) või European Collection of Authenticated Cell Cultures (ECACC).
Ohutusnõuded
[muuda | muuda lähteteksti]
Rakukultuuris on eriti oluline pöörata tähelepanu ohutus- ja puhtusnõuete täitmisele, mis tagavad ühelt poolt eksperimentaatori ja teiselt poolt rakkude heaolu.[16]
Eksperimentaatori ohutus
[muuda | muuda lähteteksti]Imetajate rakuliinid ja eriti primaarsed rakud võivad olla bioloogiliste ohtude allikaks, kuna nende kaudu võivad edasi kanduda inimest nakatavad viirused, mis pärinevad kas algsest organismist või on sisse viidud rakuliinide immortaliseerimise käigus. Näiteks inimese emakakaelavähi rakuliin HeLa sisaldab inimese papilloomiviirust 18 (HPV-18).[60] Inimese embrüo neerudest saadud rakuliin HEK293 immortaliseeriti aga 1973. aastal, kasutades adenoviiruse Ad5 fragmenti; seepärast võib HEK293 rakkude transfekteerimisel adenoviirusel põhinevate vektoritega toimuda rekombinatsioon, mille tulemuseks on nakatamisvõimelise adenoviiruse teke.[34][61]
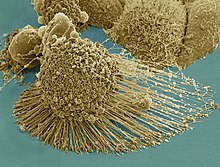
Potentsiaalse bioloogilise ohuga seotud objekte tuleb Euroopa Liidus käsitleda vastavuses direktiivis 2000/54/EC mainitud bioohutusreeglitega.[62] Seejuures eristatakse töötamisel bioohutuse erinevaid tasemeid (BSL), mis on seotud potentsiaalse haigustekitaja hinnangulise ohtlikkusega. Bioohutuse madalaim tase on 1 (BSL1: hästi iseloomustatud bioloogilised objektid, mis ei ole võimelised tekitama tervete täiskasvanute haigestumist) ning kõrgeim tase 4 (BSL4: bioloogilised objektid, mis levivad aerosoolina ja võivad põhjustada potentsiaalselt surmavat haigust, millele puudub teadaolevalt ravi või vaktsiin). Selleks, et teaduslabor kvalifitseeruks töötama teatud BSL tasemel, peab olema tagatud sobiv varustatus (sh ventilatsioonisüsteemid, eraldatus ehitise muudest ruumidest jms) ja töötajate väljaõpe. Tüüpiliste imetajate rakukultuuris kasvatatavate rakkudega töötamisel kehtivad enamasti BSL1 või BSL2 nõuded, kuid kui rakukultuuri kasutatakse ohtlikumate patogeenide uurimiseks, võib olla vajalik ka kõrgem BSL tase. Seejuures juba BSL2 rakuliinide ostmisel peab ostja enamasti tõendama labori vastavust BSL2 reeglitele ning kirjutama alla materjalide üleandmise lepingule (inglise keeles material transfer agreement ehk MTA), mis välistab soetatud materjali edasise levitamise kõrvalistele isikutele.
Puhtuse tagamine rakukultuuris
[muuda | muuda lähteteksti]Kuna toitainerikas rakusööde on suurepärane kasvukeskkond ka bakteritele ja pärmseentele, tuleb loomsete rakkude kasvatamisel rangelt täita steriilse töö nõudeid[32][39]:
- Rakuruumis tuleb kasutada laborikitlit, kaitsekindaid ja vahetusjalatseid.
- Pinnad, millele asetatakse kinnised nõud rakkude või rakusöötmega, peavad olema puhastatud etanooli või muu sobiva desinfitseeriva vahendiga.
- Rakkude, rakusöötme ja muude rakukultuuris kasutatavate lahustega anumaid tohib avada ainult töötavas bioohutuskapis ehk laminaari all. Laminaari all töötades eeldatakse vaikimisi, et steriilne on ainult laminaari õhk, kuid mitte pinnad (millele võib sattuda lahuste pritsmeid, laborikitli niite, tolmu vms).
- Rakukultuuris kasutatavat ühekordset plastikut (nt plaadid, pipetiotsikud, tsentrifuugituubid), lahuseid (nt rakusöötmed, puhverlahused) ja korduvkasutatavaid laborivahendeid (nt automaatpipetid, statiivid) tuleb enne tööd kas autoklaavida või steriliseerida UV-kiirguse abil. Paljud firmad müüvad rakukultuuri jaoks tarvikuid ja reagente, mis on gamma- või röntgenikiirgusega eelnevalt steriliseeritud ja hermeetiliselt pakendatud.
- Rakkude kasvatamiseks kasutatavaid inkubaatoreid tuleb regulaarselt puhastada tootja manuaalis kirjeldatud viisil ja vahetada välja vesi inkubaatori veevannis. Sageli lisatakse nii inkubaatori veevanni kui ka rakusöötmete soojendamiseks kasutatavasse veevanni spetsiaalseid lisandeid, mis pärsivad bakterite ja pärmseente kasvu; inkubaatori puhul tuleb jälgida, et lisand ei oleks aurustuv ega takistaks rakkude kasvu.
- Korduvkasutatavaid vahendeid (nt kolvid suspensioonikultuuri jaoks) tuleb pärast kasutamist puhastada pehme detergendiga ja seejärel rohke veega. Sageli kasutatakse enne detergendiga pesu ka desinfitseerivaid lahuseid, sh pleegiteid.
- Rakukultuuris tekkivaid vedelaid ja tahkeid jääke kogutakse, desinfitseeritakse ja käsitletakse bioloogiliselt ohtliku prügina.
Vaatamata rangetele nõuetele võib bioloogiline saastatus ikkagi tekkida.
Bioloogiline saastatus
[muuda | muuda lähteteksti]Saastatuse likvideerimiseks rakukultuuris on olemas üldised protokollid, mis võivad varieeruda olenevalt bioohutustasemest ja konkreetse labori eripäradest. Enamasti tuleb likvideerida kõik saastunud rakud (harvem rakendatakse näiteks antibiootikumravi, sest see võib viia nn peidetud saastatuseni) ja rakud, mis on kasvanud nende vahetus läheduses (kui saastatuse märke pole esialgu näha, võib sellised rakud asetada mõneks ajaks ka nn karantiiniinkubaatorisse). Paljude inkubaatorite tootjad võimaldavad kasutada oma aparaatides ka kuumutustsüklit (inglise keeles decontamination cycle) või pikaaegset UV-töötlust. Olenevalt saastatuse mastaapidest ja esinemise sagedusest võib tekkida vajadus ka põhjalikuma puhastusprotseduuri järele, mis hõlmab näiteks ruumide osoneerimist.

Tugev saastatus enamiku bakterite või pärmseentega on tuvastatav visuaalse vaatluse teel: rakusööde muutub häguseks, söötmes sisalduva indikaatori värvus muutub kollakaks, rakkude elumus väheneb järsult. Mõned saastatuse liigid võivad aga püsida rakukultuuris pikka aega märkamatult, eriti rakuliinide kasvatamisel. Tuntud probleemiks on näiteks mõni mükoplasma liik[63]; värsket statistikat on teaduskirjanduses raske leida, kuid üle 10 aasta vanuste uuringute tulemused on näidatud, et tol ajal oli maailma teaduslaborites mõne mükoplasma liigiga saastunud kuni 35% (kohati ka kuni 80%) kasutatavatest rakuliinidest.[64] Mükoplasma ei põhjusta drastilist elumuse muutust imetajarakkude populatsioonis, kuid mõjutab oluliselt saastunud rakkude ainevahetust, plasmamembraani läbitavust, tundlikkust tsütotoksilistele ühenditele jms.[65] Seepärast soovitatakse regulaarselt kontrollida, ega rakukultuuris esine mükoplasmaga saastatust. Seda kontrolli võib tehniliselt teostada nii selektiivsete (nt PCR-test) kui ka üldisemate meetodite abil[63] (nt fikseeritud rakkudes DAPI värvingu lokalisatsiooni jälgimine).
Muud saastatuse liigid ja riskid
[muuda | muuda lähteteksti]Lisaks saastatusele bakterite või pärmseentega on üheks ohuks rakukultuuris mitmete rakuliinide kasvatamisel ristsaastatuse (inglise keeles cross-contamination) teke,[66][67] kus toimub ühe rakuliini soovimatu ülekanne teise rakuliini kasvukeskkonda. Näiteks on teatatud juhtumitest, kus mitmed rakuliinid on saastunud kiirekasvuliste HeLa rakkudega, mis on rakukultuuris hoidmise käigus ajapikku asendanud algset rakuliini.[68] Ristsaastatuse tuvastamiseks on kindlaim viis viia läbi kasutatava rakuliini autentimine (vt eespool alapealkiri Rakuliinid).
Eraldi saastatuse liigina käsitletakse rakukultuuris ka saastatust endotoksiinidega: need on bakteriaalse päritoluga lipopolüsahhariidid, mis on vastupidavad kõrge temperatuuri suhtes.[69] Rakkude tundlikkus endotoksiinide suhtes on väga varieeruv, kuid on näidatud, et endotoksiinid võivad mõjutada rakkude elumust ja jagunemist, samuti rakumembraanide omadusi jpm.[70] Endotoksiinid võivad kanduda edasi nii vedelike kui ka pindade kaudu, seepärast on rakukultuuris oluline kasutada lahuseid ja vahendeid, mille puhul on tootja garanteerinud endotoksiinidega saastatuse puudumist.
Lisaks bioloogilisele saastatusele eristatakse rakukultuuris ka teisi saastatuse liike[71]: näiteks vee saastatus raskmetallide või orgaaniliste kemikaalidega, puhverdamiseks kasutatava CO2 saastatus teiste gaasidega jms.
Rakukultuuriga seotud eetilised aspektid
[muuda | muuda lähteteksti]Põhilisi eetilisi probleeme ja kitsaskohti, mis seostuvad rakukultuuris kasutatavate objektidega, võib liigitada vastavalt rakkude päritolule: kas tegemist on embrüost eraldatud rakkudega, täiskasvanud inimese organismist pärit rakkudega või muude loomade organismist pärit rakkudega.
Embrüonaalsete tüvirakkudega seotud eetikaküsimused
[muuda | muuda lähteteksti]Embrüote tüvirakud on erilised, sest nendest tekivad edasise diferentseerumise käigus kõigi teiste kudede rakud. Seega on embrüonaalsed tüvirakud unikaalseks mudelsüsteemiks, mis võimaldab uurida organismi arengut ja luua uusi lahendusi regeneratiivse meditsiini jaoks. Neid tüvirakke eraldatakse blastotsüsti staadiumis (5–7 päeva vanustest) embrüotest, mida saadakse kehavälise viljastamise teel. Eetika-alased diskussioonid embrüote tüvirakkude kohta taanduvad suuresti sellele, kas blastotsüsti võib/tuleb käsitleda sündimata lapsena või mitte.[72][73]
Euroopa Liidus on ametlikud regulatsioonid tüvirakkudega seotud teadustöö kohta riigiti erinevad.[74] Eestis allub embrüonaalsete tüvirakkudega seotud uurimistöö kunstliku viljastamise ja embrüokaitse seadusele,[75] mille kohaselt võib teadustööks kasutada embrüot, mida ei ole kunstliku viljastamise edukuse nimel või lapse ja ema tervise huvides naisele üle kantud, ning samuti embrüot, mis on osutunud liigseks seaduses defineeritud kriteeriumite alusel. Embrüo kasutamiseks teaduslikuks uurimistööks peab olema isikute nõusolek, kellelt sugurakud pärinevad.
Lahendusena embrüonaalsete tüvirakkudega seotud probleemidele on pakutud välja indutseeritud pluripotentsete tüvirakkude (iPSC-d) kasutamist teadustöös. iPSC-d saadakse täiskasvanud doonorite mitmetest kehakudedest (nt nahk või veri) eraldatud rakkude geneetilisel muundamisel, mis võimaldab vältida embrüote ex utero hävitamisega seotud eetikaprobleeme. Samas on näidatud, et iPSC-d on geneetiliselt oluliselt erinevad, võrreldes embrüonaalsete tüvirakkudega, mistõttu ei pruugi viimased olla iPSC-dega täielikult asendatavad.[76]
Täiskasvanud inimorganismist pärineva bioloogilise materjaliga seotud eetikaküsimused
[muuda | muuda lähteteksti]Täiskasvanud doonorite primaarrakkude, aga ka rakuliinide lähtematerjali kogumine on tänapäeval reguleeritud eetikanormidega, mis on muutunud rahvusvaheliseks standardiks.[77] Täpsemalt tuleb proovide kogumisel, töötlemisel ja säilitamisel lähtuda inimestel tehtavate meditsiiniuuringute eetilistest põhimõtetest, mida sõnastati Maailma Arstide Liidu (WMA) Helsingi deklaratsioonis 1964. aastal.[78] Näiteks:
- Enne doonorite kaasamist teadusuuringusse peab olema sõnastatud uuringu detailne protokoll, mis kirjeldab muuhulgas tehtava uuringu põhimõtteid, teaduslikku taustinfot, rahastust, kogutud andmete töötlemise põhimõtteid ja tagasiside andmist doonoritele. Protokolli peab olema kinnitanud eetikakomitee (nt Eestis võib valida Tartu Ülikooli inimuuringute eetika komitee ja Tervise Arengu Instituudi inimuuringute eetikakomitee vahel).
- Peab olema tagatud uuringutes osalevate isikute privaatsus ja nendega seotud uuringu jaoks kogutud info konfidentsiaalsus. Isikuandmete säilitamise ja anonümiseerimise aspekt on eriti oluline ka biopankade loomisel.[79][80]
- Doonorlus peab olema vabatahtlik ja iga doonor peab kinnitama oma informeeritud nõusolekut uuringus osalemise kohta. Kui doonor ei ole võimeline informeeritud nõusolekut andma, peavad seda tegema tema seaduslikud esindajad; sellisel juhul peab doonori seisund olema uuringus osalemise kindlaks kriteeriumiks.
Juba arendatud rakuliinide ostmiseks ametlikest allikatest ja nende kasutamiseks oma teadustöös ei pea ostja taotlema eetikakomitee luba.
Rahvusvahelise avalikkuse teadlikkus rakukultuuriga seotud eetikaküsimuste suhtes on oluliselt tõusnud pärast tõsielusündmustel põhineva raamatu "The Immortal Life of Henrietta Lacks" (autor Rebecca Skloot) ilmumist 2010. aastal. Henrietta Lacksi 1951. aasta vähibiopsiast eraldatud rakkude alusel loodi teadaolevalt esimene rakuliin HeLa, mis on edaspidi leidnud intensiivset rakendust teaduslaborites üle maailma. Samas ei küsitud Henrietta Lacksi käest nõusolekut tema bioloogilise materjali kasutamiseks teadustöös ning rakuliini loomisest ei teavitatud ka doonori seaduslikke järglasi[81] (kuni infolekkeni 1970. aastatel, mil selgus doonori nimi). 2021. aasta 4. oktoobril, täpselt 70 aastat pärast Henrietta Lacksi surma, esitasid doonori järeltulijad kohtuhagi firma Thermo Fisher Scientific vastu, kes on teeninud kasumit HeLa rakuliini müügist.[82]
Loomse päritoluga bioloogilise materjaliga seotud eetikaküsimused
[muuda | muuda lähteteksti]Koeproovide võtmine katseloomadest, mis on vajalik primaarsete rakkude eraldamiseks ja rakuliinide arendamiseks, allub loomkatsete jaoks kehtestatud eetikastandarditele.[83][84][85] Kehtiv Euroopa Liidu direktiiv 2010/63/EL[86] sätestab järgmist:
- Elusloomade kasutamine katsetes on soovitav asendada muude meetoditega. Euroopa Liidu komisjon ja liikmesriigid peaksid aitama teadusuuringute ja muude vahenditega kaasa alternatiivsete meetodite väljatöötamisele ja valideerimisele.
- Kui katseloomade kasutamine on vältimatu, siis teadustöös peaks kasutama meetodit, mis võimaldab saavutada kõige rahuldavamaid tulemusi ja põhjustab tõenäoliselt kõige vähem valu, kannatusi ja stressi.
- Väljavalitud meetodid peaksid kasutama minimaalset arvu katseloomi, mis on vajalik usaldusväärsete tulemuste saamiseks, ja peaksid nõudma selliste loomaliikide kasutamist, kelle võime tunda valu, kannatusi ja stressi on madalaim ning kellele põhjustatavad püsivad kahjustused on kõige väiksemad.
- Väljavalitud meetodid peaksid võimaluse korral vältima lõpp-punktina surma.
Sarnaselt inimuuringutega tuleb ka loomkatseteks taotleda luba.[87]
Kui loom hukatakse muudel põhjustel (nt tegemist on põllumajandusloomaga) ja koeproovid teadusuuringu jaoks saadakse hukatud loomalt, siis ei ole Eesti loomakaitseseaduse kohaselt tegemist katseloomaga. Katseloom on "lubatud teaduslikul või hariduslikul eesmärgil läbiviidavas loomkatses kasutatav, loomkatses kasutamiseks või kudede ja elundite saamiseks kasvatatud".[85] Seega ei vaja Eesti seaduste järgi eetikaluba selline teadusuuring, kus kasutatakse muul põhjusel hukatud looma bioloogilist materjali. Enamasti saadakse see materjal tapamajast; ingliskeelses teaduskirjanduses kasutatakse sellisel juhul väljendit slaughterhouse/abattoir-collected tissues. Riigiti on aga vastavad seadused erinevad. Näiteks USAs[88] ja Austraalias[89] ei ole muul põhjusel hukatud loomade bioloogilise materjali kasutamiseks teadustöös eetikaluba samuti vaja, samas Lõuna-Aafrika Vabariigi[90] seaduste kohaselt tuleb eetikaluba siiski taotleda. USAs on küll laialdaselt arutletud teadlaste ja tapamajade koostöö eetilisuse üle, eriti juhul, kui tegemist on mahukate teadusuuringutega.[91]
Rakukultuuris võivad loomse päritoluga olla mitte ainult kasvatatavad rakud, vaid ka rakusöötme lisandid. Väga levinud on näiteks veise looteseerumi ehk FBS kasutamine (vt ka eespool alapealkiri Toitained), mis sisaldab mitmeid toitvaid ja rakkude kasvu soodustavaid komponente[92] (sh albumiin, kasvufaktorid, alipoproteiinid). FBS on lihatööstuse kõrvalprodukt – seda toodetakse, kasutades tapamajja viidud tiinetest lehmadest pärit looteid. Lehma emakast eraldatud loote südamesse sisestatakse nõel, mis on ühendatud koagulanti sisaldava kogumisanumaga; kuna loode ei ole seejuures anesteesiat saanud, võib see protseduur põhjustada suuri kannatusi enne loote paratamatut surma.[93] FBS tootmisega seotud eetilised probleemid ning ka FBS eri partiide kvaliteedi ja koostise varieeruvus, mis põhjustab varieeruvust ka katsetes FBS juuresolekul kasvatatud rakkudega,[94] on põhjuseks, miks on mitmetes teaduslaborites võetud suund nn seerumivabade söötmete kasutamisele.[95] FBS asendusena on pakutud ka kindla kvantitatiivse koostisega asenduslisandeid nagu UltroSer G.[96]
Rakukultuuriga seotud märksõnade kasutamise statistika
[muuda | muuda lähteteksti]Teema kokkuvõtteks on allpool esitatud statistikat teaduskirjanduse andmebaasi PubMed põhjal, näitamaks rakukultuuriga seotud märksõnade kasutamise sagedust teadusartiklites eri aastatel. Keskendutud on just antud Vikipeedia artiklis esinevatele terminitele. PubMed on USA Rahvusliku Terviseinstituudi (National Institutes of Health, NIH) hallatud avalik andmebaas, mis refereerib eelistatult meditsiini-, bioloogia- ja biokeemiauuringutega seotud teadusajakirju. 2022. aasta seisuga sisaldab PubMed üle 34 miljoni viite teadusartiklitele, mis on ilmunud alates aastast 1946[97] (mõningad viited pärinevad ka varasemast ajast, kuid ajakirju pole enne 1946. aastat süstemaatiliselt refereeritud).
Terminite otsing sai tehtud 5.–6. novembril 2022. Statistika on esitatud jooniste vormis ning väljavõte samast statistikast on esitatud ka tabeli vormis, et illustreerida paremini vanemate teadusartiklite panust (- tähistab, et vastava märksõnaga pole aasta jooksul kunagi nii palju artikleid avaldatud). Võrdluseks on tabelisse lisatud andmed ka märksõnade kohta, kus termin culture (kultuur) pole otsingusse lisatud (näitamaks, et see mõnevõrra muudab otsingut). 2022. aasta puhul esinev süstemaatiline langustrend on seotud asjaoluga, et otsing teostati enne aasta lõppu, seega ei kajastu selle aasta statistikas kõik relevantsed teadustööd (mis võivad olla teadusajakirja avaldamiseks vastu võetud, kuid pole veel ilmunud).
-
Märksõnadeks on rakukultuuris kasvatatavate rakkude tüübid
-
Märksõnad on seotud tüvirakkudega. Tuleb tähele panna, et y-telg on katkendlik
-
Märksõnad on seotud saastatusega rakukultuuris. Tuleb tähele panna, et y-telg on katkendlik
-
Märksõnad on seotud tingimuste ja võtetega, mida saab kasutada rakkude kasvatamisel rakukultuuris. Tuleb tähele panna, et y-telg on katkendlik
| Otsitud märksõnad | Otsitud märksõnad tõlkes eesti keelde | Aasta, mil märksõna esines esimest korda PubMedi andmebaasis | Aasta, mil märksõna sisaldavate artiklite arv ületas esmakordselt 10 (aasta jooksul) | Aasta, mil märksõna sisaldavate artiklite arv ületas esmakordselt 100 (aasta jooksul) | Aastav, mil märksõna sisaldavate artiklite arv ületas esmakordselt 1000 (aasta jooksul) | Aasta, mil märksõna sisaldavate artiklite arv ületas esmakordselt 10 000 (aasta jooksul) |
|---|---|---|---|---|---|---|
| Cell culture | Rakukultuur | 1905 | 1949 | 1958 | 1967 | 2003 |
| Primary cell culture | Primaarne rakukultuur | 1907 | 1963 | 1975 | 1995 | - |
| Primary cell | Primaarne rakk | 1896 | 1947 | 1962 | 1975 | 1999 |
| Cell line culture | Rakuliini kultuur | 1916 | 1955 | 1961 | 1970 | 2010 |
| Cell line | Rakuliin | 1916 | 1955 | 1959 | 1969 | 1989 |
| Cancer cell line culture | Vähi rakuliini kultuur | 1958 | 1964 | 1971 | 1989 | - |
| Cancer cell line | Vähi rakuliin | 1958 | 1964 | 1970 | 1984 | 2007 |
| Cell culture contamination | Rakukultuuri saastatus | 1913 | 1967 | 1989 | - | - |
| Cell culture Mycoplasma | Rakukultuur(is) mükoplasma | 1956 | 1965 | - | - | - |
| Stem cell culture | Tüvirakkude kultuur | 1911 | 1964 | 1977 | 1992 | - |
| Human embryonic stem cell culture | Inimese embrüonaalsete tüvirakkude kultuur | 1980 | 1992 | 2002 | - | - |
| Induced pluripotent stem cell culture | Indutseeritud pluripotentsete tüvirakkude kultuur | 1975 | 1996 | 2008 | 2016 | - |
| 3D cell culture | 3D-rakukultuur | 1968 | 1998 | 2013 | - | - |
| Hypoxia cell culture | Hüpoksia rakukultuuris | 1964 | 1973 | 1990 | 2012 | - |
| Serum-free cell culture | Seerumivaba rakukultuur | 1956 | 1973 | 1981 | - | - |
| Cell co-culture | Rakkude kooskultiveerimine | 1928 | 1967 | 1980 | 1997 | - |
Vaata ka
[muuda | muuda lähteteksti]Viited
[muuda | muuda lähteteksti]- ↑ Victor M. Loyola-Vargas, Felipe Vázquez-Flota (2006). "An Introduction to Plant Cell Culture". An Introduction to Plant Cell Culture (Book series Methods in Molecular Biology). Springer Link. Lk 3–8.
- ↑ Andrés Garzón, Juan Jimenez (2015). Yeast Cell Culture. eLS: Wiley.
- ↑ A Rouf, Varsha Kanojia, HR Naik, Bazilla Naseer, Tahiya Qadri (2017). An overview of microbial cell culture. Journal of Pharmacognosy and Phytochemistry: Society of Pharmacognosy and Phytochemistry. Lk 1923–1928.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ 4,0 4,1 Michelle A. M. Vis, Keita Ito, Sandra Hofmann (2020). Impact of Culture Medium on Cellular Interactions in in vitro Co-culture Systems. Frontiers in Bioengineering and Biotechnology: Frontiers.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Ye Fang, Richard M. Eglen (2017). Three-Dimensional Cell Cultures in Drug Discovery and Development. SLAS Discovery: Elsevier. Lk 456–472.
- ↑ Maris-Johanna Tahk, Jane Torp, Mohammed A S Ali, Dmytro Fishman, Leopold Parts, Lukas Grätz, Christoph Müller, Max Keller, Santa Veiksina, Tõnis Laasfeld, Ago Rinken (2022). Live-cell microscopy or fluorescence anisotropy with budded baculoviruses—which way to go with measuring ligand binding to M4 muscarinic receptors?. Open Biology: The Royal Society.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ 7,0 7,1 7,2 Darja Lavogina, Helen Lust, Maris-Johanna Tahk, Tõnis Laasfeld, Hans Vellama, Naila Nasirova, Markus Vardja, Kattri-Liis Eskla, Andres Salumets, Ago Rinken, Jana Jaal (2022). Revisiting the Resazurin-Based Sensing of Cellular Viability: Widening the Application Horizon. Biosensors: MDPI.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Sergei Kopanchuk, Edijs Vavers, Santa Veiksina, Kadri Ligi, Liga Zvejniece, Maija Dambrova, Ago Rinken (2022). Intracellular dynamics of the Sigma-1 receptor observed with super-resolution imaging microscopy. PLoS One: Public Library of Science.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Jurgita Matulienė, Gediminas Žvinys, Vytautas Petrauskas, Agnė Kvietkauskaitė, Audrius Zakšauskas, Kirill Shubin, Asta Zubrienė, Lina Baranauskienė, Lina Kačenauskaitė, Sergei Kopanchuk, Santa Veiksina, Vaida Paketurytė-Latvė, Joana Smirnovienė, Vaida Juozapaitienė, Aurelija Mickevičiūtė, Vilma Michailovienė, Jelena Jachno, Dovilė Stravinskienė, Aistė Sližienė, Agnė Petrošiūtė, Holger M Becker, Justina Kazokaitė-Adomaitienė, Ala Yaromina, Edita Čapkauskaitė, Ago Rinken, Virginija Dudutienė, Ludwig J Dubois, Daumantas Matulis (2022). Picomolar fluorescent probes for compound affinity determination to carbonic anhydrase IX expressed in live cancer cells. Scientific Reports: Nature.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Jean Livet, Tamily A Weissman, Hyuno Kang, Ryan W Draft, Ju Lu, Robyn A Bennis, Joshua R Sanes, Jeff W Lichtman (2007). Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature: Nature. Lk 56–62.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ 11,0 11,1 11,2 Darja Lavogina, Artjom Stepanjuk, Maire Peters, Külli Samuel, Sergo Kasvandik, Masuma Khatun, Riikka K Arffman, Erki Enkvist, Kaido Viht, Sergei Kopanchuk, Freddy Lättekivi, Agne Velthut-Meikas, Asko Uri, Terhi T Piltonen, Ago Rinken, Andres Salumets (2021). Progesterone triggers Rho kinase-cofilin axis during in vitro and in vivo endometrial decidualization. Human Reproduction: Oxford Academic. Lk 2230–2248.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Cary Matanguihan, Paul Wu (2022). Upstream continuous processing: recent advances in production of biopharmaceuticals and challenges in manufacturing. Current Opinion in Biotechnology: Elsevier.
- ↑ S Furkan Demirden, Kadir Alptekin, Ilgin Kimiz-Gebologlu, Suphi S Oncel (2022). Influenza Vaccine: An Engineering Vision from Virological Importance to Production. Biotechnology and Bioprocess Engineering: Springer Link. Lk 1–25.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Cindy Neeley (2015). "The importance of temperature for optimal cell health and growth". Thermo Fisher Scientific. Vaadatud 05.11.2022.
- ↑ Chang Shao-Hua, Sun Hong-Liang, Li Zuo-Hu (1998). Effect of Temperature Oscillation on Insect Cell Growth and Baculovirus Replication. Applied and Environmental Microbiology: ASM Journals.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ 16,0 16,1 European Collection of Authenticated Cell Cultures (ECACC) (2018). Fundamental Techniques in Cell Culture: Laboratory Handbook, 4th Edition (PDF). Sigma Aldrich. Originaali (PDF) arhiivikoopia seisuga 10. oktoober 2022. Vaadatud 5. novembril 2022.
- ↑ Annemarie Samalecos, Katja Reimann, Stefanie Wittmann, Heinrich M Schulte, Jan J Brosens, Ana-Maria Bamberger, Birgit Gellersen (2009). Characterization of a novel telomerase-immortalized human endometrial stromal cell line, St-T1b. Reproductive Biology and Endocrinology: BMC.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ "Corning® ITS+ Premix Universal Culture Supplement". Corning Life Sciences. Vaadatud 05.11.2022.
- ↑ Reet Link, Santa Veiksina, Maris-Johanna Tahk, Tõnis Laasfeld, Päärn Paiste, Sergei Kopanchuk, Ago Rinken (2019). The constitutive activity of melanocortin-4 receptors in cAMP pathway is allosterically modulated by zinc and copper ions. Journal of Neurochemistry: Wiley. Lk 346–361.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Fisher Scientific (2020). "Proper Care and Maintenance for a Cell Culture Incubator" (PDF). Thermo Scientific koduleht. Vaadatud 05.11.2022.
- ↑ Johanna Michl, Kyung Chan Park, Pawel Swietach (2019). Evidence-based guidelines for controlling pH in mammalian live-cell culture systems. Communications Biology: Springer Nature.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ C M Bowman, E M Berger, E N Butler, K M Toth, J E Repine (1985). HEPES may stimulate cultured endothelial cells to make growth-retarding oxygen metabolites. In Vitro Cellular & Developmental Biology: Springer Link. Lk 140–142.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ J. S. Zigler Jr., J. L. Lepe-Zuniga, B. Vistica, I. Gery (1985). Analysis of the cytotoxic effects of light-exposed hepes-containing culture medium. In Vitro Cellular & Developmental Biology: Springer Link. Lk 282–287.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Trenton L. Place, Frederick E. Domann, Adam J. Case (2017). Limitations of oxygen delivery to cells in culture: An underappreciated problem in basic and translational research. Free Radical Biology and Medicine: Elsevier. Lk 311–322.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Gibco Cell Culture Basics. "Useful Numbers for Cell Culture". Thermo Fisher Scientific. Vaadatud 05.11.2022.
- ↑ 26,0 26,1 S R McKeown (2014). Defining normoxia, physoxia and hypoxia in tumours—implications for treatment response. The British Journal of Radiology: The British Institute of Radiology.[alaline kõdulink]
- ↑ 27,0 27,1 E. M. Hammond, M.-C. Asselin, D. Forster, J. P. B. O'Connor, J. M. Senra, K. J. Williams (2014). The Meaning, Measurement and Modification of Hypoxia in the Laboratory and the Clinic. Clinical Oncology: Elsevier. Lk 277–288.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Danli Wu, Patricia Yotnda (2011). Induction and Testing of Hypoxia in Cell Culture. Journal of Visualized Experiments.
- ↑ Jiri Pavlacky, Jan Polak (2020). Technical Feasibility and Physiological Relevance of Hypoxic Cell Culture Models. Frontiers in Endocrinology: Frontiers.
- ↑ KOSHEEKA (10.09.2020). "Antibiotics In Cell Culture: Why To Avoid?". Advancells. Originaali arhiivikoopia seisuga 5.11.2022. Vaadatud 05.11.2022.
- ↑ Ann H. Ryu, Walter L. Eckalbar, Anat Kreimer, Nir Yosef, Nadav Ahituv (2017). Use antibiotics in cell culture with caution: genome-wide identification of antibiotic-induced changes in gene expression and regulation. Scientific Reports: Nature.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ 32,0 32,1 ECACC (2016). "Fundamental Techniques in Cell Culture: Laboratory Handbook, 3rd Edition" (PDF). Sigma-Aldrich. Originaali (PDF) arhiivikoopia seisuga 20.10.2022. Vaadatud 05.11.2022.
- ↑ ScienCell Research Laboratories (2019). "Choosing the Right Substrate". Vaadatud 05.11.2022.
- ↑ 34,0 34,1 Magdalena Malm, Rasool Saghaleyni, Magnus Lundqvist, Marco Giudici, Veronique Chotteau, Ray Field, Paul G. Varley, Diane Hatton, Luigi Grassi, Thomas Svensson, Jens Nielsen, Johan Rockberg (2020). Evolution from adherent to suspension: systems biology of HEK293 cell line development. Scientific Reports: Nature.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Sigrid A. Langhans (2018). Three-Dimensional in Vitro Cell Culture Models in Drug Discovery and Drug Repositioning. Frontiers in Pharmacology: Frontiers.
- ↑ 36,0 36,1 Adele De Ninno, Francesca Romana Bertani, Annamaria Gerardino, Giovanna Schiavoni, Martina Musella, Claudia Galassi, Fabrizio Mattei, Antonella Sistigu, Luca Businaro (2021). Microfluidic Co-Culture Models for Dissecting the Immune Response in in vitro Tumor Microenvironments. Journal of Visualized Experiments.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Lisa Goers, Paul Freemont, Karen M. Polizzi (2014). Co-culture systems and technologies: taking synthetic biology to the next level. Journal of the Royal Society Interface: The Royal Society.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter (2002). Molecular Biology of the Cell. 4th edition. Isolating Cells and Growing Them in Culture. New York: Garland Science.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ 39,0 39,1 Gibco Cell Culture Basics. "Gibco Cell Culture Basics: Virtual Lab". ThermoFisher Scientific. Vaadatud 05.11.2022.
- ↑ Labster. "Cell Culture Basics: Plate, split and freeze human cells Virtual Lab". Vaadatud 05.11.2022.
- ↑ Mariana Pavel, Maurizio Renna, So Jung Park, Fiona M. Menzies, Thomas Ricketts, Jens Füllgrabe, Avraham Ashkenazi, Rebecca A. Frake, Alejandro Carnicer Lombarte, Carla F. Bento, Kristian Franze, David C. Rubinsztein (2018). Contact inhibition controls cell survival and proliferation via YAP/TAZ-autophagy axis. Nature Communications: Nature.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Felix Scholkmann, Daniel Fels, Michal Cifra (2013). Non-chemical and non-contact cell-to-cell communication: a short review. American Journal of Translational Research: e-Century Publishing Corporation. Lk 586–593.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Stem Cell Technologies (2022). "Cryopreservation Basics: Protocols and Best Practices for Freezing Cells". Vaadatud 05.11.2022.
- ↑ ECACC Laboratory Handbook 4th Edition (2022). "Cryopreservation of Cell Lines". Sigma Aldrich. Vaadatud 05.11.2022.
- ↑ Abcam. "Cryopreservation of mammalian cell lines video protocol". Vaadatud 05.11.2022.
- ↑ Aravind Ramakrishnan, Beverly Torok-Storb, Manoj M Pillai (2013). Primary marrow-derived stromal cells: isolation and manipulation. Methods in Molecular Biology: Springer Link. Lk 75–101.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Magdalena Richter, Oliwia Piwocka, Marika Musielak, Igor Piotrowski, Wiktoria M Suchorska, Tomasz Trzeciak (2021). From Donor to the Lab: A Fascinating Journey of Primary Cell Lines. Frontiers in Cell and Developmental Biology: Frontiers.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Miltenyi Biotec (2022). "Magnetic cell separation techniques and reagents for pure target cells". Vaadatud 07.11.2022.
- ↑ Tomasz Trybek, Artur Kowalik, Stanisław Góźdź, Aldona Kowalska (2020). Telomeres and telomerase in oncogenesis. Oncology Letters: Spandidos Publications. Lk 1015–1027.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Anja Baufeld, Jens Vanselow (2018). A Tissue Culture Model of Estrogen-producing Primary Bovine Granulosa Cells. Journal of Visualized Experiments.
- ↑ Darja Lavogina, Nadja Visser, Külli Samuel, Eva Davey, Richelle D Björvang, Jasmin Hassan, Jani Koponen, Panu Rantakokko, Hannu Kiviranta, Ago Rinken, Matts Olovsson, Andres Salumets, Pauliina Damdimopoulou (2022). Endocrine disrupting chemicals interfere with decidualization of human primary endometrial stromal cells in vitro. Frontiers in Endocrinology: Frontiers.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Matt Carter, Jennifer C. Shieh (2010). Chapter 13 - Cell Culture Techniques. Guide to Research Techniques in Neuroscience: Academic Press. Lk 281–296.
- ↑ Agnieszka Fus-Kujawa, Pawel Prus, Karolina Bajdak-Rusinek, Paulina Teper, Katarzyna Gawron, Agnieszka Kowalczuk, Aleksander L Sieron (2021). An Overview of Methods and Tools for Transfection of Eukaryotic Cells in vitro. Frontiers in Bioengineering and Biotechnology: Frontiers.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Kris F.Sachsenmeier, James M.Pipas (2001). Inhibition of Rb and p53 Is Insufficient for SV40 T-Antigen Transformation. Virology: Elsevier. Lk 40–48.
- ↑ Zuzana Storchova, David Pellman (2004). From polyploidy to aneuploidy, genome instability and cancer. Nature Reviews Molecular Cell Biology: Nature. Lk 45–54.
- ↑ Halina Was, Agata Borkowska, Aleksandra Olszewska, Aleksandra Klemba, Marta Marciniak, Agnieszka Synowiec, ClaudineKieda (2022). Polyploidy formation in cancer cells: How a Trojan horse is born. Seminars in Cancer Biology: Ensevier. Lk 24–36.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Marikki Laiho, Leena Latonen (2003). Cell cycle control, DNA damage checkpoints and cancer. Annals of Medicine: Taylor & Francis. Lk 391–397.
- ↑ Alessandro Torgovnick, Björn Schumacher (2015). DNA repair mechanisms in cancer development and therapy. Frontiers in Genetics: Frontiers.
- ↑ Vivien Marx (2014). Cell-line authentication demystified. Nature Methods: Nature. Lk 483–488.
- ↑ Institutional Biosafety Committee, Office of Research Assurances (2022). "HeLa cell lines". Washington State University. Vaadatud 07.11.2022.
- ↑ Cody S. Lee, Elliot S. Bishop, Ruyi Zhang, Xinyi Yu, Evan M. Farina, Shujuan Yan, Chen Zhao, Zongyue Zeng, Yi Shu, Xingye Wu, Jiayan Lei, Yasha Li, Wenwen Zhang, Chao Yang, Ke Wu, Ying Wu, Sherwin Ho, Aravind Athiviraham, Michael J. Lee, Jennifer Moriatis Wolf, Russell R. Reid, Tong-Chuan Hec (2017). Adenovirus-mediated gene delivery: Potential applications for gene and cell-based therapies in the new era of personalized medicine. Genes & Diseases: Elsevier. Lk 43–63.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ European Parliament and Council (08.04.2021). "Directive 2000/54/EC - biological agents at work". European Agency for Safety and Health at Work. Vaadatud 07.11.2022.
- ↑ 63,0 63,1 V. M. Chernov, O. A. Chernova, J. T. Sanchez-Vega, A. I. Kolpakov, and O. N. Ilinskaya (2014). Mycoplasma Contamination of Cell Cultures: Vesicular Traffic in Bacteria and Control over Infectious Agents. Acta Naturae. Lk 41–51.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Laleh Nikfarjam, Parvaneh Farzaneh (2012). Prevention and Detection of Mycoplasma Contamination in Cell Culture. Cell Journal: Royan Institute. Lk 203–212.
- ↑ Hans G. Drexler, Cord C. Uphoff (2002). Mycoplasma contamination of cell cultures: Incidence, sources, effects, detection, elimination, prevention. Cytotechnology: Springer Link. Lk 75–90.
- ↑ Olivera Markovic, Nenad Markovic (1998). Cell cross-contamination in cell cultures: The silent and neglected danger. In Vitro Cellular & Developmental Biology - Animal: Springer Link. Lk 1–8.
- ↑ Amanda Capes-Davis, George Theodosopoulos, Isobel Atkin, Hans G Drexler, Arihiro Kohara, Roderick A F MacLeod, John R Masters, Yukio Nakamura, Yvonne A Reid, Roger R Reddel, R Ian Freshney (2010). Check your cultures! A list of cross-contaminated or misidentified cell lines. International Journal of Cancer: Wiley. Lk 1–8.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Brendan P Lucey, Walter A Nelson-Rees, Grover M Hutchins (2009). Henrietta Lacks, HeLa cells, and cell culture contamination. Archives of Pathology and Laboratory Medicine: College of American Pathologists. Lk 1463–1467.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Yang Li, Diana Boraschi (2016). Endotoxin contamination: a key element in the interpretation of nanosafety studies. Nanomedicine: Future Medicine. Lk https://www.futuremedicine.com/doi/10.2217/nnm.15.196.
- ↑ Michael E. Dawson (1998). "The Significance of Endotoxin to Cell Culture and Biotechnology" (PDF). LAL Update, Associates of Cape Cod Incorporated. Vaadatud 07.11.2022.
- ↑ John Ryan (2022). "Understanding and Managing Cell Culture Contamination" (PDF). Environmental Health and Safety, Florida State University. Vaadatud 07.11.2022.
- ↑ Bernard Lo, Lindsay Parham (2009). Ethical Issues in Stem Cell Research. Endocrine Reviews: Oxford Academic. Lk 204–213.
- ↑ EuroStemCell. "Embryonic stem cell research: an ethical dilemma". Vaadatud 06.11.2022.
- ↑ EuroStemCell. "Regulation of stem cell research in Europe". Vaadatud 06.11.2022.
- ↑ Riigikogu (27.06.2022). "Kunstliku viljastamise ja embrüokaitse seadus". Riigi Teataja. Vaadatud 06.11.2022.
- ↑ Kazim H Narsinh, Jordan Plews, Joseph C Wu (2011). Comparison of Human Induced Pluripotent and Embryonic Stem Cells: Fraternal or Identical Twins?. Molecular Therapy: Elsevier. Lk 635–638.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Tartu Ülikooli Eetikakeskus. "Inimuuringud". TÜ Eetikaveeb. Originaali arhiivikoopia seisuga 6.11.2022. Vaadatud 06.11.2022.
- ↑ World Medical Association (2022). "WMA Declaration of Helsinki: ethical principles for medical research involving human subjects". WMA. Vaadatud 06.11.2022.
- ↑ National Cancer Institute, Division of Cancer Treatment & Diagnosis (20.09.2017). "Ethics in Biobanking". NIH. Vaadatud 06.11.2022.
- ↑ Riigikogu (15.03.2019). "Inimgeeniuuringute seadus". Riigi teataja. Vaadatud 06.11.2022.
- ↑ Laura M. Beskow (2016). Lessons from HeLa Cells: The Ethics and Policy of Biospecimens. Annual Review of Genomics and Human Genetics: Annual Reviews. Lk 395–417.
- ↑ The Associated Press (04.10.2021). "Henrietta Lacks' estate sued a company saying it used her 'stolen' cells for research". National Public Radio. Vaadatud 06.11.2022.
- ↑ Tartu Ülikooli Eetikakeskus. "Loomkatsed". TÜ Eetikaveeb. Originaali arhiivikoopia seisuga 5.11.2022. Vaadatud 05.11.2022.
- ↑ European Commission. "Animals used for scientific purposes". Vaadatud 05.11.2022.
- ↑ 85,0 85,1 Riigikogu (17.11.2021). "Loomakaitseseadus". Riigi Teataja. Vaadatud 05.11.2022.
- ↑ Euroopa Parlament ja Nõukogu (22. september 2010). "EUROOPA PARLAMENDI JA NÕUKOGU DIREKTIIV 2010/63/EL". Euroopa Liidu Teataja. Vaadatud 05.11.2022.
- ↑ Maaeluministeerium (29.08.2022). "Loomkatse korraldamine". Maaeluministeeriumi koduleht. Vaadatud 05.11.2022.
- ↑ Boston University Research Support (03.02.2021). "Postmortem Tissue Collection (IACUC)". Boston University. Vaadatud 05.11.2022.
- ↑ Queensland Government (1. august 2016). "Using dead animals for scientific purposes". Queensland Government. Vaadatud 05.11.2022.
- ↑ Rhodes University Animal Research Ethics Committee (15. november 2021). "Research Involving Animal Subjects". Rhodes University koduleht. Vaadatud 05.11.2022.
- ↑ Michael Nair-Collins (2021). From the Slaughterhouse to the Laboratory Bench: On the Ethics of Using Slaughtered Animals for Biomedical Research. Perspectives in Biology and Medicine: Johns Hopkins University Press.
- ↑ Xiaoyang Zheng, Haven Baker, William S. Hancock, Farah Fawaz, Michael McCaman, Erno Pungor Jr (2006). Proteomic Analysis for the Assessment of Different Lots of Fetal Bovine Serum as a Raw Material for Cell Culture. Part IV. Application of Proteomics to the Manufacture of Biological Drugs. Biotechnology Progress: Wiley. Lk 1294−1300. Originaali arhiivikoopia seisuga 5. november 2022. Vaadatud 5. novembril 2022.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Carlo E A Jochems, Jan B F van der Valk, Frans R Stafleu, Vera Baumans (2002). The Use of Fetal Bovine Serum: Ethical or Scientific Problem?. Alternatives to Laboratory Animals: SAGE Journals. Lk 219–227.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Jan van der Valk (2022). Fetal bovine serum—a cell culture dilemma. Science: American Association for the Advancement of Science.
- ↑ Daniel Brunner, Jürgen Frank, Helmut Appl, Harald Schöffl, Walter Pfaller, Gerhard Gstraunthaler (2010). Serum-free cell culture: the serum-free media interactive online database. ALTEX - Alternatives to Animal Experimentation. Lk 53–62.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ A. K. Pope, K. L. Harrison, L. M. Wilson, T. M. Breen, J. M. Cummins (1987). UltroSer G as a serum substitute in embryo culture medium. Journal of in Vitro Fertilization and Embryo Transfer: Springer Link. Lk 286–288.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ National Library of Medicine (25.10.2022). "MEDLINE, PubMed, and PMC (PubMed Central): How are they different?". NIH. Vaadatud 06.11.2022.



