Dihydrotestosteroni
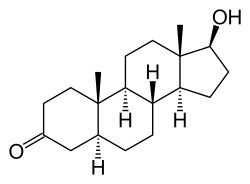
| |

| |
Dihydrotestosteroni
| |
| Systemaattinen (IUPAC) nimi | |
| (5S,8R,9S,10S,13S,14S,17S)-17-hydroksi-10,13-dimethyl-1,2,4,5,6,7,8,9,11,12,14,15,16,17-tetradekahydrosyklopenta[a]fenantren-3-oni | |
| Tunnisteet | |
| CAS-numero | |
| ATC-koodi | A14 |
| PubChem CID | |
| DrugBank | |
| Kemialliset tiedot | |
| Kaava | C19H30O2 |
| Moolimassa | 290.440 g/mol[1] |
| SMILES | Etsi tietokannasta: , |
| Synonyymit | androstanoloni, stanoloni, 5α-androstan-17β-ol-3-oni, 5α-DHT |
| Farmakokineettiset tiedot | |
| Hyötyosuus | nieltynä hyvin huono ensikierron metabolian vuoksi[2] ja lihaspistoksena/ihon läpi imeytettynä suuri |
| Metabolia | maksa[3] |
| Puoliintumisaika | 2.83 tuntia ihon kautta[4] |
| Ekskreetio | virtsa[5] |
| Terapeuttiset näkökohdat | |
| Raskauskategoria |
X(US) |
| Reseptiluokitus |
|
| Antotapa | ihon läpi imeytettynä, lihaspistoksena tai nieltynä |
Dihydrotestosteroni (DHT) on sukupuolihormoni, joka on androgeenisiltä eli miesmäisiä piirteitä aikaansaavilta vaikutuksiltaan voimakkain kehon tuottama mieshormoni.[6] Miesten ja naisten keho tuottaa DHT:tä pelkistämällä testosteronia 5α-reduktaasi-nimisellä entsyymillä.[7] Miehissä DHT:n määrä on suurempi.[6] Valtaosa kehon DHT:stä muodostuu maksassa ja ihossa,[8] mutta sitä muodostuu myös muissa kehon kudoksissa.[9][8]
DHT:llä on tiettävästi tärkeä rooli perinnöllisessä miestyypin kaljuuntumisessa; esimerkiksi päänahan suuri DHT-pitoisuus ennenaikaistaa kaljuuntumista osin tuntemattomalla tavalla. DHT:n muodostumista estäviä aineita käytetään siksi lääkkeinä kaljuuntumiseen.[6] Mieshormonit, kuten DHT, saavat aikaan eturauhasen liikakasvua. DHT:n on siksi arveltu liittyvän eturauhasen syövän kehittymiseen.[10]
DHT:tä käytetään joissain maissa lääkkeenä esimerkiksi miehillä, joilla on alikehittyneet sukupuolielimet tai keho tuottaa liian vähän testosteronia.[11][12] DHT on myös luokiteltavissa anaboliseksi steroidiksi, mutta sen anabolinen (mm. lihasmassaa lisäävä) vaikutus suhteessa androgeenisiin (mm. karvoja kasvattaviin ja ääntä madaltaviin) vaikutuksiin on heikko. Siksi sitä ei juuri käytetä anabolisissa lääkehoidoissa tai kehonrakennuksessa.[12]
DHT:n löysivät ja valmistivat ensimmäisinä maailmassa Adolf Butenandt ja hänen työtoverinsa 1935 hydraamalla testosteronia.[13]
Rooli kehossa
[muokkaa | muokkaa wikitekstiä]DHT:lla on tärkeä rooli miesmäisten piirteiden muodostumisessa alkionkehityksessä. DHT osallistuu keskeisesti miesten sukupuolielinten, viiksien, parran, häpykarvojen ja eturauhasen kehitykseen toimimalla näiden kehitystä aktivoivana ja kiihdyttävänä aineena.[14] DHT toimii lähinnä paikallisesti kudoksissa, joissa se muodostuu. Verenkierrossa sitä on vähän, joten verenkierron DHT:llä ei ole suurta hormonaalista merkitystä kehossa.[15][16]
DHT kaljuuntumisessa
[muokkaa | muokkaa wikitekstiä]DHT ja muut androgeenit sitoutuvat androgeenireseptoriin ja saavat aikaan hiusten karvatuppien kutistumisen päänahassa. Tämä johtaa miestyypin kaljuuntumiseen, vaikka muualla kehossa androgeenit saavat aikaan karvan kasvua.[17] Ristiriitaista vaikutusta kutsutaan välillä androgeeni paradoksiksi.[18]
Tarkka tapa, jolla miestyypin kaljuuntuminen saa alkunsa, on tuntematon, mutta yleisesti tunnistettuja miestyypin kaljuuntumiseen liittyviä asioita ovat päänahassa 5α-reduktaasi-entsyymien (muuttavat testosteronia DHT:ksi) toiminnan kasvu, DHT:n määrän kasvu ja androgeenireseptorien lukumäärän kasvu.[17] Kaikki tämä viittaisi DHT:n olevan erittäin tärkeässä roolissa miestyypin kaljuuntumisessa.[6] Huomion arvoista on kuitenkin se, että 5α-reduktaaseja on kehossa kolmea tyyppiä.[19] Entsyymityypin 2 geneettisen puutoksen omaavilla miehillä ei esiinny miestyypin kaljuuntumista, ja lisäksi heillä on korkeammat päänahan DHT-pitoisuudet kuin miehillä, joilla puutosta ei ole. Tyypin 2 entsyymi saattaa siten olla ratkaiseva tekijä miestyypin kaljuuntumisessa, eikä DHT itsessään aiheutakaan kaljuuntumista. Toisaalta perinnöllisistä syistä karvatupet saattavat reagoida eri herkkyyksillä DHT:hen, jolloin DHT ja vastaavanlaiset androgeenit ehkä ovatkin miestyyppisen kaljuuntumisen aiheuttajia 5α-reduktaasin eri muotojen sijaan.[6] Lisäksi ulkoiset tekijät, kuten anabolisten steroidien käyttö tai mieshormonihoidot (esim. DHT:n lääkekäyttö), voivat kiihdyttää kaljuuntumista. Vastaavasti miestyypin kaljuuntumista voidaan jossain määrin hidastaa erilaisin lääkkein, jotka estävät DHT:n muodostumista.[12]
Miehillä lääkkeitä ovat suun kautta otettavat 5α-reduktaasin salpaajat, kuten dutasteridi (salpaa 5α-reduktaaseja 1, 2 ja 3)[20] tai finasteridi (salpaa 5α-reduktaaseja 2 ja 3).[21][22] Myös minoksidiiliä käytetään ihovoiteena,[22] joka tosin ei ole 5α-reduktaasien salpaaja, eikä siten estä DHT:n muodostumista.
Naisten kaljuuntumiseen käytetään ensisijaisesti minoksidiiliä, mutta jos tämä ei toimi, voidaan finasteridiä ja dutasteridiä periaatteessa käyttää kaljuuntumiseen. Lisäksi niitä voidaan käyttää hirsutismin (liiallisen karvan kasvun) hoitoon naisilla. Raskaana olevien poikalapsille voi kuitenkin muodostua käytöstä johtuen sukupuolielinten kehityshäiriö. Alankomaissa finasteridin ja dutasteridin käyttö naisten kaljuuntumiseen tai hirsutismiin on hoitosuositusten vastaista.[23]
Biokemia
[muokkaa | muokkaa wikitekstiä]Reseptorisitoutuminen
[muokkaa | muokkaa wikitekstiä]DHT on androgeenisiltä vaikutuksiltaan voimakkain kehon luontaisista mieshormoneista.[6] DHT sitoutuu androgeenireseptoriin (AR) esimerkiksi testosteroniin verrattuna noin kaksi kertaa voimakkaammin ja poistuu reseptorista testosteronia viitisen kertaa hitaammin.[24]
DHT:n affiniteetti (Kd) ihmisen AR:ään on 0,4–1 nM.[25] DHT:n AR:än aktivoivaa pitoisuutta kuvaava EC50 on 0,13 nM ja testosteronilla 0,66 nM.[26][27] DHT:n poistumisen puoliintumisaika AR:stä on 53 minuuttia ja testosteronin 34 minuuttia.[28]
DHT:lla on kaksi pääasiallista aineenvaihdunnan tuotetta: 3α-androstaanidioli, joka on GABAA reseptorin positiivinen allosteerinen säätelijä, ja 3β-androstaanidioli, joka on estrogeenireseptori beetan (ERβ) agonisti.[29]
Muodostuminen
[muokkaa | muokkaa wikitekstiä]
Keho valmistaa DHT:tä yksisuuntaisen reaktion kautta pelkistämällä testosteronin kaksoissidos.[8][31] Reaktio tapahtuu 5α-reduktaasi-entsyymillä solun sileässä solulimakalvostossa.[30] DHT:tä muodostuu useissa eri kudoksissa: peniksessä, kivespussissa, klitoriksessa, isoissa häpyhuulissa (labia majora),[9] eturauhasessa, ihossa, karvatupissa, maksassa ja aivoissa. Kehossa muodostuu noin 200–300 mikrogrammaa DHT:tä per päivä, valtaosa ihossa ja maksassa. Verenkierron DHT on lähtöisin lähinnä maksasta. Kivekset ja eturauhanen muodostavat suhteessa vähän DHT:tä verenkiertoon.[8]
Veriseerumissa on DHT:tä noin 10 prosenttia testosteronin pitoisuudesta. Eturauhasessa DHT:tä on 5–10 kertaa enemmän kuin testosteronia. Tämä johtuu rauhasessa suurissa määrin tuotetusta 5α-reduktaasista, jonka vaikutuksesta noin 90 prosenttia rauhasen testosteronista muuntuu lopulta DHT:ksi.[32]
5α-reduktaasilla on kehossa kolme muotoa: SRD5A1, SRD5A2 ja SRD5A3.[19] SRD5A2 tuottaa valtaosan kehon DHT:stä.[8] SRD5A2 esiintyy eturauhasessa, lisäkiveksissä, rakkularauhasissa, sukuelinten ihossa, kasvojen karvatupissa, rintakehän karvatupissa,[33][34] ja maksassa. SRD5A2 esiintyy vähemmässä määrin joillain aivojen alueilla, muualla ihossa/karvatupissa kuin sukuelimien ihossa/karvatupissa, kiveksissä ja munuaisissa. SRD5A1 esiintyy alueilla enemmän. SRD5A1 esiintyy vähäisemmissä määrin eturauhasessa, lisäkiveksissä, sukuelinten ihossa, kiveksissä, lisämunuaisissa ja munuaisissa.[8] 5α-reduktaasin molemmat muodot ilmenevät tarkkaan ottaen talirauhasissa, hikirauhasissa, orvaskedessä ja karvatupissa.[33][34] Molempia muotoja esiintyy myös päänahan karvatupissa,[35] vaikkakin SRD5A2 esiintyy näissä kudoksissa enemmän.[34] Eturauhasessa ilmenee lähes pelkästään SRD5A2:ta.[36][37]
Metabolia ja erittyminen
[muokkaa | muokkaa wikitekstiä]DHT muuntuu maksassa ja muissa kudoksissa 3α-hydroksisteroidi dehydrogenaasilla (EC 1.1.1.225) ja 3β-hydroksisteroidi dehydrogenaasilla (EC 1.1.1.145) biologisesti toimimattomaksi 3α-androstaanidioliksi (CAS 1852-53-5) ja 3β-androstaanidioliksi (CAS 571-20-0) vastaavasti.[8][38] Nämä muuttuvat androsteroniksi (CAS 53-41-8) ja epiandrosteroniksi (CAS 481-29-8), jotka erittyvät virtsan mukana pois kehosta käytyään kuitenkin ensin läpi glukuronidaation ja/tai sulfonihapon lisäyksen.[8]
Kehon tuottama ja ulkoisesti annettu testosteroni voi muuntua kehossa estradioliksi. DHT puolestaan muodostuu yksisuuntaisen reaktion kautta, joten se ei aromatisoidu takaisin testosteronin kautta estradioliksi. Siksi lääkkeenä annettu tai kehon itsensä tuottama DHT ei saa aikaan merkittäviä estrogeenisiä vaikutuksia.[39][12] DHT:n aineenvaihdunnan tuote 3β-androstaanidioli kuitenkin sitoutuu voimakkaana agonistina estrogeenireseptori betaan (ERβ).[29]
Verenkuva
[muokkaa | muokkaa wikitekstiä]Veriseerumista DHT:n verenkuva (S -DhTesto) mitataan nestekromatografia-tandem massaspektrometrialla (LC-MS/MS).[40]
| Ryhmä | Seerumin pitoisuus (nmol/l) |
|---|---|
| Pojat | 0,1–0,7 |
| Murrosikäiset pojat | 0,3–2 |
| Tytöt | 0,1–0,9 |
| Murrosikäiset työt | 0,2–0,9 |
| Miehet | 1–10 |
| Naiset | 0,3–1,2 |
Käyttö
[muokkaa | muokkaa wikitekstiä]Lääkekäyttö
[muokkaa | muokkaa wikitekstiä]Suomessa useisiin alla lueteltuihin tiloihin käytetään testosteronin eri muotoja testosteronikorvaushoidoissa[41][42][43][44] DHT:n sijaan.
DHT:tä käytetään iholle laitettavana geelinä miesten hypogonadismin eli sukupuolirauhasten vajaatoiminnan tai alikehittyneisyyden hoitoon ainakin Ranskassa ja Belgiassa.[11] Ihogeelinä annettavaa DHT:tä annetaan myös hormonikorvaushoitona vanhemmille miehille, joilla on liian vähäinen mieshormonien tuotto.[12]
DHT:tä käytetään lisäksi pienentämään gynekomastiaa potevien miesten rintoja[45] ihonalaisin pistoksin[46] tai lihaspistoksin.[47]
DHT:tä on myös käytetty anabolisena steroidina 1990-luvulla HIV-potilaiden näivettymisen (kakeksian) hoitoon.[48][49] HIV-tartuntaa potevilla kehon oma DHT:n tuotanto on häiriintynyt, joten DHT:n voimakkaasta androgeenisestä vaikutuksesta ei ollut hoidoissa haittaa, vaan hyötyä.[12]
DHT:tä tutkittiin 1950-luvulla hoitona naisten rintasyöpään.[50][51][52]
DHT-geelit, kuten Andractim-lääkemerkki, sisältävät yleensä 2,5 painoprosenttia DHT:tä. Noin kymmenen prosenttia iholle laitetusta määrästä imeytyy vuorokaudessa. Annokset ovat 16–64 milligrammaa päivässä, josta noin 1,6–6,4 mg imeytyy kehoon.[12] DHT:tä ei juuri käytetä nieltynä, koska tätä kautta käytettynä keho muuntaa DHT:tä tehokkaasti käytännössä toimimattomaksi androsteronin glukuronidiksi, eli tapahtuu ensikierron metabolia-ilmiö.[2]
Urheilu- ja kuntoilukäyttö
[muokkaa | muokkaa wikitekstiä]DHT:tä ei juuri käytetä lihasmassan lisäykseen, koska sen miesmäisiä piirteitä aikaansaavat (androgeeniset) vaikutukset ovat voimakkaammat kuin sen lihasmassaa lisäävät (anaboliset) vaikutukset suhteessa muihin anabolisiin steroideihin. Erityisesti naisilla miesmäisten piirteiden kehittyminen voi olla voimakasta. Lihasmassaa lisäävän DHT-kuurin voi kuitenkin aloittaa 50–100 milligrammalla DHT:tä ihovoiteena, josta noin 5–10 mg imeytyy kehoon.[12]
Sivuvaikutukset
[muokkaa | muokkaa wikitekstiä]- Katso myös: Anaboliset steroidit#Sivu- ja muut vaikutukset
Lääkekäytön annosko’oista tulee harvoin sivuvaikutuksia. Jos niitä kuitenkin ilmenee, kertovat ne yleensä liian suuresta annostuksesta. Sivuvaikutuksiin kuuluvat muun muassa akne, painon lisääntyminen, karvojen kasvu, käheä ääni, mielialan vaihtelut ja ylienergisyys.[53] Lääkekäytön annokset ylittävät määrät DHT:tä saavat aikaan samankaltaisia vaikutuksia kuin anaboliset steroidit ja muut androgeenit. Edellä mainittujen vaikutusten lisäksi sivuvaikutuksiin kuuluu mahdollisesti nopeutunut miestyypin kaljuuntuminen miehillä, joilla on siihen perinnöllinen alttius. Naisilla voi olla muun muassa kuukautisten epäsäännöllisyyttä, äänen madaltumista, ihon rakenteen muutoksia, klitoriksen kasvua ja viiksien tai parran kasvua.[12]
DHT ei vaurioita maksaa toisin kuin jotkin muut androgeenit ja anaboliset steroidit.[12] DHT ei saa myöskään aikaan estrogeenisiä sivuvaikutuksia, kuten rintojen kehittymistä miehille ja turvotusta. Tämä johtuu siitä, että DHT ei aromatisoidu naishormoneiksi, toisin kuin jotkin muut anaboliset tai androgeeniset steroidit.[12]
Katso myös
[muokkaa | muokkaa wikitekstiä]Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ Haynes, William M. & Lide, David R. & Bruno, Thomas J.: CRC Handbook of Chemistry and Physics, s. 3–304. (95. painos) Boca Raton, Florida: CRC Press, 2014. OCLC: 908078665 ISBN 9781482208689
- ↑ a b Sarah B. Coutts, Andrew T. Kicman, Derek T. Hurst, David A. Cowan: Intramuscular administration of 5α-dihydrotestosterone heptanoate: changes in urinary hormone profile. Clinical Chemistry, 1.11.1997, 43. vsk, nro 11, s. 2091–2098. PubMed:9365393 ISSN 0009-9147 Artikkelin verkkoversio.
- ↑ Trevor M. Penning: New Frontiers in Androgen Biosynthesis and Metabolism. Current opinion in endocrinology, diabetes, and obesity, kesäkuu 2010, 17. vsk, nro 3, s. 233–239. PubMed:20186052 doi:10.1097/MED.0b013e3283381a31 ISSN 1752-296X Artikkelin verkkoversio.
- ↑ Mozayani, Ashraf & Raymon, Lionel P.: ”14 Anabolic Doping Agents”, Handbook of drug interactions : a clinical and forensic guide, s. 510-. (https://doi.org/10.1007%2F978-1-61779-222-9_15)++Totowa, New Jersey: Springer Science & Business Media, 2003. 52086779 ISBN 9781592596546 Teoksen verkkoversio.
- ↑ Melmed, Shlomo & Polonsky, Kenneth S. & Larsen, P. Reed & Kronenberg, Henry: Williams textbook of endocrinology, s. 621, 711. Elsevier Health Sciences, Elsevier Health Sciences. ISBN 9780323297387 Teoksen verkkoversio.
- ↑ a b c d e f Izabela Urysiak-Czubatka, Małgorzata L. Kmieć, Grażyna Broniarczyk-Dyła: Assessment of the usefulness of dihydrotestosterone in the diagnostics of patients with androgenetic alopecia. Advances in Dermatology and Allergology/Postȩpy Dermatologii i Alergologii, elokuu 2014, 31. vsk, nro 4, s. 207–215. PubMed:25254005 doi:10.5114/pdia.2014.40925 ISSN 1642-395X Artikkelin verkkoversio.
- ↑ H. Vierhapper, P. Nowotny, H. Maier, W. Waldhäusl: Production rates of dihydrotestosterone in healthy men and women and in men with male pattern baldness: determination by stable isotope/dilution and mass spectrometry. The Journal of Clinical Endocrinology and Metabolism, joulukuu 2001, 86. vsk, nro 12, s. 5762–5764. PubMed:11739436 doi:10.1210/jcem.86.12.8078 ISSN 0021-972X Artikkelin verkkoversio.
- ↑ a b c d e f g h Melmed, Shlomo & Polonsky, Kenneth S. & Larsen, P. Reed & Kronenberg, Henry: Williams textbook of endocrinology, s. 621, 711. Philadelphia, Pennsylvania: Elsevier Health Sciences, 2016. OCLC: 1007118907 ISBN 9780323297387 Teoksen verkkoversio.
- ↑ a b Rhoades, Rodney A. & Bell, David R.: Medical physiology : principles for clinical medicine, s. 690. Philadelphia: Lippincott Williams & Wilkins, 2013. OCLC: 847517654 ISBN 9781609134273 Teoksen verkkoversio.
- ↑ Takeo Kosaka, Akira Miyajima, Mototsugu Oya: Is DHT Production by 5α-Reductase Friend or Foe in Prostate Cancer? Frontiers in Oncology, 16.9.2014, nro 4. PubMed:25279351 doi:10.3389/fonc.2014.00247 ISSN 2234-943X Artikkelin verkkoversio.
- ↑ a b Arthi Thirumalai, Kathryn E. Berkseth, John K. Amory: Treatment of Hypogonadism: Current and Future Therapies. F1000Research, 23.1.2017, nro 6. PubMed:28149506 doi:10.12688/f1000research.10102.1 ISSN 2046-1402 Artikkelin verkkoversio.
- ↑ a b c d e f g h i j k Llewellyn, William: Anabolics, s. 353–359. Jupiter, Florida: Molecular Nutrition Llc, 2011. OCLC: 711705731 ISBN 9780982828014 Teoksen verkkoversio.
- ↑ Krüskemper, H.-L.: Anabolic Steroids. s. 12. (Käännös 1963 George Thieme kirjoittamasta kirjasta "Anabole Steroide") New York: Academic Press Inc, 1968. OCLC: 895248260 ISBN 9781483265049 Teoksen verkkoversio.
- ↑ Leonard S Marks: 5α-Reductase: History and Clinical Importance. Reviews in Urology, 2004, nro Suppl 9, s. S11–S21. PubMed:16985920 ISSN 1523-6161 Artikkelin verkkoversio.
- ↑ R. Horton: Dihydrotestosterone is a peripheral paracrine hormone. Journal of Andrology, tammikuu 1992, 13. vsk, s. 23–27. PubMed:1551803 ISSN 0196-3635 Artikkelin verkkoversio.
- ↑ Ronald S. Swerdloff, Robert E. Dudley, Stephanie T. Page, Christina Wang, Wael A. Salameh: Dihydrotestosterone: Biochemistry, Physiology, and Clinical Implications of Elevated Blood Levels. Endocrine Reviews, 2017, 38. vsk, nro 3, s. 220–254. PubMed:28472278 doi:10.1210/er.2016-1067 ISSN 1945-7189 Artikkelin verkkoversio.
- ↑ a b Emin Tuncay Ustuner: Cause of Androgenic Alopecia: Crux of the Matter. Plastic and Reconstructive Surgery Global Open, 7.11.2013, 1. vsk, nro 7. PubMed:25289259 doi:10.1097/GOX.0000000000000005 ISSN 2169-7574 Artikkelin verkkoversio.
- ↑ Shigeki Inui, Satoshi Itami: Androgen actions on the human hair follicle: perspectives. Experimental Dermatology, maaliskuu 2013, 22. vsk, nro 3, s. 168–171. PubMed:23016593 doi:10.1111/exd.12024 ISSN 1600-0625 Artikkelin verkkoversio.
- ↑ a b Faris Azzouni, Alejandro Godoy, Yun Li, James Mohler: The 5 Alpha-Reductase Isozyme Family: A Review of Basic Biology and Their Role in Human Diseases. Advances in Urology, 2012, nro 2012. PubMed:22235201 doi:10.1155/2012/530121 ISSN 1687-6369 Artikkelin verkkoversio.
- ↑ Sibylle Marihart, Mike Harik, Bob Djavan: Dutasteride: A Review of Current Data on a Novel Dual Inhibitor of 5α Reductase. Reviews in Urology, 2005, 7. vsk, nro 4, s. 203–210. PubMed:16985831 ISSN 1523-6161 Artikkelin verkkoversio.
- ↑ Kazutoshi Yamana, Fernand Labrie, Van Luu-The: Human type 3 5α-reductase is expressed in peripheral tissues at higher levels than types 1 and 2 and its activity is potently inhibited by finasteride and dutasteride. Hormone Molecular Biology and Clinical Investigation, 1.8.2010, 2. vsk, nro 3, s. 293–299. PubMed:25961201 doi:10.1515/HMBCI.2010.035 ISSN 1868-1883 Artikkelin verkkoversio.
- ↑ a b Rodney Sinclair: Male pattern androgenetic alopecia. BMJ : British Medical Journal, 26.9.1998, 317. vsk, nro 7162, s. 865–869. PubMed:9748188 ISSN 0959-8138 Artikkelin verkkoversio.
- ↑ Overview of off-label use of 5-apha reductase inhibitors in women 2015. Netherlands Pharmacovigilance Centre Lareb. Arkistoitu 8.4.2018. Viitattu 13.4.2018.
- ↑ P. B. Grino, J. E. Griffin, J. D. Wilson: Testosterone at high concentrations interacts with the human androgen receptor similarly to dihydrotestosterone. Endocrinology, helmikuu 1990, 126. vsk, nro 2, s. 1165–1172. PubMed:2298157 doi:10.1210/endo-126-2-1165 ISSN 0013-7227 Artikkelin verkkoversio.
- ↑ Mozayani, Ashraf. & Raymon, Lionel P.: Handbook of drug interactions : a clinical and forensic guide, s. 656. (2. painos) New York: Humana Press, 2012. OCLC: 787868522 LCCN: 2011933472 ISBN 9781617792229 Teoksen verkkoversio.
- ↑ Wilderer, P. A.: ”Bioassays for Estrogenic and Androgenic Effects of Water Constituents”, Treatise on Water Science, Four-Volume Set, s. 1805. Amsterdam: Elsevier Science, 2011. OCLC: 932059750 ISBN 9780444531995 Teoksen verkkoversio.
- ↑ Edwin Sonneveld, Hendrina J. Jansen, Jacoba A. C. Riteco, Abraham Brouwer, Bart van der Burg: Development of androgen- and estrogen-responsive bioassays, members of a panel of human cell line-based highly selective steroid-responsive bioassays. Toxicological Sciences: An Official Journal of the Society of Toxicology, tammikuu 2005, 83. vsk, nro 1, s. 136–148. PubMed:15483189 doi:10.1093/toxsci/kfi005 ISSN 1096-6080 Artikkelin verkkoversio.
- ↑ E. Diamanti-Kandarakis: Current aspects of antiandrogen therapy in women. Current Pharmaceutical Design, syyskuu 1999, 5. vsk, nro 9, s. 707–723. PubMed:10495361 ISSN 1381-6128
- ↑ a b Amy S. Kohtz, Cheryl A. Frye: Dissociating behavioral, autonomic, and neuroendocrine effects of androgen steroids in animal models. Methods in Molecular Biology, 2012, nro 829, s. 397–431. Clifton, New Jersey. PubMed:22231829 doi:10.1007/978-1-61779-458-2_26 ISSN 1940-6029 Artikkelin verkkoversio.
- ↑ a b Mikael Häggström, David Richfield: Diagram of the pathways of human steroidogenesis. WikiJournal of Medicine, 2014, nro 1. ORCID: 0000-0002-2732-7631 doi:10.15347/wjm/2014.005 ISSN 2002-4436 Artikkelin verkkoversio.
- ↑ Blume-Peytavi U, Whiting DA, Trüeb RM: Hair growth and disorders, s. 161–162. Berlin: Springer Science & Business Media, 2008. OCLC: 728715562 ISBN 9783540469117 Teoksen verkkoversio.
- ↑ Hay, Ian D. & Wass, J. A. H.: Clinical endocrine oncology, s. 37. Malden, Mass.: Blackwell Pub, 2009. OCLC: 352827032 ISBN 9781444300239 Teoksen verkkoversio.
- ↑ a b C. C. Zouboulis, W.-C. Chen, M. J. Thornton, K. Qin, R. Rosenfield: Sexual hormones in human skin. Horm. Metab. Res., helmikuu 2007, 39. vsk, nro 2, s. 85–95. PubMed:17326004 doi:10.1055/s-2007-961807 ISSN 0018-5043 Artikkelin verkkoversio. (Arkistoitu – Internet Archive)
- ↑ a b c Bolognia, Jean & Jorizzo, Joseph L. & Schaffer, Julie V.: Dermatology, s. 1094. (3. painos) Philadelphia, Pennsylvania: Elsevier Health Sciences, 2012. OCLC: 818314154 ISBN 0702051829 Teoksen verkkoversio.
- ↑ Murphy, Michael J.: Molecular diagnostics in dermatology and dermatopathology, s. 373. Totowa, N.J.: Springer Science & Business Media, 2011. OCLC: 900283997 ISBN 9781607611714 Teoksen verkkoversio.
- ↑ Susan J. Keam, Lesley J. Scott: Dutasteride. Drugs, 1.3.2008, 68. vsk, nro 4, s. 463–485. PubMed:18318566 doi:10.2165/00003495-200868040-00008 ISSN 0012-6667 Artikkelin verkkoversio.
- ↑ Heesakkers, John & Chapple, Christopher R. & Ridder, Dirk De & Farag, Fawzy: Practical functional urology, s. 280. Cham: Springer, 2016. OCLC: 991645976 ISBN 9783319254302 Teoksen verkkoversio.
- ↑ Tea Lanisnik Rizner, Hsueh K. Lin, Donna M. Peehl, Stephan Steckelbroeck, David R. Bauman, Trevor M. Penning: Human type 3 3alpha-hydroxysteroid dehydrogenase (aldo-keto reductase 1C2) and androgen metabolism in prostate cells. Endocrinology, 2003, 144. vsk, nro 7, s. 2922–2932. PubMed:12810547 doi:10.1210/en.2002-0032 ISSN 0013-7227 Artikkelin verkkoversio.
- ↑ Weiner, Irving B. & Gallagher, Michela & Nelson, Randy Joe: Handbook of psychology: volume 3 biological psychology, s. 333. New York: John Wiley & Sons, 2003. OCLC: 659930961 ISBN 9780471384038 Teoksen verkkoversio.
- ↑ a b Janne Suvisaari: Dihydrotestosteroni, seerumista huslab.fi. Viitattu 26.4.2018.
- ↑ SUSTANON 250 injektioneste, liuos laakeinfo.fi. Viitattu 26.4.2018.
- ↑ NEBIDO injektioneste, liuos 1000 mg/4 ml laakeinfo.fi. Viitattu 26.4.2018.
- ↑ TESTOGEL geeli 50 mg/annos laakeinfo.fi. Viitattu 26.4.2018.
- ↑ PANTESTON kapseli, pehmeä 40 mg laakeinfo.fi. Viitattu 26.4.2018.
- ↑ Neslihan Cuhaci, Sefika Burcak Polat, Berna Evranos, Reyhan Ersoy, Bekir Cakir: Gynecomastia: Clinical evaluation and management. Indian Journal of Endocrinology and Metabolism, 2014, 18. vsk, nro 2, s. 150–158. PubMed:24741509 doi:10.4103/2230-8210.129104 ISSN 2230-8210 Artikkelin verkkoversio.
- ↑ J. M. Kuhn, R. Roca, M. H. Laudat, M. Rieu, J. P. Luton, H. Bricaire: Studies on the treatment of idiopathic gynaecomastia with percutaneous dihydrotestosterone. Clinical Endocrinology, lokakuu 1983, 19. vsk, nro 4, s. 513–520. PubMed:6354523 doi:10.1111/j.1365-2265.1983.tb00026.x ISSN 0300-0664 Artikkelin verkkoversio.
- ↑ A. J. Eberle, J. T. Sparrow, B. S. Keenan: Treatment of persistent pubertal gynecomastia with dihydrotestosterone heptanoate. The Journal of Pediatrics, heinäkuu 1986, 109. vsk, nro 1, s. 144–149. PubMed:3088241 ISSN 0022-3476 Artikkelin verkkoversio.
- ↑ Unimed Pharmaceuticals begins HIV wasting syndrome trial. Journal of the International Association of Physicians in AIDS Care, toukokuu 1996, 2. vsk, nro 5, s. 51. PubMed:11363535 ISSN 1081-454X
- ↑ F. Sattler, W. Briggs, I. Antonipillai, J. Allen, R. Horton: Low dihydrotestosterone and weight loss in the AIDS wasting syndrome. Journal of Acquired Immune Deficiency Syndromes and Human Retrovirology: Official Publication of the International Retrovirology Association, 1.7.1998, nro 3, s. 246–251. PubMed:9665502 ISSN 1077-9450
- ↑ A. Gelhorn, J. Holland, J. B. Herrmann, J. Moss, A. Smelin: An evaluation of stanolone in treatment of advanced mammary cancer. Journal of the American Medical Association, 10.4.1954, 18. vsk, nro 15, s. 1274–1277. PubMed:13151839 ISSN 0002-9955
- ↑ B. J. Kennedy: The effect of stanolone in the treatment of advanced breast cancer. Cancer, toukokuu 1955, 8. vsk, nro 3, s. 488–497. PubMed:14379136 ISSN 0008-543X
- ↑ A. Segaloff, B. N. Horwitt, R. A. Carabasi, P. J. Murison, J. V. Schlosser: Hormonal therapy in cancer of the breast. VIII. The effect of dihydrotestosterone (androstanolone) on clinical course and hormonal excretion. Cancer, tammikuu 1955, 8. vsk, nro 1, s. 82–86. PubMed:13231036 ISSN 0008-543X
- ↑ Dihydrotestosterone (Andractim®) 2.5% gel for topical application Great Ormond Street Hospital for Children NHS Foundation Trust. Arkistoitu 12.4.2018. Viitattu 11.4.2018.
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- Finto, suomalainen sanasto- ja ontologiapalvelu: Dihydrotestosteroni
- PubChem: Stanolone (englanniksi)
- DrugBank: Stanolone (englanniksi)
- Human Metabolome Database (HMDB): Dihydrotestosterone (englanniksi)
- Toxin and Toxin Target Database (T3DB): Dihydrotestosterone (englanniksi)
- Kyoto Encyclopedia of Genes and Genomes (KEGG): Dihydrotestosterone (englanniksi)
- ChemBlink: Stanolone (englanniksi)