Olaparib
| Olaparib | |
| |
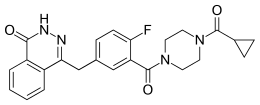
| Structure de l'olaparib | |
| Identification | |
|---|---|
| Nom UICPA | 4-(3-{[4-(cyclopropylcarbonyl)pipérazin-1-yl]carbonyl}-4-fluorobenzyl)phthalazin-1(2H)-one |
| No CAS | |
| No ECHA | 100.170.811 |
| Code ATC | |
| PubChem | 23725625 |
| ChEBI | 83766 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C24H23FN4O3 [Isomères] |
| Masse molaire[1] | 434,462 8 ± 0,022 5 g/mol C 66,35 %, H 5,34 %, F 4,37 %, N 12,9 %, O 11,05 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'olaparib (AZD-2281, commercialisé sous le nom Lynparza[2]) est un anticancéreux de la classe des inhibiteurs de PARP (iPARP), principalement efficace chez les patients présentant des mutations héréditaires des gènes BRCA1 ou BRCA2 et avec des anomalies de la recombinaison homologue, essentiellement sur le cancer de l'ovaire, le cancer du sein, le cancer de la prostate et le cancer du pancréas[3].
Mode d'action
[modifier | modifier le code]
L'olaparib agit en inhibant les poly(ADP-ribose) polymérases (PARP). Les mutations des gènes BRCA1 et BRCA2 sont susceptibles de prédisposer génétiquement au développement de certaines formes de cancer résistant à d'autres formes de traitement. Ce type de cancers peut cependant présenter une sensibilité particulière aux poly(ADP-ribose) polymérases lorsque ces enzymes deviennent indispensables à la réparation de l'ADN nécessaire à la division cellulaire. Dans ces conditions précises, les médicaments qui inhibent sélectivement les PARP peuvent cibler spécifiquement les cellules cancéreuses et de ce fait présenter une efficacité optimale comme traitement anticancéreux[4],[5],[6].
Efficacité
[modifier | modifier le code]Son efficacité a été testée chez les patients porteurs d'un cancer avec mutation sur l'un des gènes BRCA et présentant un déficit de recombinaison homologue.
Dans le cancer du sein de type HER2 négatif, il allonge la durée de rémission et diminue la mortalité par rapport à un traitement conventionnel[7].
Dans le cancer de l'ovaire, en traitement d'entretien, il allonge la durée de rémission et diminue la mortalité à trois ans[8]. Des études sont en cours pour la réintroduction de ce traitement de maintenant en première rechute.
Dans le cancer du pancréas métastatique, il allonge la durée de rémission de quelques mois[9]. Toutefois les formes avec mutations sur le BRCA sont rares (3 à 5%) et après réponse à une chimiothérapie par sels de platine.
Dans le cancer de la prostate on observe une prolongation de la survie d'environ trois mois chez des patients traités à l'olaparib ayant subi une castration, bénéficiant d'un traitement hormonal (enzalutamide ou abiratérone) et chez qui on observe une progression de la maladie, dit "résistant à la castration chimique"[10].
Dans le cancer de l'endomètre, l'introduction d'un traitement de maintenance d'un iPARP est à l'étude.
Effets secondaires
[modifier | modifier le code]Parmi les effets secondaires, on relève : en premier lieux les effets sur la formule sanguinemajoritairement anémie et thrombopénie. Ces traitements ont un risque augmenté de leucémie secondaire. On notre des troubles gastro-intestinaux tels que la nausée, les vomissements et la perte d'appétit principalement à l'introduction du traitement; l'état de fatigue ; la myalgie (douleur musculaire) et l'arthralgie (douleur articulaire) ;
Les études de qualités de vie des patients traités par iPARP sont en cours d'analyse en 2023 et pourraient changer nos regards sur la croyance initiale en oncologie clinique de peu d'effets secondaires notables.
Statut légal
[modifier | modifier le code]L'olaparib bénéficie d'une autorisation de mise sur le marché par l'agence européenne du médicament en date du 16 décembre 2014 qui a été concédée au laboratoire Astra Zeneca sous le nom de spécialité Lynparza[11]. Cette autorisation a été enregistrée par l'ANSM, et le médicament est disponible en France depuis le [12]. Ce produit est remboursé à 100 % par la sécurité sociale en France. Le prix en France est de 4 755,52 euros TTC au la boite de 112 gélules de 50 mg. Ce qui amène le coût de traitement journalier à près de 170 € pour une posologie de 400 mg/jour.
Ce médicament a bénéficié d'une autorisation temporaire d'utilisation (ATU) et à ce titre est disponible pour les patients qui en ont bénéficié avant l'attribution de l'AMM[13].
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- David PAITRAUD, « LYNPARZA 50 mg gélule (olaparib) : nouveau principe actif dans la prise en charge du cancer de l'ovaire », sur le dictionnaire Vidal en ligne (lien), (consulté le ).
- (en) Peter C. Fong, David S. Boss, Timothy A. Yap, Andrew Tutt, Peijun Wu, Marja Mergui-Roelvink, Peter Mortimer, Helen Swaisland, Alan Lau, Mark J. O'Connor, Alan Ashworth, James Carmichael, Stan B. Kaye, Jan H.M. Schellens et Johann S. de Bono, « Inhibition of Poly(ADP-Ribose) Polymerase in Tumors from BRCA Mutation Carriers », The NeW England Journal of Medicine, vol. 361, no 2, , p. 123-134 (PMID 19553641, DOI 10.1056/NEJMoa0900212, lire en ligne)
- (en) Keith A. Menear, Claire Adcock, Robert Boulter, Xiao-ling Cockcroft, Louise Copsey, Aaron Cranston, Krystyna J. Dillon, Jan Drzewiecki, Sheila Garman, Sylvie Gomez, Hashim Javaid, Frank Kerrigan, Charlotte Knights, Alan Lau, Vincent M. Loh Jr., Ian T. W. Matthews, Stephen Moore, Mark J. O’Connor, Graeme C. M. Smith et Niall M. B. Martin, « 4-[3-(4-Cyclopropanecarbonylpiperazine-1-carbonyl)-4-fluorobenzyl]-2H-phthalazin-1-one: A Novel Bioavailable Inhibitor of Poly(ADP-ribose) Polymerase-1 », Journal of Medicinal Chemistry, vol. 51, no 20, , p. 6581-6591 (PMID 18800822, DOI 10.1021/jm8001263, lire en ligne)
- (en) Sven Rottenberg, Janneke E. Jaspers, Ariena Kersbergen, Eline van der Burg, Anders O. H. Nygren, Serge A. L. Zander, Patrick W. B. Derksen, Michiel de Bruin, John Zevenhoven, Alan Lau, Robert Boulter, Aaron Cranston, Mark J. O'Connor, Niall M. B. Martin, Piet Borst et Jos Jonkers, « High sensitivity of BRCA1-deficient mammary tumors to the PARP inhibitor AZD2281 alone and in combination with platinum drugs », Proceedings of the National Academy of Sciences of the United States of America, vol. 105, no 44, , p. 17079-17084 (PMID 18971340, PMCID 2579381, DOI 10.1073/pnas.0806092105, lire en ligne)
- (en) Trevor Hay, James R. Matthews, Lucie Pietzka, Alan Lau, Aaron Cranston, Anders O.H. Nygren, Anthony Douglas-Jones, Graeme C.M. Smith, Niall M.B. Martin, Mark O’Connor et Alan R. Clarke, « Poly(ADP-Ribose) Polymerase-1 Inhibitor Treatment Regresses Autochthonous Brca2/p53-Mutant Mammary Tumors In vivo and Delays Tumor Relapse in Combination with Carboplatin », Cancer Research, vol. 69, no 9, , p. 3850-3855 (PMID 19383921, DOI 10.1158/0008-5472.CAN-08-2388, lire en ligne)
- Robson M, Im SA, Senkus E et al. Olaparib for metastatic breast cancer in patients with a germline BRCA mutation, N Engl J Med, 2017;377:523-533
- Moore K, Colombo N, Scambia G et al. Maintenance olaparib in patients with newly diagnosed advanced ovarian cancer, N Engl J Med, 2018;379:2495-2505
- Golan T, Hammel P, Reni M et al. Maintenance Olaparib for germline BRCA-mutated metastatic pancreatic cancer, N Engl J Med, 2019;25;317-327
- Rosenson RS, Burgess LJ, Ebenbichler CF et al. Survival with olaparib in metastatic castration-resistant prostate cancer, N Engl J Med, 2020;383:2345-2357
- « Lynparza - European Medicines Agency », sur European Medicines Agency, (consulté le ).
- Agence française du médicament http://agence-prd.ansm.sante.fr/php/ecodex/extrait.php?specid=65789903
- http://ansm.sante.fr/var/ansm_site/storage/original/application/e4feda6c1ae156680d7f37b45e25e9b8.xls