Oxyde de tungstène(IV)
| Oxyde de tungstène(IV) | |
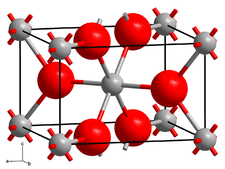
| |
| __ W4+ __ O2− Structure cristalline de l'oxyde de tungstène(IV) |
|
| Identification | |
|---|---|
| Synonymes |
dioxyde de tungstène |
| No CAS | |
| No ECHA | 100.031.662 |
| No CE | 234-842-7 |
| PubChem | 82850 |
| SMILES | |
| InChI | |
| Apparence | poudre cristallisée pratiquement insoluble dans l'eau[1] |
| Propriétés chimiques | |
| Formule | WO2 |
| Masse molaire[2] | 215,84 ± 0,01 g/mol O 14,83 %, W 85,17 %, |
| Propriétés physiques | |
| T° fusion | 1 500 à 1 600 °C[1] |
| T° ébullition | 1 730 °C[1] |
| Masse volumique | 10,72 g·cm-3[1] à 25 °C |
| Cristallographie | |
| Système cristallin | monoclinique |
| Structure type | Rutile |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'oxyde de tungstène(IV), ou dioxyde de tungstène, est un composé chimique de formule WO2. Il s'agit d'un solide cristallisé brun doré diamagnétique et conducteur de l'électricité dont la structure cristalline monoclinique est semblable à celle du rutile, avec des centres octaédriques WO6 distordus présentant une alternance de liaisons W–W courtes de 248 pm[3].
Préparation
[modifier | modifier le code]Le dioxyde de tungstène WO2 peut être obtenu par réduction du trioxyde de tungstène WO3 avec du tungstène ou de l'hydrogène ou en faisant réagir de la vapeur d'eau sur du tungstène ; les réactions se déroulent dans les deux cas à haute température.
On peut obtenir des monocristaux de dioxyde de tungstène par réaction de transport chimique (en). On commence par faire réagir du trioxyde de tungstène WO3 avec quelques milligrammes d'iode I2 dans une ampoule à 1 100 °C pour former de l'oxyde polycristallin. Celui-ci, de couleur brun-doré, est ensuite fondu avec 1 % d'iode à une extrémité d'une autre ampoule placée dans un four à deux compartiments de sorte que chaque ampoule occupe un compartiment. Une moitié est ainsi chauffée à 1 000 °C tandis que l'autre demeure à 960 °C. Après trois jours de réaction, et après refroidissement, on peut récupérer, à l'autre extrémité, des monocristaux dorés d'environ 2 mm de diamètre[4] :
- WO2 + I2 WO2I2 (g).
Utilisation
[modifier | modifier le code]Les oxydes de tungstène comme le dioxyde WO2 comptent parmi les catalyseurs utilisé par l'industrie pétrolière et pour la réduction catalytique sélective des oxydes d'azote avec l'ammoniac NH3 dans les gaz d'échappement des centrales électriques. Ils sont encore utilisés dans les verres, les glaçures et les céramiques.
Notes et références
[modifier | modifier le code]- Entrée « Tungsten(IV) oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 avril 2019 (JavaScript nécessaire)
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) A. F. Wells, (1984), Structural Inorganic Chemistry, 5e édition, Clarendon Press, Oxford, 1984. (ISBN 0-19-855370-6)
- ↑ (en) D. B. Rogers et al., « Single crystals of transition-metal dioxides - C. Tungsten dioxide and β-rhenium dioxide », Inorganic Syntheses, F. A. Cotton, vol. 13, McGraw-Hill Book Company, Inc., 1972, p. 135-145. (ISBN 0-07-013208-9)
