Wiki Article
Cobalt
Nguồn dữ liệu từ Wikipedia, hiển thị bởi DefZone.Net
 | ||||||||||||||||||||||||||||||||||||
| Cobalt | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | /ˈkoʊbɒlt/ ⓘ[1] | |||||||||||||||||||||||||||||||||||
| Appearance | Hard lustrous bluish gray metal | |||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Co) | ||||||||||||||||||||||||||||||||||||
| Cobalt in the periodic table | ||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 27 | |||||||||||||||||||||||||||||||||||
| Group | group 9 | |||||||||||||||||||||||||||||||||||
| Period | period 4 | |||||||||||||||||||||||||||||||||||
| Block | d-block | |||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d7 4s2 | |||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 15, 2 | |||||||||||||||||||||||||||||||||||
| Physical properties | ||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | |||||||||||||||||||||||||||||||||||
| Melting point | 1768 K (1495 °C, 2723 °F) | |||||||||||||||||||||||||||||||||||
| Boiling point | 3200 K (2927 °C, 5301 °F) | |||||||||||||||||||||||||||||||||||
| Density (at 20° C) | 8.834 g/cm3 [4] | |||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 7.75 g/cm3 | |||||||||||||||||||||||||||||||||||
| Heat of fusion | 16.06 kJ/mol | |||||||||||||||||||||||||||||||||||
| Heat of vaporization | 377 kJ/mol | |||||||||||||||||||||||||||||||||||
| Molar heat capacity | 24.81 J/(mol·K) | |||||||||||||||||||||||||||||||||||
| Specific heat capacity | 420.987 J/(kg·K) | |||||||||||||||||||||||||||||||||||
Vapor pressure
| ||||||||||||||||||||||||||||||||||||
| Atomic properties | ||||||||||||||||||||||||||||||||||||
| Oxidation states | common: +2, +3 −3,[5] −1,[7] 0,[7] +1,[7] +4,[7] +5[6] | |||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.88 | |||||||||||||||||||||||||||||||||||
| Ionization energies |
| |||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 125 pm | |||||||||||||||||||||||||||||||||||
| Covalent radius | Low spin: 126±3 pm High spin: 150±7 pm | |||||||||||||||||||||||||||||||||||
| Other properties | ||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | |||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal close-packed (hcp) (hP2) | |||||||||||||||||||||||||||||||||||
| Lattice constants | a = 250.71 pm c = 407.00 pm (at 20 °C)[4] | |||||||||||||||||||||||||||||||||||
| Thermal expansion | 12.9×10−6/K (at 20 °C)[a] | |||||||||||||||||||||||||||||||||||
| Thermal conductivity | 100 W/(m⋅K) | |||||||||||||||||||||||||||||||||||
| Electrical resistivity | 62.4 nΩ⋅m (at 20 °C) | |||||||||||||||||||||||||||||||||||
| Magnetic ordering | Ferromagnetic | |||||||||||||||||||||||||||||||||||
| Young's modulus | 209 GPa | |||||||||||||||||||||||||||||||||||
| Shear modulus | 75 GPa | |||||||||||||||||||||||||||||||||||
| Bulk modulus | 180 GPa | |||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 4720 m/s (at 20 °C) | |||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.31 | |||||||||||||||||||||||||||||||||||
| Mohs hardness | 5.0 | |||||||||||||||||||||||||||||||||||
| Vickers hardness | 1043 MPa | |||||||||||||||||||||||||||||||||||
| Brinell hardness | 470–3000 MPa | |||||||||||||||||||||||||||||||||||
| CAS Number | 7440-48-4 | |||||||||||||||||||||||||||||||||||
| History | ||||||||||||||||||||||||||||||||||||
| Naming | from the kobelt ore, possibly named after Kobolds | |||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Georg Brandt (1735) | |||||||||||||||||||||||||||||||||||
| Isotopes of cobalt | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
Cobalt is a chemical element; it has symbol Co and atomic number 27. As with nickel, cobalt is found in the Earth's crust only in a chemically combined form, save for small deposits found in alloys of natural meteoric iron. The free element, produced by reductive smelting, is a hard, lustrous, somewhat brittle, gray metal.
Cobalt-based blue pigments (cobalt blue) have been used since antiquity for jewelry and paints, and to impart a distinctive blue tint to glass. The color was long thought to be due to the metal bismuth. Miners had long used the name kobold ore (German for goblin ore) for some of the blue pigment-producing minerals. They were so named because they were poor in known metals and gave off poisonous arsenic-containing fumes when smelted.[9] In 1735, such ores were found to be reducible to a new metal (the first discovered since ancient times), which was ultimately named for the kobold.
Today, cobalt is usually produced as a by-product of copper and nickel mining, but sometimes also from one of a number of metallic-lustered ores such as cobaltite (CoAsS). The Copperbelt in the Democratic Republic of the Congo (DRC) and Zambia yields most of the global cobalt production. World production in 2016 was 116,000 tonnes (114,000 long tons; 128,000 short tons) according to Natural Resources Canada, and the DRC alone accounted for more than 50%.[10] In 2024, production exceeded 300,000 tons, of which DRC accounted for more than 80%.[11]
Cobalt is primarily used in lithium-ion batteries, and in the manufacture of magnetic, wear-resistant. and high-strength alloys. The compounds cobalt silicate and cobalt(II) aluminate (CoAl2O4, cobalt blue) give a distinctive deep blue color to glass, ceramics, inks, paints and varnishes. Cobalt occurs naturally as only one stable isotope, cobalt-59. Cobalt-60 is a commercially important radioisotope, used as a radioactive tracer and for the production of high-energy gamma rays. Cobalt is also used in the petroleum industry as a catalyst when refining crude oil. This is to purge it of sulfur, which is very polluting when burned and causes acid rain.[12]
Cobalt is the active center of a group of coenzymes called cobalamins. Vitamin B12, the best-known example of the type, is an essential vitamin for all animals. Cobalt in inorganic form is also a micronutrient for bacteria, algae, and fungi.
The name cobalt derives from a type of ore considered a nuisance by 16th century German silver miners, which in turn may have been named from a spirit or goblin held superstitiously responsible for it; this spirit is considered equitable to the kobold (a household spirit) by some, or categorized as a gnome (mine spirit) by others.
Characteristics
[edit]
Cobalt is a ferromagnetic metal with a specific gravity of 8.9. The Curie temperature is 1,115 °C (2,039 °F)[13] and the magnetic moment is 1.6–1.7 Bohr magnetons per atom.[14] Cobalt has a relative permeability two-thirds that of iron.[15] Metallic cobalt occurs as two crystallographic structures: hcp and fcc. The ideal transition temperature between the hcp and fcc structures is 450 °C (842 °F), but in practice the energy difference between them is so small that random intergrowth of the two is common.[16][17][18]
Cobalt is a weakly reducing metal that is protected from oxidation by a passivating oxide film. It is attacked by halogens and sulfur. Heating in oxygen produces Co3O4 which loses oxygen at 900 °C (1,650 °F) to give the monoxide CoO.[19] The metal reacts with fluorine (F2) at 520 K to give CoF3; with chlorine (Cl2), bromine (Br2) and iodine (I2), producing equivalent binary halides. It does not react with hydrogen gas (H2) or nitrogen gas (N2) even when heated, but it does react with boron, carbon, phosphorus, arsenic and sulfur.[20] At ordinary temperatures, it reacts slowly with mineral acids, and very slowly with moist, but not dry, air.[citation needed]
Compounds
[edit]
Common oxidation states of cobalt include +2 and +3, although compounds with oxidation states ranging from −3 to +5 are also known. A common oxidation state for simple compounds is +2 (cobalt(II)). These salts form the pink-colored metal aquo complex [Co(H
2O)
6]2+
in water. Addition of chloride gives the intensely blue [CoCl
4]2−
.[6] In a borax bead flame test, cobalt shows deep blue in both oxidizing and reducing flames.[21]
Oxygen and chalcogen compounds
[edit]Several oxides of cobalt are known. Green cobalt(II) oxide (CoO) has rocksalt structure. It is readily oxidized with water and oxygen to brown cobalt(III) hydroxide (Co(OH)3). At temperatures of 600–700 °C, CoO oxidizes to the blue cobalt(II,III) oxide (Co3O4), which has a spinel structure.[6] Black cobalt(III) oxide (Co2O3) is also known.[22] Cobalt oxides are antiferromagnetic at low temperature: CoO (Néel temperature 291 K) and Co3O4 (Néel temperature: 40 K), which is analogous to magnetite (Fe3O4), with a mixture of +2 and +3 oxidation states.[23]
The principal chalcogenides of cobalt are the black cobalt(II) sulfides, CoS2 (pyrite structure), Co2S3 (spinel structure), and CoS (nickel arsenide structure).[6]: 1118
Halides
[edit]
Four dihalides of cobalt(II) are known: cobalt(II) fluoride (CoF2, pink), cobalt(II) chloride (CoCl2, blue), cobalt(II) bromide (CoBr2, green), cobalt(II) iodide (CoI2, blue-black). These halides exist in anhydrous and hydrated forms. Whereas the anhydrous dichloride is blue, the hydrate is red.[24]
The reduction potential for the reaction Co3+
+ e− → Co2+
is +1.92 V, beyond that for chlorine to chloride, +1.36 V. Consequently, cobalt(III) chloride would spontaneously reduce to cobalt(II) chloride and chlorine. Because the reduction potential for fluorine to fluoride is so high, +2.87 V, cobalt(III) fluoride is one of the few simple stable cobalt(III) compounds. Cobalt(III) fluoride, which is used in some fluorination reactions, reacts vigorously with water.[19]
Coordination compounds
[edit]The inventory of complexes is very large. Starting with higher oxidation states, complexes of Co(IV) and Co(V) are rare. Examples are found in caesium hexafluorocobaltate(IV) (Cs2CoF6) and potassium percobaltate (K3CoO4).[19]
Cobalt(III) forms a wide variety of coordination complexes with ammonia and amines, which are called ammine complexes. Examples include [Co(NH3)6]3+, [Co(NH3)5Cl]2+ (chloropentamminecobalt(III)), and cis- and trans-[Co(NH3)4Cl2]+. The corresponding ethylenediamine complexes are also well known. Analogues are known where the halides are replaced by nitrite, hydroxide, carbonate, etc. Alfred Werner worked extensively on these complexes in his Nobel-prize winning work.[25] The robustness of these complexes is demonstrated by the optical resolution of tris(ethylenediamine)cobalt(III) ([Co(en)
3]3+
).[26]
Cobalt(II) forms a wide variety of complexes, but mainly with weakly basic ligands. The pink-colored cation hexaaquocobalt(II) [Co(H2O)6]2+ is found in several routine cobalt salts such as the nitrate and sulfate. Upon addition of excess chloride, solutions of the hexaaquo complex converts to the deep blue CoCl2−4, which is tetrahedral.[citation needed]
Softer ligands like triphenylphosphine form complexes with Co(II) and Co(I), examples being bis- and tris(triphenylphosphine)cobalt(I) chloride, CoCl2(PPh3)2 and CoCl(PPh3)3. These Co(I) and Co(II) complexes represent a link to the organometallic complexes described below.[citation needed]
Organometallic compounds
[edit]
Cobaltocene is a structural analog to ferrocene, with cobalt in place of iron. Cobaltocene is much more sensitive to oxidation than ferrocene.[27] Cobalt carbonyl (Co2(CO)8) is a catalyst in carbonylation and hydrosilylation reactions.[28] Vitamin B12 (see below) is an organometallic compound found in nature and is the only vitamin that contains a metal atom.[29] An example of an alkylcobalt complex in the otherwise uncommon +4 oxidation state of cobalt is the homoleptic complex tetrakis(1-norbornyl)cobalt(IV) (Co(1-norb)4), a transition metal-alkyl complex that is notable for its resistance to β-hydrogen elimination,[30] in accord with Bredt's rule. The cobalt(III) and cobalt(V) complexes [Li(THF)
4]+
[Co(1-norb)
4]−
and [Co(1-norb)
4]+
[BF
4]−
are also known.[31]
Isotopes
[edit]59Co is the only stable cobalt isotope and the only isotope that exists naturally on Earth. Twenty-two radioisotopes have been characterized: the most stable, 60Co, has a half-life of 5.2714 years; 57Co has a half-life of 271.81 days; 56Co has a half-life of 77.24 days; and 58Co has a half-life of 70.84 days. All the other radioactive isotopes of cobalt have half-lives shorter than 18 hours, and in most cases shorter than 1 second. This element also has 4 meta states, all of which have half-lives shorter than 15 minutes.[32]
The isotopes of cobalt range from 50Co to 78Co. The primary decay mode for isotopes with atomic masses less than that of the only stable isotope, 59Co, is electron capture and the primary mode of decay in isotopes with atomic mass greater than that is beta decay. The primary decay products below 59Co are element 26 (iron) isotopes; above that the decay products are element 28 (nickel) isotopes.[32]
The 59Co nucleus is detectable using nuclear magnetic resonance[33] and has a magnetic quadrupole moment. Among all NMR active nuclei, 59Co has the largest chemical shift range and the chemical shift can be correlated with the spectrochemical series.[34] Resonances are observed over a range of 20000 ppm, the width of the signals being up to 20 kHz. A widely used standard is potassium hexacyanocobaltate (0.1M K3Co(CN)6 in D2O), which, due to its high symmetry, has a rather small line width. Systems of low symmetry can yield broadened signals to an extent that renders the signals unobservable in fluid phase NMR, but still observable in solid state NMR.
Etymology
[edit]Many different stories about the origin of the word "cobalt" have been proposed. In one version the element cobalt was named after "kobelt", the name which 16th century German silver miners had given to a nuisance type of ore which occurred that was corrosive and issued poisonous gas.[35][36] Although such ores had been used for blue pigmentation since antiquity, the Germans at that time did not have the technology to smelt the ore into metal (cf. § History below).[37]
The authority on such kobelt ore (Latinized as cobaltum or cadmia[38][39]) at the time was Georgius Agricola.[35][37] He was also the oft-quoted authority on the mine spirits called "kobel" (Latinized as cobalus or pl. cobali) in a separate work.[40][41][42]
Agricola did not make a connection between the similarly named ore and spirit. However, a causal connection (ore blamed on "kobel") was made by a contemporary,[44] and a word origin connection (word "formed" from cobalus) made by a late 18th century writer.[45] Later, Grimms' dictionary (1868) noted the kobalt/kobelt ore was blamed on the mountain spirit (Bergmännchen[b]) which was also held responsible for "stealing the silver and putting out an ore that caused poor mining atmosphere (Wetter[46]) and other health hazards".[36]
Grimms' dictionary entries equated the word "kobel" with "kobold", and listed it as a mere variant diminutive,[48] but the latter is defined in it as a household spirit.[47] Some more recent commentators prefer to characterize the ore's namesake kobelt (recté kobel) as a gnome.[49][52]
The early 20th century Oxford English Dictionary (1st edition, 1908) upheld Grimm's etymology.[c][53] However, by around the same time in Germany, the alternate etymology not endorsed by Grimm (kob/kof "house, chamber" + walt "power, ruler") was being proposed as more convincing.[54][55]
Somewhat later, Paul Kretschmer (1928) explained that while this "house ruler" etymology was the proper one that backed the original meaning of kobold as household spirit, a corruption later occurred introducing the idea of "mine demon" to it.[56] The present edition of the Etymologisches Wörterbuch (25th ed., 2012) under "kobold" lists the latter, not Grimm's etymology, but still maintains, under its entry for "kobalt", that the cobalt ore may have gotten its name from "a type of mine spirit/demon" (daemon metallicus) while stating that this is "apparently" the kobold.[57]
Joseph William Mellor (1935) also stated that cobalt may derive from kobalos (κόβαλος), though other theories had been suggested.[58]
Alternate theories
[edit]Several alternative etymologies that have been suggested, which may not involve a spirit (kobel or kobold) at all. Karl Müller-Fraureuth conjectured that kobelt derived from Kübel, a bucket used in mining, frequently mentioned by Agricola,[54] namely the kobel/köbel (Latinized as modulus).[59]
Another theory given by the Etymologisches Wörterbuch derives the term from kōbathium[57] or rather cobathia (κωβάθια, "arsenic sulfide"[60]) which occurs as noxious fumes.[37]
An etymology from Slavonic kowalti was suggested by Emanuel Merck (1902).[61][58]
W. W. Skeat and J. Berendes construed κόβαλος as "parasite", i.e. as an ore parasitic to nickel,[58] but this explanation is faulted for its anachronism since nickel was not discovered until 1751.[62][63]
History
[edit]
Cobalt compounds have been used for centuries to impart a rich blue color to glass, glazes, and ceramics. Cobalt has been detected in Egyptian sculpture, Persian jewelry from the third millennium BC, in the ruins of Pompeii, destroyed in 79 AD, and in China, dating from the Tang dynasty (618–907 AD) and the Ming dynasty (1368–1644 AD).[64]
Cobalt has been used to color glass since the Bronze Age. The excavation of the Uluburun shipwreck yielded an ingot of blue glass, cast during the 14th century BC.[65][66] Blue glass from Egypt was either colored with copper, iron, or cobalt. The oldest cobalt-colored glass is from the eighteenth dynasty of Egypt (1550–1292 BC). The Egyptians sourced this cobalt from cobaltiferous alums found in Egypt's Western Oases.[67]
One possible origin of the word cobalt is the 16th century German "kobald", a type of ore. The first attempts to smelt those ores for copper or silver failed, yielding simply powder (cobalt(II) oxide) instead. Because the primary ores of cobalt always contain arsenic, smelting the ore oxidized the arsenic into the highly toxic and volatile arsenic oxide, adding to the notoriety of the ore.[68] Paracelsus, Georgius Agricola, and Basil Valentine all referred to such silicates as "cobalt".[69]
Swedish chemist Georg Brandt (1694–1768) is credited with discovering cobalt c. 1735, showing it to be a previously unknown element, distinct from bismuth and other traditional metals. Brandt called it a new "semi-metal",[70][71] naming it for the mineral from which he had extracted it.[72]: 153 He showed that compounds of cobalt metal were the source of the blue color in glass, which previously had been attributed to the bismuth found with cobalt. Cobalt became the first metal to be discovered since the pre-historical period. All previously known metals (iron, copper, silver, gold, zinc, mercury, tin, lead and bismuth) had no recorded discoverers.[73]
During the 19th century, a significant part of the world's production of cobalt blue (a pigment made with cobalt compounds and alumina) and smalt (cobalt glass powdered for use for pigment purposes in ceramics and painting) was carried out at the Norwegian Blaafarveværket.[74][75] The first mines for the production of smalt in the 16th century were located in Norway, Sweden, Saxony and Hungary. With the discovery of cobalt ore in New Caledonia in 1864, the mining of cobalt in Europe declined. With the discovery of ore deposits in Ontario, Canada, in 1904 and the discovery of even larger deposits in the Katanga Province in the Congo in 1914, mining operations shifted again.[68] When the Shaba conflict started in 1978, the copper mines of Katanga Province nearly stopped production.[76][77] The impact on the world cobalt economy from this conflict was smaller than expected: cobalt is a rare metal, the pigment is highly toxic, and the industry had already established effective ways for recycling cobalt materials. In some cases, industry was able to change to cobalt-free alternatives.[76][77]
In 1938, John Livingood and Glenn T. Seaborg discovered the radioisotope cobalt-60.[78] This isotope was famously used at Columbia University in the 1950s to establish parity violation in radioactive beta decay.[79][80]
After World War II, the US wanted to guarantee the supply of cobalt ore for military uses (as the Germans had been doing) and prospected for cobalt within the US. High purity cobalt was highly sought after for its use in jet engines and gas turbines.[81] An adequate supply of the ore was found in Idaho near Blackbird canyon. Calera Mining Company started production at the site.[82]
Cobalt demand has further accelerated in the 21st century as an essential constituent of materials used in rechargeable batteries, superalloys, and catalysts.[81] It has been argued that cobalt will be one of the main objects of geopolitical competition in a world running on renewable energy and dependent on batteries, but this perspective has also been criticised for underestimating the power of economic incentives for expanded production.[83]
Occurrence
[edit]The stable form of cobalt is produced in supernovae through the r-process.[84] It comprises 0.0029% of the Earth's crust. Except as recently delivered in meteoric iron, free cobalt (the native metal) is not found on Earth's surface because of its tendency to react with oxygen in the atmosphere. Small amounts of cobalt compounds are found in most rocks, soils, plants, and animals.[85] In the ocean cobalt typically reacts with chlorine.
In nature, cobalt is frequently associated with nickel. Both are characteristic components of meteoric iron, though cobalt is much less abundant in iron meteorites than nickel. As with nickel, cobalt in meteoric iron alloys may have been well enough protected from oxygen and moisture to remain as the free (but alloyed) metal.[86]
Cobalt in compound form occurs in copper and nickel minerals. It is the major metallic component that combines with sulfur and arsenic in the sulfidic cobaltite (CoAsS), safflorite (CoAs2), glaucodot ((Co,Fe)AsS), and skutterudite (CoAs3) minerals.[19] The mineral cattierite is similar to pyrite and occurs together with vaesite in the copper deposits of Katanga Province.[87] When it reaches the atmosphere, weathering occurs; the sulfide minerals oxidize and form pink erythrite ("cobalt glance": Co3(AsO4)2·8H2O) and spherocobaltite (CoCO3).[88][89]
Cobalt is also a constituent of tobacco smoke.[90] The tobacco plant readily absorbs and accumulates heavy metals like cobalt from the surrounding soil in its leaves. These are subsequently inhaled during tobacco smoking.[91]
Production
[edit]

| Country | Production | Reserves |
|---|---|---|
| 130,000 | 4,000,000 | |
| 10,000 | 600,000 | |
| 8,900 | 250,000 | |
| 5,900 | 1,500,000 | |
| 3,900 | 220,000 | |
| 3,800 | 500,000 | |
| 3,800 | 260,000 | |
| 3,000 | 100,000 | |
| 3,000 | 47,000 | |
| 2,700 | 36,000 | |
| 2,300 | 13,000 | |
| 2,200 | 140,000 | |
| 800 | 69,000 | |
| Other countries | 5,200 | 610,000 |
| World total | 190,000 | 8,300,000 |
The main ores of cobalt are cobaltite, erythrite, glaucodot and skutterudite (see above), but most cobalt is obtained by reducing the cobalt by-products of nickel and copper mining and smelting.[93][94]
Since cobalt is generally produced as a by-product, the supply of cobalt depends to a great extent on the economic feasibility of copper and nickel mining in a given market. Demand for cobalt was projected to grow 6% in 2017.[95]
Primary cobalt deposits are rare, such as those occurring in hydrothermal deposits, associated with ultramafic rocks, typified by the Bou-Azzer district of Morocco. At such locations, cobalt ores are mined exclusively, albeit at a lower concentration, and thus require more downstream processing for cobalt extraction.[96][97]
Several methods exist to separate cobalt from copper and nickel, depending on the concentration of cobalt and the exact composition of the used ore. One method is froth flotation, in which surfactants bind to ore components, leading to an enrichment of cobalt ores. Subsequent roasting converts the ores to cobalt sulfate, and the copper and the iron are oxidized to the oxide. Leaching with water extracts the sulfate together with the arsenates. The residues are further leached with sulfuric acid, yielding a solution of copper sulfate. Cobalt can also be leached from the slag of copper smelting.[98]
The products of the above-mentioned processes are transformed into the cobalt oxide (Co3O4). This oxide is reduced to metal by the aluminothermic reaction or reduction with carbon in a blast furnace.[19]

Extraction
[edit]
The United States Geological Survey estimates world reserves of cobalt at 11,000,000 metric tons.[99] The Democratic Republic of the Congo (DRC) currently produces 63% of the world's cobalt. This market share may reach 73% by 2025 if planned expansions by mining producers like Glencore Plc take place as expected. Bloomberg New Energy Finance has estimated that by 2030, global demand for cobalt could be 47 times more than it was in 2017.[100]
Democratic Republic of the Congo
[edit]
Changes that Congo made to mining laws in 2002[further explanation needed] attracted new investments in Congolese copper and cobalt projects.[101] In 2005, the top producer of cobalt was the copper deposits in the Democratic Republic of the Congo's Katanga Province. Formerly Shaba province, the area had almost 40% of global reserves, reported the British Geological Survey in 2009.[102]
The Mukondo Mountain project, operated by the Central African Mining and Exploration Company (CAMEC) in Katanga Province, may be the richest cobalt reserve in the world. It produced an estimated one-third of the total global cobalt production in 2008.[103] In July 2009, CAMEC announced a long-term agreement to deliver its entire annual production of cobalt concentrate from Mukondo Mountain to Zhejiang Galico Cobalt & Nickel Materials of China.[104]
In 2016, Chinese ownership of cobalt production in the Congo was estimated at over 10% of global cobalt supply, forming a key input to the Chinese cobalt refining industry and granting China substantial influence over the global cobalt supply chain.[105] Chinese control of Congolese cobalt has raised concern in Western nations which have sought to reduce supply chain reliance upon China and have expressed concern regarding labor and human rights violations in cobalt mines in the DRC.[106][107]
Glencore's Mutanda Mine shipped 24,500 tons of cobalt in 2016, 40% of Congo DRC's output and nearly a quarter of global production. After oversupply, Glencore closed Mutanda for two years in late 2019.[101][108] Glencore's Katanga Mining project is resuming as well and should produce 300,000 tons of copper and 20,000 tons of cobalt by 2019, according to Glencore.[95]
In February 2018, global asset management firm AllianceBernstein defined the DRC as economically "the Saudi Arabia of the electric vehicle age", due to its cobalt resources, as essential to the lithium-ion batteries that drive electric vehicles.[109]
On 9 March 2018, President Joseph Kabila updated the 2002 mining code, increasing royalty charges and declaring cobalt and coltan "strategic metals".[110][111] The 2002 mining code was effectively updated on 4 December 2018.[112]
In February 2025, the DRC implemented a four-month suspension of cobalt exports, citing an oversupply of the metal amid a price decline to its lowest level in 21 years. Cobalt, a key byproduct of copper mining, is an essential material in battery technology. The DRC accounts for approximately 75 percent of the global supply. Within the country, the China Molybdenum Company (CMOC) dominates the industry, contributing roughly 40 percent of the world's cobalt production. Over the past year, CMOC has significantly increased its output, doubling production from two of its mines in the DRC from 56,000 tonnes to 114,000 tonnes.[citation needed]
Labor conditions
[edit]Artisanal mining supplied 17% to 40% of the DRC production as of 2016.[113] Some 100,000 cobalt miners in Congo DRC use hand tools to dig hundreds of feet, with little planning and fewer safety measures, say workers and government and NGO officials, as well as The Washington Post reporters' observations on visits to isolated mines. The lack of safety precautions frequently causes injuries or death.[114] Mining pollutes the vicinity and exposes local wildlife and indigenous communities to toxic metals thought to cause birth defects and breathing difficulties, according to health officials.[115]
Child labor is used in mining cobalt from African artisanal mines.[113][116] Human rights activists have highlighted this and investigative journalism reporting has confirmed it.[117][118] This revelation prompted cell phone maker Apple Inc., on 3 March 2017, to stop buying ore from suppliers such as Zhejiang Huayou Cobalt who source from artisanal mines in the DRC, and begin using only suppliers that are verified to meet its workplace standards.[119][120] In 2023, Apple announced it would convert to using recycled cobalt by 2025.[121]
There is a push globally by the EU and major car manufacturers (OEM) for global production of cobalt to be sourced and –produced sustainably, responsibly and traceability of the supply chain. Mining companies are adopting and practising ESG initiatives in line with OECD Guidance and putting in place evidence of zero to low carbon footprint activities in the supply chain production of lithium-ion batteries. These initiatives are already taking place with major mining companies, artisanal and small-scale mining companies (ASM). Car manufacturers and battery manufacturer supply chains: Tesla, VW, BMW, BASF and Glencore are participating in several initiatives, such as the Responsible Cobalt Initiative[122] and Cobalt for Development[123] study. In 2018 BMW Group in partnership with BASF, Samsung SDI and Samsung Electronics have launched a pilot project in the DRC over one pilot mine, to improve conditions and address challenges for artisanal miners and the surrounding communities.
The political and ethnic dynamics of the region have in the past caused outbreaks of violence and years of armed conflict and displaced populations. This instability affected the price of cobalt and also created perverse incentives for the combatants in the First and Second Congo Wars to prolong the fighting, since access to diamond mines and other valuable resources helped to finance their military goals—which frequently amounted to genocide—and also enriched the fighters themselves. While DR Congo has in the 2010s not recently been invaded by neighboring military forces, some of the richest mineral deposits adjoin areas where Tutsis and Hutus still frequently clash, unrest continues although on a smaller scale and refugees still flee outbreaks of violence.[124]
Cobalt extracted from small Congolese artisanal mining endeavors in 2007 supplied a single Chinese company, Congo DongFang International Mining. A subsidiary of Zhejiang Huayou Cobalt, one of the world's largest cobalt producers, Congo DongFang supplied cobalt to some of the world's largest battery manufacturers, who produced batteries for ubiquitous products like the Apple iPhones. Because of accused labour violations and environmental concerns, LG Chem subsequently audited Congo DongFang in accordance with OECD guidelines. LG Chem, which also produces battery materials for car companies, imposed a code of conduct on all suppliers that it inspects.[125]
In December 2019, International Rights Advocates, a human rights NGO, filed a landmark lawsuit against Apple, Tesla, Dell, Microsoft and Google company Alphabet for "knowingly benefiting from and aiding and abetting the cruel and brutal use of young children" in mining cobalt.[126] The companies in question denied their involvement in child labour.[127] In 2024 the court ruled that the suppliers facilitate force labor but the US tech companies are not liable because they don't operate as a shared enterprise with the suppliers and that the "alleged injuries are not fairly traceable" to any of the defendants' conduct.[128] The book Cobalt Red[129][130] alleges that workers including children suffer injuries, amputations, and death as the result of the hazardous working conditions and mine tunnel collapses during artisanal mining of cobalt in the DRC.[131]
Since child and slave labor have been repeatedly reported in cobalt mining, primarily in the artisanal mines of DR Congo, technology companies seeking an ethical supply chain have faced shortages of this raw material and[132] the price of cobalt metal reached a nine-year high in October 2017, more than US$30 a pound, versus US$10 in late 2015.[133] After oversupply, the price dropped to a more normal $15 in 2019.[134][135] As a reaction to the issues with artisanal cobalt mining in DR Congo a number of cobalt suppliers and their customers have formed the Fair Cobalt Alliance (FCA) which aims to end the use of child labor and to improve the working conditions of cobalt mining and processing in the DR Congo. Members of FCA include Zhejiang Huayou Cobalt, Sono Motors, the Responsible Cobalt Initiative, Fairphone, Glencore and Tesla, Inc.[136][137]
Canada
[edit]In 2017, some exploration companies were planning to survey old silver and cobalt mines in the area of Cobalt, Ontario, where significant deposits are believed to lie.[138]
Cobalt mined in Canada is a by-product of nickel mining. Even so, in 2023 the country produced more than 5,000 tons of cobalt (43% is mined in Newfoundland and Labrador, the rest in Ontario, Manitoba and Quebec). Exports of cobalt and cobalt products totaled $568 million in 2023.[139]
Cuba
[edit]Canada's Sherritt International processes cobalt ores in nickel deposits from the Moa mines in Cuba, and the island has several others mines in Mayarí, Camagüey, and Pinar del Río. Continued investments by Sherritt International in Cuban nickel and cobalt production while acquiring mining rights for 17–20 years made the communist country third for cobalt reserves in 2019, before Canada itself.[140]
Indonesia
[edit]Starting from smaller amounts in 2021, Indonesia began producing cobalt as a byproduct of nickel production. By 2022, the country had become the world's second-largest cobalt producer, with Benchmark Mineral Intelligence forecasting Indonesian output to make up 20 percent of global production by 2030.[141] Cobalt production increased from 1,300 tons to 20,500 tons between 2015 and 2024 due to the Indonesian government's strategic initiative to develop a robust domestic supply chain for electric vehicles. An export ban in 2020 has ensured an influx of foreign investment in nickel and cobalt processing in the country.[11]
Applications
[edit]In 2016, 116,000 tonnes (128,000 short tons) of cobalt was used.[10] Cobalt has been used in the production of high-performance alloys.[93][94] It is also used in some rechargeable batteries.
Alloys
[edit]Cobalt-based superalloys have historically consumed most of the cobalt produced.[93][94] The temperature stability of these alloys makes them suitable for turbine blades for gas turbines and aircraft jet engines, although nickel-based single-crystal alloys surpass them in performance.[142] Cobalt-based alloys are also corrosion- and wear-resistant, making them, like titanium, useful for making orthopedic implants that do not wear down over time. The development of wear-resistant cobalt alloys started in the first decade of the 20th century with the stellite alloys, containing chromium with varying quantities of tungsten and carbon. Alloys with chromium and tungsten carbides are very hard and wear-resistant.[143] Special cobalt-chromium-molybdenum alloys like Vitallium are used for prosthetic parts (hip and knee replacements).[144] Cobalt alloys are also used for dental prosthetics as a useful substitute for nickel, which may be allergenic.[145] Some high-speed steels also contain cobalt for increased heat and wear resistance. The special alloys of aluminium, nickel, cobalt and iron, known as Alnico, and of samarium and cobalt (samarium–cobalt magnet) are used in permanent magnets.[146] It is also alloyed with 95% platinum for jewelry, yielding an alloy suitable for fine casting, which is also slightly magnetic.[147] In addition to structural and magnetic roles, cobalt alloys are critical in aerospace-grade electrical components. They are used in connectors, thermal switches, and microsensors that must endure extreme temperatures, vibration, and radiation—conditions typical in satellites, fighter aircraft, and hypersonic systems.[148] These alloys maintain conductivity and mechanical integrity even under fluctuating mission-critical loads.[149]
Batteries
[edit]Lithium cobalt oxide (LiCoO2, aka "LCO"), first sold commercially in 1991 by Sony, was widely used in lithium-ion battery cathodes until the 2010s. The material is composed of cobalt oxide layers with the lithium intercalated. These LCO batteries continue to dominate the market for consumer electronics. Batteries for electric cars however have shifted to lower cobalt technologies.[150]
In 2018 most cobalt in batteries was used in a mobile device,[151] a more recent application for cobalt is rechargeable batteries for electric cars. This industry increased five-fold in its demand for cobalt from 2016 to 2020, which made it urgent to find new raw materials in more stable areas of the world.[152] Demand is expected to continue or increase as the prevalence of electric vehicles increases.[153] Exploration in 2016–2017 included the area around Cobalt, Ontario, an area where many silver mines ceased operation decades ago.[152] Cobalt for electric vehicles increased 81% from the first half of 2018 to 7,200 tonnes in the first half of 2019, for a battery capacity of 46.3 GWh.[154][155]
As of August 2020 battery makers have gradually reduced the cathode cobalt content from 1/3 (NMC 111) to 1/5 (NMC 442) to currently 1/10 (NMC 811) and have also introduced the cobalt free lithium iron phosphate cathode into the battery packs of electric cars such as the Tesla Model 3.[156][157] Research was also conducted by the European Union into the possibility of eliminating cobalt requirements in lithium-ion battery production.[158][159] In September 2020, Tesla outlined their plans to make their own, cobalt-free battery cells.[160]
Nickel–cadmium[161] (NiCd) and nickel metal hydride[162] (NiMH) batteries also included cobalt to improve the oxidation of nickel in the battery.[161] Lithium iron phosphate batteries officially surpassed ternary cobalt batteries in 2021 with 52% of installed capacity. Analysts estimate that its market share will exceed 60% in 2024.[163]
Catalysts
[edit]Several cobalt compounds are oxidation catalysts. Cobalt acetate is used to convert xylene to terephthalic acid, the precursor of the bulk polymer polyethylene terephthalate. Typical catalysts are the cobalt carboxylates (known as cobalt soaps). They are also used in paints, varnishes, and inks as "drying agents" through the oxidation of drying oils.[164][165] However, their use is being phased out due to toxicity concerns.[166] The same carboxylates are used to improve the adhesion between steel and rubber in steel-belted radial tires. In addition they are used as accelerators in polyester resin systems.[167][168][169]
Cobalt-based catalysts are used in reactions involving carbon monoxide. Cobalt is also a catalyst in the Fischer–Tropsch process for the hydrogenation of carbon monoxide into liquid fuels.[170] Hydroformylation of alkenes often uses cobalt octacarbonyl as a catalyst.[171] The hydrodesulfurization of petroleum uses a catalyst derived from cobalt and molybdenum. This process helps to clean petroleum of sulfur impurities that interfere with the refining of liquid fuels.[165]
Pigments and coloring
[edit]

Before the 19th century, cobalt was predominantly used as a pigment. It has been used since the Middle Ages to make smalt, a blue-colored glass. Smalt is produced by melting a mixture of roasted mineral smaltite, quartz and potassium carbonate, which yields a dark blue silicate glass, which is finely ground after the production.[172] Smalt was widely used to color glass and as pigment for paintings.[173] In 1780, Sven Rinman discovered cobalt green, and in 1802 Louis Jacques Thénard discovered cobalt blue.[174] Cobalt pigments such as cobalt blue (cobalt aluminate), cerulean blue (cobalt(II) stannate), various hues of cobalt green (a mixture of cobalt(II) oxide and zinc oxide), and cobalt violet (cobalt phosphate) are used as artist's pigments because of their superior chromatic stability.[175][176]
Radioisotopes
[edit]Cobalt-60 (Co-60 or 60Co) is useful as a gamma-ray source because it can be produced in predictable amounts with high activity by bombarding cobalt with neutrons. It produces gamma rays with energies of 1.17 and 1.33 MeV.[32][177]
Cobalt is used in external beam radiotherapy, sterilization of medical supplies and medical waste, radiation treatment of foods for sterilization (cold pasteurization),[178] industrial radiography (e.g. weld integrity radiographs), density measurements (e.g. concrete density measurements), and tank fill height switches. The metal has the unfortunate property of producing a fine dust, causing problems with radiation protection. Cobalt from radiotherapy machines has been a serious hazard when not discarded properly, and one of the worst radiation contamination accidents in North America occurred in 1984, when a discarded radiotherapy unit containing cobalt-60 was mistakenly disassembled in a junkyard in Juarez, Mexico.[179][180]
Cobalt-60 has a radioactive half-life of 5.27 years. Loss of potency requires periodic replacement of the source in radiotherapy and is one reason why cobalt machines have been largely replaced by linear accelerators in modern radiation therapy.[181] Cobalt-57 (Co-57 or 57Co) is a cobalt radioisotope most often used in medical tests, as a radiolabel for vitamin B12 uptake, and for the Schilling test. Cobalt-57 is used as a source in Mössbauer spectroscopy and is one of several possible sources in X-ray fluorescence devices.[182][183]
Nuclear weapon designs could intentionally incorporate 59Co, some of which would be activated in a nuclear explosion to produce 60Co. The 60Co, dispersed as nuclear fallout, is sometimes called a cobalt bomb.[184][185]
Magnetic materials
[edit]Due to the ferromagnetic properties of cobalt, it is used in the production of various magnetic materials.[186] It is used in creating permanent magnets like Alnico magnets, known for their strong magnetic properties used in electric motors, sensors, and MRI machines.[187][188] It is also used in production of magnetic alloys like cobalt steel, widely used in magnetic recording media such as hard disks and tapes.[189]
Cobalt's ability to maintain magnetic properties at high temperatures makes it valuable in magnetic recording applications, ensuring reliable data storage devices.[190] Cobalt also contributes to specialized magnets such as samarium-cobalt magnets, which are vital in electronics for components like sensors and actuators.[191]
Other uses
[edit]- Cobalt is used in electroplating for its attractive appearance, hardness, and resistance to oxidation.[192]
- It is also used as a base primer coat for porcelain enamels.[193]
Biological role
[edit]Cobalt is essential to the metabolism of all animals. It is a key constituent of cobalamin, also known as vitamin B12, the primary biological reservoir of cobalt as an ultratrace element.[194][195] Bacteria in the stomachs of ruminant animals convert cobalt salts into vitamin B12, a compound which can only be produced by bacteria or archaea. A minimal presence of cobalt in soils therefore markedly improves the health of grazing animals, and an uptake of 0.20 mg/kg a day is recommended, because they have no other source of vitamin B12.[196]
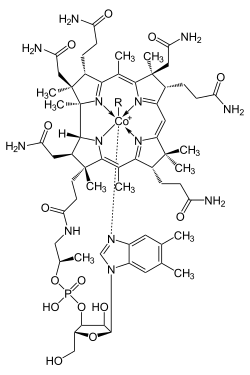
Proteins based on cobalamin use corrin to hold the cobalt. Coenzyme B12 features a reactive C-Co bond that participates in the reactions.[197] In humans, B12 has two types of alkyl ligand: methyl and adenosyl. MeB12 promotes methyl (−CH3) group transfers. The adenosyl version of B12 catalyzes rearrangements in which a hydrogen atom is directly transferred between two adjacent atoms with concomitant exchange of the second substituent, X, which may be a carbon atom with substituents, an oxygen atom of an alcohol, or an amine. Methylmalonyl coenzyme A mutase (MUT) converts MMl-CoA to Su-CoA, an important step in the extraction of energy from proteins and fats.[198]
Although far less common than other metalloproteins (e.g. those of zinc and iron), other cobaltoproteins are known besides B12. These proteins include methionine aminopeptidase 2, an enzyme that occurs in humans and other mammals that does not use the corrin ring of B12, but binds cobalt directly. Another non-corrin cobalt enzyme is nitrile hydratase, an enzyme in bacteria that metabolizes nitriles.[199]
Cobalt deficiency
[edit]In humans, consumption of cobalt-containing vitamin B12 meets all needs for cobalt. For cattle and sheep, which meet vitamin B12 needs via synthesis by resident bacteria in the rumen, there is a function for inorganic cobalt. In the early 20th century, during the development of farming on the North Island Volcanic Plateau of New Zealand, cattle suffered from what was termed "bush sickness". It was discovered that the volcanic soils lacked the cobalt salts essential for the cattle food chain.[200][201] The "coast disease" of sheep in the Ninety Mile Desert of the Southeast of South Australia in the 1930s was found to originate in nutritional deficiencies of trace elements cobalt and copper. The cobalt deficiency was overcome by the development of "cobalt bullets", dense pellets of cobalt oxide mixed with clay given orally for lodging in the animal's rumen.[clarification needed][202][201][203]
-
Cobalt-deficient sheep
Health issues
[edit]| Hazards | |
|---|---|
| GHS labelling:[204] | |
 
| |
| Danger | |
| H302, H317, H319, H334, H341, H350, H360F, H412 | |
| P273, P280, P301+P312, P302+P352, P305+P351+P338, P308+P313 | |
| NFPA 704 (fire diamond) | |
The LD50 value for soluble cobalt salts has been estimated to be between 150 and 500 mg/kg.[205] In the US, the Occupational Safety and Health Administration (OSHA) has designated a permissible exposure limit (PEL) in the workplace as a time-weighted average (TWA) of 0.1 mg/m3. The National Institute for Occupational Safety and Health (NIOSH) has set a recommended exposure limit (REL) of 0.05 mg/m3, time-weighted average. The IDLH (immediately dangerous to life and health) value is 20 mg/m3.[206]
However, chronic cobalt ingestion has caused serious health problems at doses far less than the lethal dose. In 1966, the addition of cobalt compounds to stabilize beer foam in Canada led to a peculiar form of toxin-induced cardiomyopathy, which came to be known as beer drinker's cardiomyopathy.[207][208]
Furthermore, cobalt metal is suspected of causing cancer (i.e., possibly carcinogenic, IARC Group 2B) as per the International Agency for Research on Cancer (IARC) Monographs.[209]
It causes respiratory problems when inhaled.[210] It also causes skin problems when touched; after nickel and chromium, cobalt is a major cause of contact dermatitis.[211]
Notes
[edit]- ^ The thermal expansion of cobalt is anisotropic: the coefficients for each crystal axis are (at 20 °C): αa = 10.9×10−6/K, αc = 17.9×10−6/K, and αaverage = αV/3 = 12.9×10−6/K.
- ^ Grimm's dictionary more specifically calls it "spectral mountain manikin" (gespenstisches Bergmännchen), elsewhere ("Kobold" II) it is notes kobold also refers to Berggeist in bergmännisch (miners' lingo).
- ^ Grimm derived and kobold from Greek kobalos, as aforestated; the OED concurred that kobold, kobelt (ore), kobel (mine spirit) were the same word.
References
[edit]- ^ "cobalt". Oxford English Dictionary (2nd ed.). Oxford University Press. 1989.
- ^ "Standard Atomic Weights: Cobalt". CIAAW. 2017.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. (4 May 2022). "Standard atomic weights of the elements 2021 (IUPAC Technical Report)". Pure and Applied Chemistry. doi:10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ a b Arblaster, John W. (2018). Selected Values of the Crystallographic Properties of Elements. Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ Co(–3) is known in Na3Co(CO)3; see John E. Ellis (2006). "Adventures with Substances Containing Metals in Negative Oxidation States". Inorganic Chemistry. 45 (8): 3167–3186. doi:10.1021/ic052110i.
- ^ a b c d Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1117–1119. doi:10.1016/C2009-0-30414-6. ISBN 978-0-08-037941-8.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 28. doi:10.1016/C2009-0-30414-6. ISBN 978-0-08-037941-8.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). "The NUBASE2020 evaluation of nuclear properties" (PDF). Chinese Physics C. 45 (3) 030001. doi:10.1088/1674-1137/abddae.
- ^ "cobalt". Oxford English Dictionary (2nd ed.). Oxford University Press. 1989.
- ^ a b Danielle Bochove (1 November 2017). "Electric car future spurs Cobalt rush: Swelling demand for product breathes new life into small Ontario town". Vancouver Sun. Bloomberg. Archived from the original on 28 July 2019.
- ^ a b GlobalData (17 January 2025). "Global cobalt supply to surpass 300kt mark in 2024, driven by production from the DRC and Indonesia". Mining Technology. Retrieved 20 April 2025.
- ^ "Catalysts". Cobalt Institute. Archived from the original on 16 August 2023. Retrieved 15 August 2023.
- ^ Enghag, Per (2004). "Cobalt". Encyclopedia of the elements: technical data, history, processing, applications. Wiley. p. 667. ISBN 978-3-527-30666-4.
- ^ Murthy, V. S. R (2003). "Magnetic Properties of Materials". Structure And Properties of Engineering Materials. McGraw-Hill Education (India) Pvt Limited. p. 381. ISBN 978-0-07-048287-6.
- ^ Celozzi, Salvatore; Araneo, Rodolfo; Lovat, Giampiero (1 May 2008). Electromagnetic Shielding. Wiley. p. 27. ISBN 978-0-470-05536-6.
- ^ Lee, B.; Alsenz, R.; Ignatiev, A.; Van Hove, M.; Van Hove, M. A. (1978). "Surface structures of the two allotropic phases of cobalt". Physical Review B. 17 (4): 1510–1520. Bibcode:1978PhRvB..17.1510L. doi:10.1103/PhysRevB.17.1510.
- ^ "Properties and Facts for Cobalt". American Elements. Archived from the original on 2 October 2008. Retrieved 19 September 2008.
- ^ Cobalt. Brussels: Centre d'Information du Cobalt. 1966. p. 45.
- ^ a b c d e Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). "Cobalt". Lehrbuch der Anorganischen Chemie (in German) (102nd ed.). de Gruyter. pp. 1146–1152. ISBN 978-3-11-017770-1.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall. p. 722. ISBN 978-0-13-175553-6.
- ^ Rutley, Frank (6 December 2012). Rutley's Elements of Mineralogy. Springer Science & Business Media. p. 40. ISBN 978-94-011-9769-4.
- ^ Krebs, Robert E. (2006). The history and use of our earth's chemical elements: a reference guide (2nd ed.). Greenwood Publishing Group. p. 107. ISBN 0-313-33438-2.
- ^ Petitto, Sarah C.; Marsh, Erin M.; Carson, Gregory A.; Langell, Marjorie A. (2008). "Cobalt oxide surface chemistry: The interaction of CoO(100), Co3O4(110) and Co3O4(111) with oxygen and water". Journal of Molecular Catalysis A: Chemical. 281 (1–2): 49–58. doi:10.1016/j.molcata.2007.08.023. S2CID 28393408.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1119–1120. doi:10.1016/C2009-0-30414-6. ISBN 978-0-08-037941-8.
- ^ Werner, A. (1912). "Zur Kenntnis des asymmetrischen Kobaltatoms. V". Chemische Berichte. 45: 121–130. doi:10.1002/cber.19120450116.
- ^ Gispert, Joan Ribas (2008). "Early Theories of Coordination Chemistry". Coordination chemistry. Wiley. pp. 31–33. ISBN 978-3-527-31802-5. Archived from the original on 5 May 2016. Retrieved 27 June 2015.
- ^ House, James e. (2008). Inorganic chemistry. Academic Press. p. 767. ISBN 978-0-12-356786-4. Retrieved 16 May 2011.
- ^ Starks, Charles M.; Liotta, Charles Leonard; Halpern, Marc (1994). Phase-transfer catalysis: fundamentals, applications, and industrial perspectives. Springer. p. 600. ISBN 978-0-412-04071-9. Retrieved 16 May 2011.
- ^ Sigel, Astrid; Sigel, Helmut; Sigel, Roland, eds. (2010). Organometallics in Environment and Toxicology (Metal Ions in Life Sciences). Cambridge, UK: Royal Society of Chemistry Publishing. p. 75. ISBN 978-1-84755-177-1.
- ^ Byrne, Erin K.; Richeson, Darrin S.; Theopold, Klaus H. (1 January 1986). "Tetrakis(1-norbornyl)cobalt, a low spin tetrahedral complex of a first row transition metal". Journal of the Chemical Society, Chemical Communications (19): 1491. doi:10.1039/C39860001491. ISSN 0022-4936.
- ^ Byrne, Erin K.; Theopold, Klaus H. (1 February 1987). "Redox chemistry of tetrakis(1-norbornyl)cobalt. Synthesis and characterization of a cobalt(V) alkyl and self-exchange rate of a Co(III)/Co(IV) couple". Journal of the American Chemical Society. 109 (4): 1282–1283. doi:10.1021/ja00238a066. ISSN 0002-7863.
- ^ a b c Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). "The NUBASE2020 evaluation of nuclear properties" (PDF). Chinese Physics C. 45 (3) 030001. doi:10.1088/1674-1137/abddae.
- ^ Chan J, Auyeung S (2000). "Cobalt-59 NMR spectroscopy". In Webb GA (ed.). Annual Reports on NMR Spectroscopy. Vol. 41. Elsevier. pp. 1–54. doi:10.1016/S0066-4103(00)41008-2. ISBN 978-0-12-505341-9.
- ^ Yamasaki, A (1991). "Cobalt-59 Nuclear Magnetic Resonance Spectroscopy in Coordination Chemistry". Journal of Coordination Chemistry. 24 (3): 211–260. doi:10.1080/00958979109407886.
- ^ a b c Ball, Philip (2003). Bright Earth: Art and the Invention of Color. University of Chicago Press. pp. 118–119. ISBN 9780226036281.
- ^ a b c Grimms; Hildebrand, Rudolf (1868). Deutsches Wörterbuch, Band 5, s.v. "Kobalt"
- ^ a b c d e f Wothers, Peter (2019). Antimony, Gold, and Jupiter's Wolf: How the elements were named. Oxford University Press. pp. 47–49. ISBN 9780192569905.
- ^ Agricola, Georgius (1546) [1530]. "Bermannus, sive de re metallica dialogus". Georgii Agricolae De ortu & causis subterraneorum lib. 5. De natura eorum quae effluunt ex terra lib. 4. De natura fossilium lib. 10. De ueteribus & nouis metallis lib. 2. Bermannus, siue De re metallica dialogus lib.1. Interpretatio Germanica uocum rei metallicæ, addito Indice fœcundissimo. Basel: Froben. pp. 441–442.
cobaltum nostri uocant, Græci cadmiam
; Cf. index under "cobaltum". - ^ Agricola, Georgius (1912). Georgius Agricola De Re Metallica: Tr. from the 1st Latin Ed. of 1556 (Books I–VIII). Translated by Hoover, Herbert Clark and Lou Henry Hoover. London: The Mining Magazine. pp. 112–113. Describes (and tabulates) German form kobelt; In two volumes: Second Part, Books IX–XII, contiguous pagination.
- ^ Agricola, Georgius (1614) [1549]. "37". In Johannes Sigfridus (ed.). Georgii Agricolae De Animantibus subterraneis. Witebergæ: Typis Meisnerianis. pp. 78–79.
- ^ a b Agricola, Georgius (1657) [1530]. "Animantium nomina latina, graega, q'ue germanice reddita, quorum author in Libro de subterraneis animantibus meminit". Georgii Agricolae Kempnicensis Medici Ac Philosophi Clariss. De Re Metallica Libri XII.: Quibus Officia, Instrumenta, Machinae, Ac Omnia Denique Ad Metallicam Spectantia, Non Modo Luculentissime describuntur; sed & per effigies, suis locis insertas ... ita ob oculos ponuntur, ut clarius tradi non possint. Basel: Sumptibus & Typis Emanuelis König. p. [762].
Dæmonum: Dæmon subterraneus trunculentus: bergterufel; mitis bergmenlein/kobel/guttel
- ^ This passage from the separate work, de animantibus is translated in footnote by the Agricola & Hoovers trr. (1912), p. 217, n26: "the Germans as well as the Greeks call cobalos".
- ^ Agricola & Hoovers trr. (1912), p. 214, n21.
- ^ Lutheran reformist theologian Johannes Mathesius's sermon (1652) on the nuisance kobelt ore believed caused by a demon known to the masses as kobel. Quoted in English by the Hoovers,[43] excerpted by Wothers.[37]
- ^ Johann Beckmann (Eng. tr. 1797), who did explicitly comment on the derivation of the word for "cobalt" ore as formed from kobel (Agricola's cobalus) has been cited by chemist Peter Wothers on this topic.[37]
- ^ "New and complete dictionary of the German language for Englishmen" s.v. "Das Wetter": "4. Air and vapours, damps, steams... among Miners", Küttner, Carl Gottlob; Nicholson, William, edd. (1813), vol. 3.
- ^ a b Grimms; Hildebrand, Rudolf (1868). Deutsches Wörterbuch, Band 5, s.v. "Kobold" at "III. 3) nebenformen"
- ^ Grimms dictionary states that kobalt and kobold are "the same word at its original source (ursprünglich)".[36] Also, Grimm's entry in "kobold", III. ursprung, nebenformen, 3) a) lists kobel as a diminutive Nebenname.[47]
- ^ Actually, among "gnomes and goblins".[35][37]
- ^ Lecouteux, Claude (2016). "BERGMÄNNCHEN (Bergmännlein, Bergmönch, Knappenmanndl, Kobel, Gütel; gruvrå in Sweden)". Encyclopedia of Norse and Germanic Folklore, Mythology, and Magic. Simon and Schuster. ISBN 9781620554814., cf. (in French) Lecouteux (2014), "BERGMÄNNCHEN", Dictionnaire de mythologie germanique, pp. 1995–1996.
- ^ Verardi, Donato (2023). Aristotelianism and Magic in Early Modern Europe: Philosophers, Experimenters and Wonderworkers. Bloomsbury Publishing. p. 85. ISBN 9781350357174.
- ^ The kobel was aka "bergmenlin" (mod. standard spelling Bergmännlein, Bergmännchen) according to Agricola's gloss.[41] Grimms dictionary also says the ores are caused by Bergmännchen sprites, but it thinks the miners call this "kobold", not distinguishable from "kobel". Lecouteux's dictionary defines "Bergmännchen" as "mine spirit" and admits "kobel" but not "kobld" as synonym.[50] More recently, literature is found that does not hesitate to call the Bergmännchen a "gnome".[51]
- ^ "cobalt". Oxford English Dictionary (Online ed.). Oxford University Press. (Subscription or participating institution membership required.); Murray, James A. H. ed. (1908) A New Eng. Dict. II, s.v."cobalt"
- ^ a b Müller-Fraureuth, Karl (1906). "Kap. 14". Sächsische Volkswörter: Beiträge zur mundartlichen Volkskunde. Dresden: Wilhelm Baensch. pp. 25–26. ISBN 978-3-95770-329-3.
{{cite book}}: ISBN / Date incompatibility (help) - ^ Glasenapp, Carl Friedrich [in German] (1911). "III. Der Kobold". Siegfried Wagner und seine Kunst: gesammelte Aufsätze über das dramatische Schaffen Siegfried Wagners vom "Bärenhäuter" bis zum "Banadietrich". Illustrated by Franz Stassen. Leipzig: Breitkopf & Härtel. p. 134.
- ^ Kretschmer, Paul (1928). "Weiteres zur Urgeschichte der Inder". Zeitschrift für vergleichende Sprachforschung auf dem Gebiete der indogermanischen Sprachen. 55. p. 89 and p. 87, n2.
- ^ a b Kluge, Friedrich; Seebold, Elmar, eds. (2012) [1899]. "Kobalt". Etymologisches Wörterbuch der deutschen Sprache (25 ed.). Walter de Gruyter GmbH & Co KG. p. 510. ISBN 9783110223651.
- ^ a b c Mellor, J. W. (1935) Cobalt A comprehensive treatise on inorganic and theoretical chemistry vol. XIV, p. 420.
- ^ Agricola (1546) p. 481: Latin: modulus = German: Kobel
- ^ Liddell and Scott (1940). A Greek–English Lexicon. s.v. "kwba/qia". Revised and augmented throughout by Sir Henry Stuart Jones with the assistance of Roderick McKenzie. Oxford: Clarendon Press. ISBN 0-19-864226-1. Online version retrieved 29 August 2024.
- ^ Merck, Emanuel (1902). "Cobaltum metall". Airy Nothings: Imagining the Otherworld of Faerie from the Middle Ages to the Age of Reason: Essays in Honour of Alasdair A. MacDonald (2 ed.). Darmstadt: E. Merck. p. 75.
- ^ Taylor, J. R. (1977). "The Origin and Use of Cobalt Compounds as Blue". Science and Archaeology. 19: 6.
- ^ "J. Berenedes" recté Berendes, J. (8 February 1899). "Die Namen der Elemente". Chemiker-Zeitung. 23 (11): 103.
- ^ Cobalt, Encyclopædia Britannica Online.
- ^ Pulak, Cemal (1998). "The Uluburun shipwreck: an overview". International Journal of Nautical Archaeology. 27 (3): 188–224. doi:10.1111/j.1095-9270.1998.tb00803.x.
- ^ Henderson, Julian (2000). "Glass". The Science and Archaeology of Materials: An Investigation of Inorganic Materials. Routledge. p. 60. ISBN 978-0-415-19933-9.
- ^ Abe, Yoshinari; Harimoto, Rodan; Kikugawa, Tadashi; Yazawa, Ken; Nishisaka, Akiko; Kawai, Nozomu; Yoshimura, Sakuji; Nakai, Izumi (2012). "Transition in the use of cobalt-blue colorant in the New Kingdom of Egypt". Journal of Archaeological Science. 39 (6): 1793–1808. doi:10.1016/j.jas.2012.01.021. ISSN 0305-4403. Retrieved 17 July 2025.
- ^ a b Dennis, W. H (2010). "Cobalt". Metallurgy: 1863–1963. AldineTransaction. pp. 254–256. ISBN 978-0-202-36361-5.
- ^ "Tariff Information Surveys on the Articles in Paragraph 1- of the Tariff Act of 1913 ... And Related Articles in Other Paragraphs". 17 August 2023.
- ^ Georg Brandt first showed cobalt to be a new metal in: G. Brandt (1735) "Dissertatio de semimetallis" (Dissertation on semi-metals), Acta Literaria et Scientiarum Sveciae (Journal of Swedish literature and sciences), vol. 4, pages 1–10.
See also: (1) G. Brandt (1746) "Rön och anmärkningar angäende en synnerlig färg—cobolt" (Observations and remarks concerning an extraordinary pigment—cobalt), Kongliga Svenska vetenskapsakademiens handlingar (Transactions of the Royal Swedish Academy of Science), vol. 7, pp. 119–130; (2) G. Brandt (1748) "Cobalti nova species examinata et descripta" (Cobalt, a new element examined and described), Acta Regiae Societatis Scientiarum Upsaliensis (Journal of the Royal Scientific Society of Uppsala), 1st series, vol. 3, pp. 33–41; (3) James L. Marshall and Virginia R. Marshall (Spring 2003) "Rediscovery of the Elements: Riddarhyttan, Sweden". The Hexagon (official journal of the Alpha Chi Sigma fraternity of chemists), vol. 94, no. 1, pages 3–8. - ^ Wang, Shijie (2006). "Cobalt—Its recovery, recycling, and application". Journal of the Minerals, Metals and Materials Society. 58 (10): 47–50. Bibcode:2006JOM....58j..47W. doi:10.1007/s11837-006-0201-y. S2CID 137613322.
- ^ Weeks, M. E. (1968). Discovery of the elements. (H. M. Leicester, Ed.; 7th ed.). Journal of chemical education.
- ^ Weeks, Mary Elvira (1932). "The discovery of the elements. III. Some eighteenth-century metals". Journal of Chemical Education. 9 (1): 22. Bibcode:1932JChEd...9...22W. doi:10.1021/ed009p22.
- ^ Ramberg, Ivar B. (2008). The making of a land: geology of Norway. Geological Society. p. 98. ISBN 978-82-92394-42-7. Retrieved 30 April 2011.
- ^ C. Tomlinson, ed. (1852). "Cobalt". Cyclopædia of useful arts & manufactures. pp. 400–403.
- ^ a b Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. "Global Nonfuel Mineral Resources and Sustainability". United States Geological Survey.
- ^ a b Westing, Arthur H; Stockholm International Peace Research Institute (1986). "cobalt". Global resources and international conflict: environmental factors in strategic policy and action. Oxford University Press. pp. 75–78. ISBN 978-0-19-829104-6.
- ^ Livingood, J.; Seaborg, Glenn T. (1938). "Long-Lived Radio Cobalt Isotopes". Physical Review. 53 (10): 847–848. Bibcode:1938PhRv...53..847L. doi:10.1103/PhysRev.53.847.
- ^ Wu, C. S. (1957). "Experimental Test of Parity Conservation in Beta Decay". Physical Review. 105 (4): 1413–1415. Bibcode:1957PhRv..105.1413W. doi:10.1103/PhysRev.105.1413.
- ^ Wróblewski, A. K. (2008). "The Downfall of Parity – the Revolution That Happened Fifty Years Ago". Acta Physica Polonica B. 39 (2): 251. Bibcode:2008AcPPB..39..251W. S2CID 34854662.
- ^ a b Roberts, Stephen; Gunn, Gus (6 January 2014), Gunn, Gus (ed.), "Cobalt", Critical Metals Handbook (1 ed.), Wiley, pp. 122–149, doi:10.1002/9781118755341.ch6, ISBN 978-0-470-67171-9, retrieved 1 December 2023
{{citation}}: CS1 maint: work parameter with ISBN (link) - ^ "Richest Hole in the Mountain". Popular Mechanics: 65–69. 1952.
- ^ Overland, Indra (1 March 2019). "The geopolitics of renewable energy: Debunking four emerging myths". Energy Research & Social Science. 49: 36–40. Bibcode:2019ERSS...49...36O. doi:10.1016/j.erss.2018.10.018. hdl:11250/2579292. ISSN 2214-6296.
- ^ Ptitsyn, D. A.; Chechetkin, V. M. (1980). "Creation of the Iron-Group Elements in a Supernova Explosion". Soviet Astronomy Letters. 6: 61–64. Bibcode:1980SvAL....6...61P.
- ^ Domingo, Jose L. (1989), "Cobalt in the Environment and Its Toxicological Implications", in Ware, George W. (ed.), Reviews of Environmental Contamination and Toxicology, vol. 108, New York: Springer, pp. 105–132, doi:10.1007/978-1-4613-8850-0_3, ISBN 978-1-4613-8850-0, PMID 2646660, retrieved 30 November 2023
- ^ Nuccio, Pasquale Mario; Valenza, Mariano (1979). "Determination of metallic iron, nickel and cobalt in meteorites" (PDF). Rendiconti Societa Italiana di Mineralogia e Petrografia. 35 (1): 355–360.
- ^ Kerr, Paul F. (1945). "Cattierite and Vaesite: New Co-Ni Minerals from the Belgian Kongo" (PDF). American Mineralogist. 30: 83–492.
- ^ Buckley, A. N. (1987). "The Surface Oxidation of Cobaltite". Australian Journal of Chemistry. 40 (2): 231. doi:10.1071/CH9870231.
- ^ Young, R. (1957). "The geochemistry of cobalt". Geochimica et Cosmochimica Acta. 13 (1): 28–41. Bibcode:1957GeCoA..13...28Y. doi:10.1016/0016-7037(57)90056-X.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). "Hazardous Compounds in Tobacco Smoke". International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207.
- ^ Pourkhabbaz, A; Pourkhabbaz, H (2012). "Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues". Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865. PMID 23493960.
- ^ Cobalt Statistics and Information (PDF), United States Geological Survey, 2023
- ^ a b c Shedd, Kim B. "Mineral Yearbook 2006: Cobalt" (PDF). United States Geological Survey. Retrieved 26 October 2008.
- ^ a b c Shedd, Kim B. "Commodity Report 2008: Cobalt" (PDF). United States Geological Survey. Retrieved 26 October 2008.
- ^ a b Henry Sanderson (14 March 2017). "Cobalt's meteoric rise at risk from Congo's Katanga". Financial Times. London.
- ^ Murray W. Hitzman, Arthur A. Bookstrom, John F. Slack, and Michael L. Zientek (2017). "Cobalt—Styles of Deposits and the Search for Primary Deposits". United States Geological Survey. Retrieved 17 April 2021.
- ^ "Cobalt price: BMW avoids the Congo conundrum – for now". Mining.com. Retrieved 17 April 2021.
- ^ Davis, Joseph R. (2000). ASM specialty handbook: nickel, cobalt, and their alloys. ASM International. p. 347. ISBN 0-87170-685-7.
- ^ "Cobalt" (PDF). United States Geological Survey, Mineral Commodity Summaries. January 2016. pp. 52–53.
- ^ Wilson, Thomas (26 October 2017). "We'll All Be Relying on Congo to Power Our Electric Cars". Bloomberg News. Retrieved 25 March 2023.
- ^ a b "Glencore's cobalt stock overhang contains prices despite mine suspension". Reuters. 8 August 2019.
- ^ "African Mineral Production" (PDF). British Geological Survey. Retrieved 6 June 2009.
- ^ "CAMEC – The Cobalt Champion" (PDF). International Mining. July 2008. Retrieved 18 November 2011.
- ^ Amy Witherden (6 July 2009). "Daily podcast – July 6, 2009". Mining weekly. Retrieved 15 November 2011.
- ^ Gulley, Andrew; McCullough, Erin; Shedd, Kim (August 2019). "China's domestic and foreign influence in the global cobalt supply chain". Resources Policy. 62: 317–323. Bibcode:2019RePol..62..317G. doi:10.1016/j.resourpol.2019.03.015.
- ^ "From Cobalt to Cars: How China Exploits Child and Forced Labor in the Congo | Congressional-Executive Commission on China". cecc.gov. 14 November 2023.
- ^ Home, Andy (19 February 2024). "West challenges China's critical minerals hold on Africa". Reuters.
- ^ "Glencore closes Mutanda mine, 20% of global cobalt supply comes offline". Benchmark Mineral Intelligence. 28 November 2019.
the mine would be placed on care and maintenance for a period of no less than two years
- ^ Mining Journal "The [Ivanhoe] pullback investors have been waiting for", Aspermont Ltd., London, UK, 22 February 2018. Retrieved 21 November 2018.
- ^ Shabalala, Zandi "Cobalt to be declared a strategic mineral in Congo", Reuters, 14 March 2018. Retrieved 3 October 2018.
- ^ Reuters, "Congo's Kabila signs into law new mining code", 14 March 2018. Retrieved 3 October 2018.
- ^ "DRC declares cobalt 'strategic'", Mining Journal, 4 December 2018. Retrieved 7 October 2020.
- ^ a b Frankel, Todd C. (30 September 2016). "Cobalt mining for lithium ion batteries has a high human cost". The Washington Post. Retrieved 18 October 2016.
- ^ Mucha, Lena; Sadof, Karly Domb; Frankel, Todd C. (28 February 2018). "Perspective – The hidden costs of cobalt mining". The Washington Post. ISSN 0190-8286. Retrieved 7 March 2018.
- ^ Frankel, Todd C. (30 September 2016). "The Cobalt Pipeline: Tracing the path from deadly hand-dug mines in Congo to consumers' phones and laptops". The Washington Post.
- ^ "Child labour behind smart phone and electric car batteries". Amnesty International. 19 January 2016. Retrieved 7 January 2018.
- ^ Crawford, Alex. "Meet Dorsen, 8, who mines cobalt to make your smartphone work". Sky News. Retrieved 7 January 2018.
- ^ "Are you holding a product of child labour right now? (Video)". Sky News. 28 February 2017. Retrieved 7 January 2018.
- ^ Reisinger, Don (3 March 2017). "Child Labor Revelation Prompts Apple to Make Supplier Policy Change". Fortune. Retrieved 7 January 2018.
- ^ Frankel, Todd C. (3 March 2017). "Apple cracks down further on cobalt supplier in Congo as child labor persists". The Washington Post. Retrieved 7 January 2018.
- ^ "Apple to use only recycled cobalt in batteries by 2025". Reuters. 2023. Retrieved 9 November 2024.
- ^ "Responsible Cobalt Initiative (RCI)". respect.international. Retrieved 28 November 2024.
- ^ Development, Cobalt for. "Cobalt for Development (C4D) - Towards responsible artisanal cobalt mining in the DR Congo". Cobalt for Development (C4D). Retrieved 28 November 2024.
- ^ Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. "Global Nonfuel Mineral Resources and Sustainability". Retrieved 16 May 2009.
- ^ Audit Report on Congo Dongfang International Mining sarl. DNV-GL Retrieved 18 April 2021.
- ^ "U.S. cobalt lawsuit puts spotlight on 'sustainable' tech". Sustainability Times. 17 December 2019. Retrieved 16 September 2020.
- ^ "Apple, Google Fight Blame For Child Labor in Cobalt Mines – Law360". law360.com. Retrieved 16 September 2020.
- ^ "Buying cobalt doesn't make US firms liable for abuses in DR Congo". 6 March 2024.
- ^ Kara, Siddharth (2023). Cobalt red: how the blood of the Congo powers our lives (First ed.). New York, New York: St. Martin's Press. ISBN 978-1-250-28429-7.
- ^ Aikins, Matthieu. "How Is Your Phone Powered? Problematically". The New York Times. Retrieved 9 November 2024.
Siddharth Kara's "Cobalt Red" takes a deep dive into the horrors of mining the valuable mineral – and the many who benefit from others' suffering.
- ^ Gross, Terry (1 February 2023). "How 'modern-day slavery' in the Congo powers the rechargeable battery economy". NPR. Retrieved 31 March 2025.
- ^ Hermes, Jennifer (31 May 2017). "Tesla & GE Face Major Shortage Of Ethically Sourced Cobalt". Environmentalleader.com. Archived from the original on 2 April 2019. Retrieved 7 January 2018.
- ^ "Electric cars yet to turn cobalt market into gold mine – Nornickel". Mining.com. 30 October 2017. Retrieved 7 January 2018.
- ^ "Why Have Cobalt Prices Crashed". International Banker. 31 July 2019. Archived from the original on 30 November 2019.
- ^ "Cobalt Prices and Cobalt Price Charts – InvestmentMine". infomine.com.
- ^ "Tesla joins "Fair Cobalt Alliance" to improve DRC artisanal mining". mining-technology.com. 8 September 2020. Retrieved 26 September 2020.
- ^ Klender, Joey (8 September 2020). "Tesla joins Fair Cobalt Alliance in support of moral mining efforts". teslarati.com. Retrieved 26 September 2020.
- ^ "The Canadian Ghost Town That Tesla Is Bringing Back to Life". Bloomberg.com. Archived from the original on 2 May 2024. Retrieved 18 April 2025.
- ^ Canada, Natural Resources (9 March 2023). "Cobalt facts". natural-resources.canada.ca. Retrieved 18 April 2025.
- ^ "Cubas Nickel Production Exceeds 50000 metric tons". Cuba Business Report. Retrieved 18 April 2021.
- ^ "The biggest source of cobalt outside Africa is now Indonesia". Bloomberg News. 8 February 2023. Retrieved 10 May 2023.
- ^ Donachie, Matthew J. (2002). Superalloys: A Technical Guide. ASM International. ISBN 978-0-87170-749-9.
- ^ Campbell, Flake C (30 June 2008). "Cobalt and Cobalt Alloys". Elements of metallurgy and engineering alloys. ASM International. pp. 557–558. ISBN 978-0-87170-867-0.
- ^ Michel, R.; Nolte, M.; Reich M.; Löer, F. (1991). "Systemic effects of implanted prostheses made of cobalt-chromium alloys". Archives of Orthopaedic and Trauma Surgery. 110 (2): 61–74. doi:10.1007/BF00393876. PMID 2015136. S2CID 28903564.
- ^ Disegi, John A. (1999). Cobalt-base Aloys for Biomedical Applications. ASTM International. p. 34. ISBN 0-8031-2608-5.
- ^ Luborsky, F. E.; Mendelsohn, L. I.; Paine, T. O. (1957). "Reproducing the Properties of Alnico Permanent Magnet Alloys with Elongated Single-Domain Cobalt-Iron Particles". Journal of Applied Physics. 28 (344): 344. Bibcode:1957JAP....28..344L. doi:10.1063/1.1722744.
- ^ Biggs, T.; Taylor, S. S.; Van Der Lingen, E. (2005). "The Hardening of Platinum Alloys for Potential Jewellery Application". Platinum Metals Review. 49: 2–15. doi:10.1595/147106705X24409.
- ^ Hypersonics Supply Chain Mapping Study (Report). National Defense Industrial Association (NDIA). 2023. Retrieved 24 June 2025.
- ^ "Modern Uses of Cobalt in Aerospace and Electronics". MineToMetal. Retrieved 24 June 2025.
- ^ Frith, James T.; Lacey, Matthew J.; Ulissi, Ulderico (26 January 2023). "A non-academic perspective on the future of lithium-based batteries". Nature Communications. 14 (1): 420. doi:10.1038/s41467-023-35933-2. ISSN 2041-1723. PMC 9879955. PMID 36702830.
- ^ Castellano, Robert (13 October 2017). "How To Minimize Tesla's Cobalt Supply Chain Risk". Seeking Alpha. Archived from the original on 4 April 2022. Retrieved 29 June 2022.
- ^ a b "As Cobalt Supply Tightens, LiCo Energy Metals Announces Two New Cobalt Mines". cleantechnica.com. 28 November 2017. Retrieved 7 January 2018.
- ^ Shilling, Erik (31 October 2017). "We May Not Have Enough Minerals To Even Meet Electric Car Demand". Jalopnik. Archived from the original on 1 April 2022. Retrieved 29 June 2022.
- ^ "State of Charge: EVs, Batteries and Battery Materials (Free Report from @AdamasIntel)". Adamas Intelligence. 20 September 2019. Archived from the original on 20 October 2019. Retrieved 20 October 2019.
- ^ "Muskmobiles running rivals off the road". MINING.COM. 26 September 2019. Archived from the original on 30 September 2019.
- ^ Yoo-chul, Kim (14 August 2020). "Tesla's battery strategy, implications for LG and Samsung". The Korea Times. Retrieved 26 September 2020.
- ^ Shahan, Zachary (31 August 2020). "Lithium & Nickel & Tesla, Oh My!". cleantechnica.com. Retrieved 26 September 2020.
- ^ CObalt-free Batteries for FutuRe Automotive Applications website
- ^ COBRA project at European Union
- ^ Calma, Justine (22 September 2020). "Tesla to make EV battery cathodes without cobalt". theverge.com. Retrieved 26 September 2020.
- ^ a b Armstrong, R. D.; Briggs, G. W. D.; Charles, E. A. (1988). "Some effects of the addition of cobalt to the nickel hydroxide electrode". Journal of Applied Electrochemistry. 18 (2): 215–219. doi:10.1007/BF01009266. S2CID 97073898.
- ^ Zhang, P.; Yokoyama, Toshiro; Itabashi, Osamu; Wakui, Yoshito; Suzuki, Toshishige M.; Inoue, Katsutoshi (1999). "Recovery of metal values from spent nickel–metal hydride rechargeable batteries". Journal of Power Sources. 77 (2): 116–122. Bibcode:1999JPS....77..116Z. doi:10.1016/S0378-7753(98)00182-7.
- ^ "EV Lithium Iron Phosphate Battery Battles Back". energytrend.com. 25 May 2022.
- ^ "Cobalt Drier for Paints | Cobalt Cem-All®". Borchers. Archived from the original on 9 July 2023. Retrieved 15 May 2021.
- ^ a b Hawkins, M. (2001). "Why we need cobalt". Applied Earth Science. 110 (2): 66–71. Bibcode:2001ApEaS.110...66H. doi:10.1179/aes.2001.110.2.66. S2CID 137529349.
- ^ Halstead, Joshua (April 2023). "Expanded Applications and Enhanced Durability of Alkyd Coatings Using High-Performance Catalysts". CoatingsTech. 20 (3). American Coatings Association: 45–55.
- ^ Weatherhead, R. G. (1980), Weatherhead, R. G. (ed.), "Catalysts, Accelerators and Inhibitors for Unsaturated Polyester Resins", FRP Technology: Fibre Reinforced Resin Systems, Dordrecht: Springer Netherlands, pp. 204–239, doi:10.1007/978-94-009-8721-0_10, ISBN 978-94-009-8721-0
{{citation}}: CS1 maint: work parameter with ISBN (link) - ^ "The product selector | AOC". aocresins.com. Retrieved 15 May 2021.
- ^ "Comar Chemicals – Polyester Acceleration". comarchemicals.com. Archived from the original on 15 May 2021. Retrieved 15 May 2021.
- ^ Khodakov, Andrei Y. Khodakov; Chu, Wei & Fongarland, Pascal (2007). "Advances in the Development of Novel Cobalt Fischer-Tropsch Catalysts for Synthesis of Long-Chain Hydrocarbons and Clean Fuels". Chemical Reviews. 107 (5): 1692–1744. doi:10.1021/cr050972v. PMID 17488058.
- ^ Hebrard, Frédéric & Kalck, Philippe (2009). "Cobalt-Catalyzed Hydroformylation of Alkenes: Generation and Recycling of the Carbonyl Species, and Catalytic Cycle". Chemical Reviews. 109 (9): 4272–4282. doi:10.1021/cr8002533. PMID 19572688.
- ^ Overman, Frederick (1852). A treatise on metallurgy. D. Appleton & company. pp. 631–637.
- ^ Muhlethaler, Bruno; Thissen, Jean (1969). "Smalt". Studies in Conservation. 14 (2): 47–61. doi:10.2307/1505347. JSTOR 1505347.
- ^ Gehlen, A. F. (1803). "Ueber die Bereitung einer blauen Farbe aus Kobalt, die eben so schön ist wie Ultramarin. Vom Bürger Thenard". Neues Allgemeines Journal der Chemie, Band 2. H. Frölich. (German translation from L. J. Thénard; Journal des Mines; Brumaire 12 1802; p 128–136)
- ^ Witteveen, H. J.; Farnau, E. F. (1921). "Colors Developed by Cobalt Oxides". Industrial & Engineering Chemistry. 13 (11): 1061–1066. doi:10.1021/ie50143a048.
- ^ Venetskii, S. (1970). "The charge of the guns of peace". Metallurgist. 14 (5): 334–336. doi:10.1007/BF00739447. S2CID 137225608.
- ^ Mandeville, C.; Fulbright, H. (1943). "The Energies of the γ-Rays from Sb122, Cd115, Ir192, Mn54, Zn65, and Co60". Physical Review. 64 (9–10): 265–267. Bibcode:1943PhRv...64..265M. doi:10.1103/PhysRev.64.265.
- ^ Wilkinson, V. M.; Gould, G. (1998). Food irradiation: a reference guide. Woodhead. p. 53. ISBN 978-1-85573-359-6.
- ^ Blakeslee, Sandra (1 May 1984). "The Juarez accident". The New York Times. Retrieved 6 June 2009.
- ^ "Ciudad Juarez orphaned source dispersal, 1983". Wm. Robert Johnston. 23 November 2005. Retrieved 24 October 2009.
- ^ National Research Council (U.S.). Committee on Radiation Source Use and Replacement; National Research Council (U.S.). Nuclear and Radiation Studies Board (January 2008). Radiation source use and replacement: abbreviated version. National Academies Press. pp. 35–. ISBN 978-0-309-11014-3. Retrieved 29 April 2011.
- ^ Meyer, Theresa (30 November 2001). Physical Therapist Examination Review. SLACK Incorporated. p. 368. ISBN 978-1-55642-588-2.
- ^ Kalnicky, D.; Singhvi, R. (2001). "Field portable XRF analysis of environmental samples". Journal of Hazardous Materials. 83 (1–2): 93–122. Bibcode:2001JHzM...83...93K. doi:10.1016/S0304-3894(00)00330-7. PMID 11267748.
- ^ Payne, L. R. (1977). "The Hazards of Cobalt". Occupational Medicine. 27 (1): 20–25. doi:10.1093/occmed/27.1.20. PMID 834025.
- ^ Puri-Mirza, Amna (2020). "Morocco Cobalt Production". Statistica.
- ^ Trento, Chin (14 April 2024). "What is Cobalt Used in Everyday Life". Stanford Advanced Materials. Retrieved 24 June 2024.
- ^ Croat, John; Ormerod, John, eds. (2022). "Chapter 11:Permanent magnet coatings and testing procedures". Modern Permanent Magnets. Woodhead Publishing Series in Electronic and Optical Materials. Woodhead Publishing. pp. 371–402. doi:10.1016/B978-0-323-88658-1.00011-X. ISBN 9780323886581. Retrieved 24 June 2024.
- ^ "Alnico Magnets: A Closer Look at Their History, Properties, and Applications". Radial Magnet. 15 February 2024. Retrieved 24 June 2024.
- ^ Mohapatra, Jeotikanta; Xing, Meiying (2020). "Hard and semi-hard magnetic materials based on cobalt and cobalt alloys". Journal of Alloys and Compounds. 824. doi:10.1016/j.jallcom.2020.153874.
- ^ Yousuf, Rehab; Mahmoud, Naglaa (2021). "Electric and magnetic properties of cobalt, copper and nickel organometallic complexes for molecular wires". Ain Shams Engineering Journal. 12 (2): 2135–2144. doi:10.1016/j.asej.2020.12.002.
- ^ "Samarium Cobalt vs Neodymium Magnets". Ideal Magnet Solutions. 15 May 2019. Retrieved 24 June 2024.
- ^ Davis, Joseph R; Handbook Committee, ASM International (1 May 2000). "Cobalt". Nickel, cobalt, and their alloys. ASM International. p. 354. ISBN 978-0-87170-685-0.
- ^ Committee on Technological Alternatives For Cobalt Conservation, National Research Council (U.S.); National Materials Advisory Board, National Research Council (U.S.) (1983). "Ground–Coat Frit". Cobalt conservation through technological alternatives. p. 129.
- ^ Yamada, Kazuhiro (2013). "Chapter 9. Cobalt: Its Role in Health and Disease". In Sigel, Astrid; Sigel, Helmut; Sigel, Roland K. O. (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 295–320. doi:10.1007/978-94-007-7500-8_9. ISBN 978-94-007-7499-5. PMID 24470095.
- ^ Cracan, Valentin; Banerjee, Ruma (2013). "Chapter 10 Cobalt and Corrinoid Transport and Biochemistry". In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 333–374. doi:10.1007/978-94-007-5561-1_10. ISBN 978-94-007-5560-4. PMID 23595677. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402.
- ^ Schwarz, F. J.; Kirchgessner, M.; Stangl, G. I. (2000). "Cobalt requirement of beef cattle – feed intake and growth at different levels of cobalt supply". Journal of Animal Physiology and Animal Nutrition. 83 (3): 121–131. doi:10.1046/j.1439-0396.2000.00258.x.
- ^ Voet, Judith G.; Voet, Donald (1995). Biochemistry. New York: J. Wiley & Sons. p. 675. ISBN 0-471-58651-X. OCLC 31819701.
- ^ Smith, David M.; Golding, Bernard T.; Radom, Leo (1999). "Understanding the Mechanism of B12-Dependent Methylmalonyl-CoA Mutase: Partial Proton Transfer in Action". Journal of the American Chemical Society. 121 (40): 9388–9399. doi:10.1021/ja991649a.
- ^ Kobayashi, Michihiko; Shimizu, Sakayu (1999). "Cobalt proteins". European Journal of Biochemistry. 261 (1): 1–9. doi:10.1046/j.1432-1327.1999.00186.x. PMID 10103026.
- ^ "Soils". Waikato University. Archived from the original on 25 January 2012. Retrieved 16 January 2012.
- ^ a b McDowell, Lee Russell (2008). Vitamins in Animal and Human Nutrition (2nd ed.). Hoboken: John Wiley & Sons. p. 525. ISBN 978-0-470-37668-3.
- ^ Australian Academy of Science > Deceased Fellows > Hedley Ralph Marston 1900–1965 Accessed 12 May 2013.
- ^ Snook, Laurence C. (1962). "Cobalt: its use to control wasting disease". Journal of the Department of Agriculture, Western Australia. 4. 3 (11): 844–852.
- ^ "Cobalt 356891". Sigma-Aldrich. 14 October 2021. Retrieved 22 December 2021.
- ^ Donaldson, John D. and Beyersmann, Detmar (2005) "Cobalt and Cobalt Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a07_281.pub2
- ^ NIOSH Pocket Guide to Chemical Hazards. "#0146". National Institute for Occupational Safety and Health (NIOSH).
- ^ Morin Y; Tětu A; Mercier G (1969). "Quebec beer-drinkers' cardiomyopathy: Clinical and hemodynamic aspects". Annals of the New York Academy of Sciences. 156 (1): 566–576. Bibcode:1969NYASA.156..566M. doi:10.1111/j.1749-6632.1969.tb16751.x. PMID 5291148. S2CID 7422045.
- ^ Barceloux, Donald G. & Barceloux, Donald (1999). "Cobalt". Clinical Toxicology. 37 (2): 201–216. doi:10.1081/CLT-100102420. PMID 10382556.
- ^ [PDF]
- ^ Elbagir, Nima; van Heerden, Dominique; Mackintosh, Eliza (May 2018). "Dirty Energy". CNN. Retrieved 30 May 2018.
- ^ Basketter, David A.; Angelini, Gianni; Ingber, Arieh; Kern, Petra S.; Menné, Torkil (2003). "Nickel, chromium and cobalt in consumer products: revisiting safe levels in the new millennium". Contact Dermatitis. 49 (1): 1–7. doi:10.1111/j.0105-1873.2003.00149.x. PMID 14641113. S2CID 24562378.
Further reading
[edit]
- Harper, E. M.; Kavlak, G.; Graedel, T. E. (2012). "Tracking the metal of the goblins: Cobalt's cycle of use". Environmental Science & Technology. 46 (2): 1079–86. Bibcode:2012EnST...46.1079H. doi:10.1021/es201874e. PMID 22142288. S2CID 206948482.
- Narendrula, R.; Nkongolo, K. K.; Beckett, P. (2012). "Comparative soil metal analyses in Sudbury (Ontario, Canada) and Lubumbashi (Katanga, DR-Congo)". Bulletin of Environmental Contamination and Toxicology. 88 (2): 187–92. Bibcode:2012BuECT..88..187N. doi:10.1007/s00128-011-0485-7. PMID 22139330. S2CID 34070357.
- Pauwels, H.; Pettenati, M.; Greffié, C. (2010). "The combined effect of abandoned mines and agriculture on groundwater chemistry". Journal of Contaminant Hydrology. 115 (1–4): 64–78. Bibcode:2010JCHyd.115...64P. doi:10.1016/j.jconhyd.2010.04.003. PMID 20466452.
- Bulut, G. (2006). "Recovery of copper and cobalt from ancient slag". Waste Management & Research. 24 (2): 118–24. Bibcode:2006WMR....24..118B. doi:10.1177/0734242X06063350. PMID 16634226. S2CID 24931095.
- Jefferson, J. A.; Escudero, E.; Hurtado, M. E.; Pando, J.; Tapia, R.; Swenson, E. R.; Prchal, J.; Schreiner, G. F.; Schoene, R. B.; Hurtado, A.; Johnson, R. J. (2002). "Excessive erythrocytosis, chronic mountain sickness, and serum cobalt levels". Lancet. 359 (9304): 407–8. doi:10.1016/s0140-6736(02)07594-3. PMID 11844517. S2CID 12319751.
- Løvold, T. V.; Haugsbø, L. (1999). "Cobalt mining factory--diagnoses 1822-32". Tidsskrift for den Norske Laegeforening. 119 (30): 4544–6. PMID 10827501.
- Bird, G. A.; Hesslein, R. H.; Mills, K. H.; Schwartz, W. J.; Turner, M. A. (1998). "Bioaccumulation of radionuclides in fertilized Canadian Shield lake basins". The Science of the Total Environment. 218 (1): 67–83. Bibcode:1998ScTEn.218...67B. doi:10.1016/s0048-9697(98)00179-x. PMID 9718743.
- Nemery, B. (1990). "Metal toxicity and the respiratory tract". The European Respiratory Journal. 3 (2): 202–19. doi:10.1183/09031936.93.03020202. PMID 2178966.
- Kazantzis, G. (1981). "Role of cobalt, iron, lead, manganese, mercury, platinum, selenium, and titanium in carcinogenesis". Environmental Health Perspectives. 40: 143–61. Bibcode:1981EnvHP..40..143K. doi:10.1289/ehp.8140143. PMC 1568837. PMID 7023929.
- Kerfoot, E. J.; Fredrick, W. G.; Domeier, E. (1975). "Cobalt metal inhalation studies on miniature swine". American Industrial Hygiene Association Journal. 36 (1): 17–25. doi:10.1080/0002889758507202. PMID 1111264.
External links
[edit]- . Encyclopædia Britannica. Vol. VI (9th ed.). 1878. pp. 81–83.
- Cobalt at The Periodic Table of Videos (University of Nottingham)
- Centers for Disease and Prevention – Cobalt
- usgs.gov (Mineral Commodity Summaries 2025): Cobalt