Périndopril
| Périndopril | |
| |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.120.843 |
| Code ATC | C09 |
| PubChem | 107807 |
| Propriétés chimiques | |
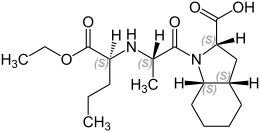
| Formule | C19H32N2O5 |
| Masse molaire[2] | 368,467 8 ± 0,019 3 g/mol C 61,93 %, H 8,75 %, N 7,6 %, O 21,71 %, [1] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le périndopril est un inhibiteur de l'enzyme de conversion de l’angiotensine (IEC)[3]. Il est prescrit dans le cas d'hypertension artérielle, de maladie coronaire stable et d'insuffisance cardiaque. Il inhibe la métabolisation de l'angiotensine I en angiotensine II. Cette protéine possède un puissant pouvoir vasoconstricteur sur les artérioles et dégrade la bradykinine vasodilatatrice. Ainsi une production diminuée d'angiotensine II donne lieu à une vasodilatation donc une diminution des résistances vasculaires périphériques (RVP) et par conséquent une baisse de la pression artérielle.
Le brevet du périndopril est tombé en 2003. En 2014, les laboratoires Servier et quatre laboratoires de génériques ont été condamnés à une amende de 428 millions d’euros par la commission européenne pour entrave à la fabrication d’un générique de sa molécule[4] ; Servier a fait appel de ce jugement.
Indications
[modifier | modifier le code]Le périndopril est indiqué dans l’hypertension artérielle et dans la maladie coronaire stable. Dans ce dernier contexte, le périndopril réduit le risque d’événements cardiaques chez les malades ayant un antécédent d’infarctus du myocarde et/ou de revascularisation.
Ce médicament est également indiqué dans le traitement de l’insuffisance cardiaque symptomatique.
Études cliniques
[modifier | modifier le code]EUROPA
[modifier | modifier le code]En 2003, les résultats de l'étude EUROPA ont été publiés dans The Lancet[5]. Douze mille deux cent dix huit (12 218) patients âgés de plus de 18 ans ont été répartis entre le groupe traité par périndopril à la dose de 8 mg (n=6 110) et le groupe placebo (n=6 108)[6]. La moyenne d’âge des patients était de 60 ans ; la plupart de ceux-ci recevaient le traitement étudié en plus de leur thérapie usuelle incluant des antiagrégants plaquettaires, des hypolipémiants et des bêta-bloquants. Le critère principal d'efficacité était un critère combiné associant la mortalité cardiovasculaire, l'infarctus du myocarde non fatal et/ou l'arrêt cardiaque récupéré[6].
Le traitement par le périndopril à la dose de 8 mg une fois par jour a abouti à une réduction absolue significative du critère principal de 1,9 % (soit une réduction du risque relatif de 20 %). Ce résultat montre que le périndopril, à la dose de 8 mg une fois par jour, prévient un décès cardiovasculaire, un infarctus du myocarde non fatal ou un arrêt cardiaque sur 50 patients coronariens traités pendant quatre ans[3].
Le périndopril a aussi un effet préventif sur le développement d'une insuffisance cardiaque[7]. Les patients de l'étude présentaient une maladie coronaire sans signe clinique d'insuffisance cardiaque. Au total, 90 % des patients avaient un antécédent d'infarctus du myocarde et/ou un antécédent de revascularisation coronaire. Par rapport au placebo, une diminution du risque absolu de 2,2 % (correspondant à une diminution du risque relatif de 22,4 %) du critère principal a été observée chez les patients ayant un antécédent d'infarctus du myocarde et/ou de revascularisation[6].
ASCOT
[modifier | modifier le code]Par ailleurs, l’étude ASCOT (Anglo-Scandinavian Cardiac Outcomes Trial)[8], présentée à l'European Society of Cardiology[9] a permis d’évaluer l’intérêt d’associer le périndopril à l’amlodipine (un inhibiteur calcique) dans la survenue d’infarctus du myocarde ou de mortalité cardiaque. Les 19 000 patients inclus étaient hypertendus, présentaient trois facteurs de risque additionnels — par exemple l’âge, le fait de fumer, le sexe, etc. — mais pas d’antécédents cardiaques ; deux stratégies de traitement ont été comparées : l'amlodipine associée au périndopril vs. un bêta-bloqueur (aténolol) à un diurétique. Les résultats de cette étude ont montré que l’association du périndopril à l'amlodipine réduisait le risque de mortalité toute cause (risque relatif 0,89, p=0,002), des accidents vasculaires cérébraux (risque relatif 0,77, p=0,0003), du nombre d’événements cardiovasculaires (risque relatif 0,84, p < 0,001) et de la survenue de nouveau diabète (risque relatif 0,70, p<0,001). Une diminution de la combinaison décès cardiovasculaires - infarctus - AVC (risque relatif 0,84, p=0,0003) a également été observée.
L’étude a été arrêtée prématurément à la suite d'une décision du comité de sécurité car 25 % des sujets ont dû cesser leur médication en raison d’effets secondaires, sans différence entre les deux groupes et les sujets sélectionnés étaient très malades, et ne représentent pas nécessairement la pratique usuelle[9].
Une préparation avec périndopril et amlodipine est commercialisée sous le nom de « Coveram » par les laboratoires Servier[10].
Contre-indications
[modifier | modifier le code]Le périndopril – hormis les situations classiques d’hypersensibilité au périndopril ou à l’un des excipients, ou à un autre inhibiteur de l’enzyme de conversion (IEC) – est contre-indiqué en cas d’antécédent d’angio-œdème lié à la prise d’un IEC, héréditaire ou idiopathique.
Le périndopril est également contre-indiqué chez la femme enceinte, à partir du 2e trimestre de la grossesse.
Enfin, l’utilisation concomitante de l’aliskiren chez les patients diabétiques ou insuffisants rénaux avec le périndopril est à exclure.
Précautions d’emploi
[modifier | modifier le code]Si un épisode d'angor instable (majeur ou non) se produit pendant le premier mois de traitement par le périndopril, une évaluation approfondie du rapport bénéfice/risque devra être effectuée avant la poursuite du traitement.
Hypotension
[modifier | modifier le code]De par leur mécanisme d’action, les IEC peuvent provoquer une chute de la pression artérielle. L'hypotension symptomatique est rarement observée mais peut se produire dans certaines populations telles que les patients traités par un diurétique, les insuffisants cardiaques (avec ou sans insuffisance rénale associée).
Une hypotension transitoire n'est pas une contre-indication à la poursuite du traitement, qui pourra être généralement poursuivi sans problème une fois la pression artérielle remontée à la suite de l'augmentation de la volémie. Si l'hypotension devient symptomatique, une diminution de la posologie ou l'arrêt du périndopril peut être nécessaire.
Sténose des valves aortique et mitrale / cardiomyopathie hypertrophique
[modifier | modifier le code]Comme les autres IEC, le périndopril doit être donné avec précaution chez les patients ayant une sténose de la valve mitrale et une obstruction du débit ventriculaire gauche telle qu'une sténose aortique ou une cardiomyopathie hypertrophique.
Insuffisance rénale
[modifier | modifier le code]En cas d'insuffisance rénale, (clairance de la créatinine < 60 ml/min) la posologie initiale de périndopril devra être ajustée en fonction de la clairance de la créatinine du patient et ensuite en fonction de la réponse du patient au traitement.
Patients hémodialysés
[modifier | modifier le code]Chez les patients dialysés et traités par un IEC, les membranes de haute perméabilité devront être évitées pour minimiser le risque de réactions anaphylactoïdes. Il conviendra d'utiliser un autre type de membrane de dialyse ou un agent antihypertenseur de classe différente chez ces patients.
Hypersensibilité/Angio-œdème
[modifier | modifier le code]Des angio-œdèmes de la face, des extrémités, des lèvres, des muqueuses, de la langue, de la glotte et/ou du larynx ont été rarement signalés chez les patients traités par un IEC, le périndopril inclus. Ceci peut se produire à n'importe quel moment du traitement. Dans de tels cas, le périndopril doit être arrêté immédiatement et le patient doit être surveillé jusqu'à disparition complète des symptômes. Le patient doit être maintenu sous surveillance médicale stricte jusqu'à disparition complète des symptômes. Les patients ayant un antécédent d'angio-œdème non lié à la prise d'un IEC sont sujets à un risque accru de faire un angio-œdème sous IEC.
Un angio-œdème intestinal a été rarement signalé chez des patients traités par inhibiteur de l'enzyme de conversion.
Insuffisance hépatique
[modifier | modifier le code]Les IEC ont été rarement associés à un syndrome commençant par une jaunisse cholestatique et pouvant conduire à une hépatite nécrosante fulminante et (parfois) à la mort. Le mécanisme de ce syndrome n'est pas élucidé.
Les patients sous IEC qui développent une jaunisse ou qui présentent une élévation marquée des enzymes hépatiques doivent arrêter le traitement par IEC et bénéficier d'une surveillance médicale appropriée.
Neutropénie, agranulocytose, thrombocytopénie, anémie
[modifier | modifier le code]Des neutropénie/agranulocytose thrombocytopénie et anémie ont été rapportées chez certains patients sous IEC.
Le périndopril doit être utilisé avec une extrême précaution chez les patients atteints de maladies du collagène vasculaire, chez les patients sous immunosuppresseur, chez les patients traités par allopurinol ou procaïnamide, ou chez les patients présentant une association de ces facteurs de risque, tout particulièrement en cas d'insuffisance rénale préexistante.
Toux
[modifier | modifier le code]Une toux a été rapportée avec l'utilisation des IEC. D'une façon caractéristique, la toux est non productive, persistante et disparaît à l'arrêt du traitement. La toux induite par les IEC devra faire partie du diagnostic différentiel de la toux.
Hyperkaliémie
[modifier | modifier le code]Des élévations de la kaliémie ont été observées chez certains patients traités avec des IEC, dont le périndopril. Les facteurs de risque d'hyperkaliémie sont une insuffisance rénale, une dégradation de la fonction rénale, l'âge (> 70 ans), le diabète, les événements intercurrents tels que déshydratation, décompensation cardiaque aiguë, acidose métabolique, utilisation concomitante de diurétiques épargneurs de potassium (par exemple: spironolactone, eplerenone, triamtérène, amiloride), de suppléments potassiques ou de substituts du sel contenant du potassium ou la prise d'autres traitements augmentant la kaliémie (par exemple: héparine).
Grossesse
[modifier | modifier le code]À moins que le traitement par IEC ne soit considéré comme essentiel, il est recommandé aux patientes qui envisagent une grossesse de modifier leur traitement antihypertenseur pour un médicament ayant un profil de sécurité bien établi pendant la grossesse. En cas de diagnostic de grossesse, le traitement par IEC doit être arrêté immédiatement, et si nécessaire, un traitement alternatif doit être débuté.
Excipients
[modifier | modifier le code]En raison de la présence de lactose, les patients présentant une galactosémie congénitale, une malabsorption du glucose et du galactose ou un déficit en lactase ne doivent pas prendre ce traitement.
Autres effets indésirables
[modifier | modifier le code]Le description des effets indésirables est issue de la notice publiée auprès de l'agence nationale de sécurité du médicament et des produits de santé (Ansm)[11].
Fréquents (entre 1 patient sur 10 et 1 patient sur 100)
[modifier | modifier le code]- Céphalée, étourdissement, vertige, paresthésie ;
- Hypotension et effets liés à une hypotension ;
- Toux, dyspnée ;
- Douleurs abdominales, constipation, diarrhée, dysgueusie, dyspepsie, nausées, vomissements ;
- Prurit, rash ;
- Crampes musculaires ;
- Asthénie.
Peu fréquents (entre 1 patient sur 100 et 1 patient sur 1 000)
[modifier | modifier le code]- Éosinophilie ;
- Hypoglycémie, hyperkaliémie, hyponatrémie ;
- Troubles de l’humeur, troubles du sommeil (somnipathie) ;
- Somnolence, syncope ;
- Palpitations, tachycardie ;
- Bronchospasme ;
- Sécheresse buccale (xérostomie) ;
- Urticaire, angio-œdème (œdème de Quincke), réactions de la photosensibilité, pemphigoïde, hyperhidrose ;
- Arthralgie, myalgie ;
- Insuffisance rénale ;
- Impuissance ;
- Douleur thoracique, malaise, œdème périphérique (en), fièvre ;
- Augmentation de l’urée sanguine, augmentation de la créatinine plasmatique ;
- Chute.
Rares (entre 1 patient sur 1 000 et 1 patient sur 10 000)
[modifier | modifier le code]- Élévation de la bilirubinémie ;
- Élévation des enzymes hépatiques.
Très rares (entre 1 patient sur 10 000 et 1 patient sur 100 000)
[modifier | modifier le code]- Agranulocytose ou pancytopénie, diminution de l’hémoglobine et de l’hématocrite, leucopénie, neutropénie, anémie hémolytique ou hémolyse chez les patients ayant un déficit congénital en G6P-DH, thrombocytopénie ;
- Confusion ;
- Angine de poitrine, arythmie, infarctus du myocarde ;
- Accident vasculaire cérébral ;
- Pneumonie à éosinophiles, rhinite ;
- Pancréatite ;
- Hépatite cytolytique ou choléstatique ;
- Érythème multiforme ;
- Insuffisance rénale aiguë.
Références
[modifier | modifier le code]- Masse molaire calculée d’après « (en) « Atomic weights of the elements 2015 », sur chem.qmul.ac.uk (version du sur Internet Archive) » (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- André Scheen et Victor Legrand, « L'étude clinique du mois : L'étude europa : protection cardio-vasculaire avec le périndopril chez les patients avec coronaropathie stable », Revue Médicale de Liège, vol. 58, no 11, , p. 713-6 (ISSN 0370-629X, lire en ligne, consulté le )
- Ententes et abus de position dominante : la Commission inflige des amendes à Servier et à cinq fabricants de génériques pour avoir freiné l’entrée sur le marché de versions moins chères d'un médicament cardiovasculaire, communiqué de presse de la commission européenne, 9 juillet 2014
- (en) Fox, K.M. et al., « Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study) », The Lancet, vol. 362, no 9386, , p. 782-788 (DOI 10.1016/S0140-6736(03)14286-9, lire en ligne [PDF])
- J. P. Hellermann et T. F. Lüscher, « Traitement habituel plus placebo ou perindopril chez le patient coronarien : l'étude EUROPA », Revue Médicale Suisse, vol. 0. 23810, (lire en ligne, consulté le ).
- Szucs, T.D., « Rapport coût-efficacité du périndopril chez les patients atteints de coronaropathie en Suisse – Une analyse de l’étude EUROPA », Revue Médicale Suisse, no 2483, , p. 1103-1104 (lire en ligne)
- (en) Dahlöf B, « Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial », The Lancet, vol. 366, no 9489, , p. 895-906 (lire en ligne, consulté le )
- L’étude ASCOT démontre la supériorité des « nouveaux » antihypertenseurs mais…, publié en 2005 par Luc Lanthier, sur le site de la Société québécoise d'hypertension artérielle (consulté le ).
- Médicament : « Coveram », sur eurekasante.vidal.fr, (consulté le ).
- Dénomination du médicament : Périndopril Mylan 4 mg, comprimé sécable, publié le sur le site de l'Ansm (consulté le ).