Sarcopénie
| Spécialité | Gériatrie |
|---|
| CIM-10 | M62.5 |
|---|---|
| CIM-9 | 728.2 |
| MeSH | D055948 |
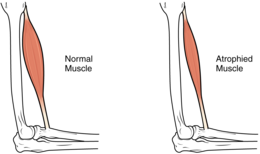
La sarcopénie est un syndrome gériatrique se caractérisant dans un premier temps par une diminution des capacités musculaires due à l'âge et qui en s’aggravant sera à l’origine d’une détérioration de la force musculaire et des performances physiques[1]. La sarcopénie observée chez la personne âgée est imputable au processus de vieillissement mais peut être accélérée par des facteurs pathologiques et comportementaux tels que la dénutrition et la sédentarité[2].
Définition et conséquences médico-économiques
[modifier | modifier le code]L’avancée en âge s’accompagne d’une modification de la composition corporelle. On constate une augmentation de masse grasse et une diminution de masse maigre (masse osseuse, organes, tissu musculaire). Le terme « sarcopénie » a initialement été défini par Irwin Rosenberg en 1989 pour désigner la diminution de la masse musculaire squelettique au cours du vieillissement. Ce mot provient du grec sarx pour « chair » et penia pour « manque ». Depuis 1989 la définition purement quantitative a évolué pour intégrer les notions de force et de qualité musculaire. En 2010, un groupe de travail européen sur la sarcopénie des populations âgées (European Working Group on Sarcopenia in Older People) a travaillé sur l’établissement d’une définition consensuelle de la sarcopénie. Il a insisté sur la nécessité de prendre en compte à la fois la perte de masse et la perte de fonction musculaire : ainsi la sarcopénie se définit maintenant comme la diminution de la masse et de la force musculaire, associées à une baisse des performances physiques[1].
Ce groupe suggère d’utiliser trois degrés conceptuels :
- la présarcopénie, qui est définie par une diminution de la masse musculaire uniquement,
- la sarcopénie, qui associe une baisse de la masse musculaire et la diminution soit de la force musculaire, soit de la performance,
- la sarcopénie sévère, associant la baisse de la masse, de la force et de la performance.
En 2019, le même groupe a actualisé son schéma de diagnostic de la sarcopénie (voir paragraphe diagnostic) [3].
La sarcopénie est à l’origine d’une détérioration générale de l’état physique se traduisant par une augmentation du risque de chutes, une incapacité progressive à effectuer des gestes du quotidien, une perte d’autonomie et conduit fatalement à une augmentation du taux de morbidité et de la mortalité[4],[5]. À ce titre, la sarcopénie est maintenant reconnue comme étant un facteur central dans la physiopathologie du syndrome de fragilité chez la personne âgée[6] et favorise l’entrée dans la dépendance. La sarcopénie est majorée par la dénutrition, fréquente chez les personnes âgées hospitalisées. Il s’ensuit des altérations de la marche, une augmentation du risque de chutes et d’invalidité[7], une vulnérabilité aux traumatismes, des altérations métaboliques (diabète de type 2)[8] etc..., d’où une dégradation de la qualité de vie et une augmentation des dépenses de santé[9],[10],[11].
Pour ce qui est des conséquences économiques, il est maintenant bien documenté que la sarcopénie augmente les complications infectieuses, la durée moyenne de séjour à l’hôpital de 4 jours, le pourcentage de réadmission de 20 % et les besoins de soins de réadaptation[12]. En France, le coût direct lié à la fragilité, dont la sarcopénie est la composante majeure, a été estimé à 1200 € par personne fragile et par an[9], soit un coût total estimé à plus de 2,4 milliards d’euros. En Europe, il a été estimé que l’existence d’une sarcopénie augmente les coûts d’une hospitalisation de plus de 50 %[10]. Aux Etats-Unis, la sarcopénie affecte environ 18 millions de personnes à un degré plus ou moins avancé avec un coût moyen de 18,5 milliards de $US en 2000[11] soit 1,5 % des dépenses de santé (lié à un nombre de visites médicales plus important, une augmentation et complexification des traitements médicamenteux, de nombreuses comorbidités comme l’ostéoporose, etc. soit plus de 1000 $US par individu atteint et par an[13].
La sarcopénie affecte toutes les personnes âgées y compris celles considérées en bonne santé[14] et les individus ayant gardé une activité sportive[15]. Différentes études estiment que 25 % des personnes de plus de 70 ans et 40 % des plus de 80 ans seraient sarcopéniques[16],[17]. Par ailleurs, la sarcopénie est un facteur de risque post opératoire en général et en particulier dans la prise en charge en chirurgie oncologique. De multiples études ont montré, d'une part, une augmentation de la morbi-mortalité post opératoire dans la plupart des cancers d'origine digestive, urologique et gynécologiques[18],[19],[20],[21]. La plupart des études, faites de façon rétrospective, ne prennent pas en compte les données sur la force musculaire et les performances physiques, ce qui peut diminuer l'impact de la sarcopénie dans les résultats en incluant des patients avec une faible masse musculaire mais sans retentissement musculaire. En effet Simonsen et al. (2018)[22] a montré une augmentation du risque relatif de 1,4 à 2,7 selon qu'on ne considère que la masse musculaire (calculé grâce au scanner) ou si l'on inclut l'étude de la force musculaire et des performances physiques.
Caractéristiques
[modifier | modifier le code]Diminution de la masse et de la force musculaire
[modifier | modifier le code]Dès 30 ans, on observe une dégénérescence musculaire de 3 à 8 % par décennie. Le tissu musculaire est remplacé par la masse grasse et cette perte s’accélère à partir de 50 ans[23]. En effet, la masse musculaire décline approximativement de 1 à 2 % par an passé l’âge de 50 ans tandis que la force décline en moyenne de 1,5 % par an entre 50 et 60 ans (-15 %), puis au rythme de 3 % par an, soit une perte de 30 % par décennie après 60 ans[24].
La diminution de la masse musculaire avec l’avancée en âge s’explique essentiellement par la perte de fibres musculaires qui touche à la fois les fibres de type I et II. Alors qu’une diminution de 5 % du nombre de fibres est observée entre 24 et 50 ans, une réduction de 30 à 40 % est rapportée entre 50 et 80 ans[25]. Néanmoins, l’atrophie des fibres musculaires, c’est-à-dire la diminution de leur diamètre, est également incriminée pour expliquer la diminution de la masse musculaire liée à l’âge[26]. Cette atrophie n’affecte pas de manière similaire tous les types de fibres musculaires. Ce sont les fibres de type II, dites « de contraction rapide », qui sont les plus affectées par l’avancée en âge[27].
L’une des principales explications à l’atrophie des fibres musculaires des populations âgées est l’altération de la synthèse des protéines musculaires avec l’âge[28].
Mécanisme
[modifier | modifier le code]La sarcopénie est un phénomène multifactoriel complexe. L’atrophie musculaire liée à l’âge résulte d’une part de la perte de cellules musculaires (myocyte) et d’autre part de la perte de protéines myofibrillaires. La taille du muscle dépend de la quantité de protéines totales du muscle et résulte donc d’un équilibre entre les vitesse et quantité de protéines synthétisées et les vitesses et quantité de protéines dégradées. Or chez la personne âgée, cet équilibre est rompu par une altération du renouvellement protéique. La masse musculaire dépend également de l’équilibre entre les processus d’apoptose et de régénération cellulaire. Certaines données suggèrent d’ailleurs qu’une augmentation de l’apoptose cellulaire pourrait jouer un rôle majeur durant le vieillissement musculaire [29],[30].
De multiples facteurs, interdépendants, participent au développement et à la progression de la sarcopénie. Ces facteurs contribuent, à des degrés variés, à la perte de masse et de force musculaires :
- une augmentation de l’extraction splanchnique (c’est-à-dire une rétention des acides aminés alimentaires par l’intestin et le foie pour leurs besoins propres) des acides aminés est observée et ceci limite la biodisponibilité postprandiale des acides aminés chez la personne âgée et en conséquence la réponse anabolique[31],[32] ;
- des apports nutritionnels inadaptés aux besoins de l’organisme au cours du vieillissement[33], les personnes atteintes de sarcopénie consomment d'ailleurs moins d'oméga-3, d'acide folique, de magnésium, de phosphore, de sélénium, de zinc et de vitamines C, D et E que celles sans sarcopénie[34] ;
- l’effet des hormones anaboliques est fortement perturbé au cours du vieillissement. Soit la concentration en hormone circulante est réduite[35],[36], soit la sensibilité du muscle à l’action de certaines hormones telle que l’insuline apparaît diminuée[37] ;
- une dénervation ainsi qu’une perte de la fonctionnalité des unités motrices est observée au cours du vieillissement et ceci entrainerait une moindre constructibilité des fibres musculaires[38] ;
- des dysfonctionnements mitochondriaux pourraient avoir un rôle déterminant dans l’apparition de la sarcopénie via la production d’espèces radicalaires, génératrices d’un stress oxydant[39].
Une étude de 2019, dirigée par France Piétri-Rouxel et Sestina Falcone, identifie la protéine CaVβ1E, normalement exprimée dans le muscle embryonnaire et réexprimée en cas d'atteinte du nerf périphérique. Elle active le facteur de croissance ou de différenciation cellulaire GDF5 (en) qui prévient alors l’atrophie du muscle. Ce mécanisme réparateur perd de son efficacité avec le vieillissement. Une surexpression de cette protéine permet, sur modèle murin, de récupérer plus de masse musculaire et de force, ce qui laisse présager des perspectives thérapeutiques face à la sarcopénie[40],[41].
Diagnostic
[modifier | modifier le code]Diagnostic proposé par l’EWGSOP en 2019
[modifier | modifier le code]En 2010, le groupe de travail européen sur la sarcopénie des populations âgées (European Working Group on Sarcopenia in Older People) a donné une première définition et un schéma de diagnostic de la sarcopénie. Depuis 2019, il propose une adaptation de ce schéma (figure 1), basée sur les caractéristiques cliniques associées à la sarcopénie.

C’est une méthode de diagnostic simple, ne nécessitant pas de gros appareillages. Ce diagnostic repose sur un arbre décisionnel en 4 étapes :
Étape 1 : examen clinique ou SARC F
[modifier | modifier le code]La première étape de ce diagnostic consiste à identifier les patients pour lesquels une sarcopénie est suspectée, soit par un examen clinique, basée sur l’expérience clinique du médecin, soit par le questionnaire SARC-F, un questionnaire en 5 questions. L’utilisation d’instruments de mesure n’étant pas toujours possible, surtout en cabinet de ville, le questionnaire SARC-F a été mis en place pour permettre un diagnostic rapide et facile de la sarcopénie. Un score supérieur ou égal à 4 doit faire supposer la présence d’une sarcopénie (ou dystrophie musculaire liée à l’âge) et doit donc entraîner un diagnostic plus approfondi. A contrario, si le score est inférieur ou égal à 3, le patient est diagnostiqué « non sarcopénique » mais des tests seront à refaire régulièrement.
Étape 2 : évaluation de la force musculaire
[modifier | modifier le code]Il s’agit d’une évaluation de la force musculaire faite par le biais de plusieurs indicateurs : soit la mesure de la force de préhension à l’aide d’un dynamomètre (mesure reproductible et fiable), soit un test de levée de chaise (se lever 5 fois de sa chaise en un temps chronométré). La force musculaire est faible lorsque la force de préhension est inférieure à 27 kg chez l’homme ou à 16 kg chez la femme ou bien lorsque 5 levés de chaise sont effectués en plus de 15 secondes.
À l’issue de cette évaluation, 2 solutions sont possibles : si la force musculaire est diagnostiquée comme faible alors l’individu est un « sarcopénique probable », et cela suffit pour mettre en place un traitement et pour chercher les causes de cette sarcopénie. En cas de force musculaire normale, l’individu n’est pas sarcopénique mais devra être régulièrement contrôlé.
Étape 3 : confirmation du diagnostic
[modifier | modifier le code]Chez les patients probablement sarcopéniques, l’évaluation de la qualité et de la quantité musculaire par des mesures de composition corporelle ou des techniques d’imageries médicales permettront de confirmer la présence de la sarcopénie. La composition corporelle peut être évaluée par absorptiométrie biphotonique (DEXA) ou par impédancemétrie. Il s’agit de mesurer la masse squelettique appendiculaire (MSA), c’est-à-dire la masse musculaire des membres supérieurs et inférieurs, ou l’indice de MSA (IMSA = MSA/taille2). La sarcopénie est confirmée lorsque la MSA est inférieure à 20 kg chez l’homme et 15 kg chez la femme ou lorsque l’IMSA est inférieur à 7 kg/m2 chez l’homme et 5,5 kg/m2 chez la femme. Si la sarcopénie n’est pas confirmée, les causes de sa force musculaire altérée seront étudiées et le patient sera suivi.
Étape 4 : évaluation de la gravité de la sarcopénie
[modifier | modifier le code]Chez les patients pour lesquels une sarcopénie est confirmée, cette quatrième étape permet d’évaluer la gravité de la sarcopénie par des tests de fonctionnalité musculaire :
- La vitesse de marche : il faut délimiter un parcours de 4 mètres (dans un couloir par exemple), marcher normalement du point de départ à l’arrivée du parcours délimité et se chronométrer. Après avoir parcouru ces 4 mètres, il vous reste à calculer la vitesse de marche en m/s :
Distance (4 mètres) / le temps de parcours (secondes).
- Le test du SPPB (cliquer ici pour tout savoir sur le SPPB) : s’il est inférieur ou égal à 8, il indique la présence d’une sarcopénie sévère.
- Le test du get up and go (cliquer ici pour tout savoir sur le test du get up and go) : s’il est effectué en plus de 30 secondes, il indique la présence d’une sarcopénie sévère.
Évolution de la masse musculaire
[modifier | modifier le code]Mesures anthropométriques
[modifier | modifier le code]La circonférence et l’épaisseur du pli cutané de la partie médiane du bras sont utilisées pour estimer la masse musculaire dans le cadre ambulatoire. Il n’y a pas de valeurs seuils définies en raison d’une trop grande variabilité individuelle. L’évolution des valeurs mesurées peut toutefois être un indicateur de sarcopénie.
La circonférence du mollet est positivement corrélée avec la masse musculaire. Lorsque cette circonférence est inférieure à 31 cm, elle est un indicateur de sarcopénie[42].
Cependant, ces mesures ne permettent pas de diagnostiquer la sarcopénie grâce à des valeurs seuils en raison des importantes variabilités individuelles. Elles peuvent toutefois permettre d’observer une évolution de la masse musculaire chez un patient. Finalement, peu d’études considèrent les mesures anthropométriques comme pertinentes chez les personnes âgées[43].
Bioimpédancemétrie
[modifier | modifier le code]La bioimpédancemétrie (BIA) permet d’estimer le rapport entre masse grasse et masse maigre. Cette technique est peu coûteuse, facile d’usage et appropriée à la fois pour les patients ambulatoires et alités. Des valeurs de référence ont été établies pour des populations d’hommes et de femmes. Janssen a utilisé un indice de masse musculaire correspondant à la masse musculaire mesurée par BIA (kg) divisé par la masse (kg) multiplié par cent. L’indice était ensuite ajusté à la taille et au tissu non squelettique (graisse-organe-os)[8]. Janssen établit des valeurs seuils de sarcopénie modérée avec la méthode BIA à 5,76 pour les femmes et à 8,51 pour les hommes[44].
Imagerie médicale
[modifier | modifier le code]DEXA
[modifier | modifier le code]L’ostéodensitométrie (DEXA en anglais) est une technique d’imagerie médicale permettant notamment d’analyser la composition corporelle. En 1998, Baumgartner définit la sarcopénie comme étant une diminution de deux écarts-type de la masse musculaire squelettique des membres, telle que mesurée par DEXA, divisée par la taille au carré chez des sujets âgés par rapport à la moyenne de ce rapport chez des personnes de moins de 30 ans en bonne santé participant à l’étude qu’il a menée[45]. Baumgartner[16] et Melton[46] ont publié des valeurs seuils pour le diagnostic de la sarcopénie par DEXA : 5,45 kg·m-2 pour les femmes et 7,26 kg·m-2 pour les hommes. Cette méthode est assez coûteuse et est trop complexe à mettre en œuvre pour effectuer des tests de routine.
IRM
[modifier | modifier le code]L’imagerie par résonance magnétique (IRM) permet de mesurer la masse musculaire ainsi que d’évaluer la qualité musculaire en calculant l’infiltration de la graisse dans le muscle. Cependant l’IRM est une méthode coûteuse non indiquée de façon systématique pour étudier la masse musculaire. Cette méthode est utilisée en recherche clinique.
CT scan
[modifier | modifier le code]La tomographie par ordinateur (en anglais : CT scan) est un système très précis permettant de différencier la masse grasse des autres tissus de l’organisme. Elle est l’une des techniques de référence dans la recherche. Cependant c’est une méthode très coûteuse. En général, l'évaluation se fait par calcul de l'aire musculaire, en coupe axiale, au niveau de la troisième vertèbre lombaire, sur deux coupes successives. La densité musculaire est comprise en -29 et +150 UH (unité Hounsfield). Il existe de multiples seuils selon le genre et les ethnies. Les seuils utilisés comme référence dans la population blanche sont :
- 38,5 cm2/m2 pour les femmes ;
- 52,4 cm2/m2 pour les hommes[47].
Évaluation de la force musculaire
[modifier | modifier le code]La force de préhension
[modifier | modifier le code]La force de préhension de la main mesurée par la méthode du Hand grip reflète la force maximale dérivée de la contraction combinée des muscles intrinsèques et extrinsèques de la main conduisant à la flexion des articulations de la main. La mesure de la force de préhension maximale mesurée avec un dynamomètre a été initialement développée pour déterminer la capacité de la main après une chirurgie[48]. En raison de sa faisabilité et de la pertinence des résultats obtenus, la mesure de la force de préhension est rapidement apparue en recherche clinique[1]. En effet, il a été démontré que la force de préhension est corrélée à la force musculaire des membres inférieurs (couple de force musculaire des extenseurs du genou, muscles du mollet)[48]. Une faible force de préhension maximale est ainsi considérée comme un marqueur clinique traduisant une faible mobilité[49]. Comme la force de préhension est corrélée avec un grand nombre d’indicateurs de la sarcopénie, sa mesure est actuellement considérée comme un moyen rapide et efficace d’estimer la condition physique d’une population âgée. Laurentani établit des valeurs seuils prédictives de sarcopénie par mesure de la force de préhension : inférieures à 20 kg pour les femmes et inférieures à 30 kg pour les hommes[49].
Flexion/extension du genou
[modifier | modifier le code]On la mesure généralement comme la force appliquée au niveau de la cheville chez un patient assis maintenant l’angle cuisse-mollet à 90 degrés[50].
Cette technique est adaptée en recherche clinique mais son utilisation en pratique clinique est limitée par la nécessité d’un équipement spécial et d’une formation du personnel.
Évaluation de la performance physique
[modifier | modifier le code]Les tests de performance physique fournissent des données pratiques permettant de situer facilement l’individu dans des normes et de mettre en place un suivi longitudinal[1].
Short Physical Performance Battery
[modifier | modifier le code]L’ensemble de ces tests permet d’évaluer l’équilibre, la marche, la force et l’endurance en examinant les capacités de l’individu à se tenir debout les pieds côte à côte, en décalé et l’un devant l’autre, à effectuer une marche sur 8 pas et à se lever et s’asseoir 5 fois d’affilée[51]. Chaque épreuve permet d’obtenir un score de performance. L’addition des scores de tous les tests permet d’obtenir un score de performance globale. Un score inférieur à 8 indique une sarcopénie[52].
Test de la marche
[modifier | modifier le code]Les tests de vitesse de marche sont habituellement réalisés sur 4 ou 6 m. Le seuil de détection de la sarcopénie est : une vitesse est inférieure à 1 m/s sur une distance de 6 m ou une vitesse inférieure à 0,8 m/s sur une distance de 4 m[53].
Timed up and go
[modifier | modifier le code]Le TUG est un test permettant de mesurer le temps nécessaire pour effectuer une série de tâches motrices basiques. Le patient doit se lever d’une chaise, marcher sur une distance de 3 mètres, faire demi-tour et revenir s’assoir. Il permet une évaluation de l’équilibre dynamique[54].
Stair climb power test
[modifier | modifier le code]Cette méthode permet d’estimer cliniquement la puissance des membres inférieurs. Le patient doit effectuer la montée de 10 marches le plus rapidement possible. La puissance des membres inférieurs est ensuite calculée par rapport à la hauteur des marches, la vitesse de montée et normalisée avec le poids du sujet[55].
Diagnostic proposé par l’EWGSOP en 2010
[modifier | modifier le code]
Le groupe de travail européen a établi une méthode de diagnostic de la sarcopénie (figure 2) intégrant les trois paramètres de sa définition, à savoir la masse musculaire, la force musculaire et la performance physique, dans le but de fournir un outil utilisable en pratique clinique et en routine[1].
Stratégies de prise en charge
[modifier | modifier le code]L’exercice physique
[modifier | modifier le code]Deux types d’activité physique sont à distinguer :
- les exercices en endurance permettant d’améliorer l’équilibre et l’appétit et d’augmenter les capacités respiratoires et la synthèse protéique musculaire en ayant toutefois une action minime sur la force musculaire ;
- les exercices en force contre résistance permettent d’augmenter rapidement la force musculaire et la qualité musculaire et ainsi la masse des muscles.
Chez des sujets âgés, des exercices en force contre résistance pratiqués à faible intensité, 40 % de la force maximale, 3 fois par semaine pendant 12 semaines, augmentent la force des muscles extenseurs du genou et l’épaisseur des muscles[56]. Une méta-analyse de 2003[57] portant sur 66 essais et près de 4 000 personnes âgées a montré que les exercices en force contre résistance avaient un effet positif sur la force musculaire. Même si les exercices en force contre résistance de faible intensité sont moins efficaces que ceux de forte intensité, ils sont souvent préférés car plus facilement adaptables aux capacités physiques des personnes âgées.
Un entrainement en endurance (20 à 40 minutes, quatre fois par semaine, pendant quatre mois) chez des hommes de plus de 60 ans favorise la synthèse protéique musculaire [58].
Pour lutter contre ou prévenir la sarcopénie, il est indispensable de pratiquer une activité physique régulière et adaptée alliant des exercices en endurance et des exercices en force : ceci permettra de ralentir le phénomène de vieillissement musculaire, d’améliorer la fatigue, l’équilibre, de prévenir les chutes et d'améliorer la qualité de vie. Cependant, l'activité physique, bien qu'indispensable, ne suffit pas. Une bonne hygiène de vie doit également être suivie : nutrition, sommeil...
En 2018, une équipe canadienne a mis en évidence chez des seniors sarcopéniques que l'association d'un entrainement physique (3 séances hebdomadaires de 30 minutes de vélo elliptique) avec la consommation de L-citrulline est plus efficace pour augmenter la force musculaire et la fonction musculaire que l’entrainement physique sans association avec la citrulline [59]. En 2019, cette même équipe a approfondi son analyse et a conclu que l'association de l'entrainement physique et la consommation de L-citrulline était plus bénéfique aux personnes qui consomment moins de 1g/kg/j de protéines que chez celles consommant plus de 1g/kg/j de protéines [60].
Nutrition
[modifier | modifier le code]Différentes études ont montré que chez le sujet âgé :
- consommer fréquemment une nourriture riche en fruits et légumes diminue significativement le risque de sarcopénie (chez l'homme et chez la femme)[61] ;
- la réponse anabolique « postprandiale » (suivant un repas) est meilleure si l'apport protéique est concentré sur un seul repas : 80 % des apports journaliers recommandés, évalués à 1 à 1,2 g par kilogramme de masse corporelle et par jour chez la personne âgée (on parle alors de nutrition pulsée ou de régime pulsé)[31],[32],[62],[63],[64],[65],[66]. Cet apport élevé sature partiellement l’extraction splanchnique et permet une meilleure biodisponibilité des acides aminés pour la stimulation de la synthèse protéique musculaire postprandiale.
Mais cet apport de 80 % des besoins protéiques en un seul repas (déjeuner) est difficile à mettre en place quotidiennement à domicile, et n’est donc pas adaptée à toute la population. Certains services gériatriques de pointe l'utilisent (ex. : à l’hôpital Émile Roux (Limeil-Brevannes).
Citrulline
[modifier | modifier le code]La citrulline est un acide aminé n’entrant pas dans la composition des protéines, dont l’intérêt dans la sarcopénie liée à l’âge vient du fait qu’il est le seul acide aminé à ne pas être capté par le foie, ce qui lui permet d’échapper à l’extraction splanchnique. La citrulline a un pouvoir stimulant sur la voie mTOR[67]. Ainsi, un apport chronique de L-citrulline permet une augmentation de la masse maigre de l’ordre de 8 % (et en particulier une augmentation de la masse musculaire de l’ordre de 25 %), associée à une diminution de la masse grasse cutanée (-14 %) et intra-abdominale (-42 %)[68]. Chez l’Homme, la consommation de L-citrulline est très bien tolérée (jusqu’à 15 g par jour) et induit de manière dose-dépendante une augmentation du bilan azoté (+57 %)[68],[69]. Les auteurs de ces travaux préconisent la dose de 10 g en utilisation clinique, en tant qu’adjuvant des traitements de la dénutrition et de la sarcopénie par exemple. Des résultats similaires ont été obtenus chez l'adulte âgé[70]. Une étude chez le volontaire sain soumis pendant 3 jours à un régime hypoprotéique montre qu’une complémentation en citrulline induit une augmentation de 25 % de la vitesse de la synthèse protéique musculaire[32]. Pour des raisons méthodologiques, la citrullinémie de ces sujets devait être stable. Elle était comprise entre 800 et 1 000 µM. La pharmacocinétique indique que pour obtenir une telle citrullinémie, une dose de 3,5 g de citrulline doit être ingérée. Chez des personnes âgées dénutries hospitalisées, un essai clinique randomisé en double aveugle montre qu'une complémentation en citrulline de 10 g par jour pendant 21 jours permet d'augmenter de 5 à 10 % la masse musculaire [71] et d’améliorer les performances physiques (Amélioration des performances physiques en EHPAD). Dans le même sens, chez des seniors de plus de 60 ans sarcopéniques (et obèses), 10 g de L-citrulline par jour pendant 3 mois, associés à un entrainement physique, est plus efficace pour augmenter la force musculaire et la fonction musculaire que l’entrainement physique sans association avec la citrulline [72]. Et dans une population de seniors plus hétérogènes, il a aussi été démontré que cette association entrainement physique et citrulline était plus bénéfique aux personnes qui consomment moins de 1g/kg/j de protéines que chez celles consommant plus de 1g/kg/j de protéines [73]. Cependant un essai sur des adultes en bonne santé n'a pas donné d'effet positif[74].
Leucine
[modifier | modifier le code]Parmi les acides aminés, les acides aminés à chaîne ramifiée, et en particulier la leucine, jouent un rôle primordial dans la synthèse des protéines musculaires. La leucine stimule la protéosynthèse musculaire par son action sur la voie mTOR[75]. Des études réalisées chez l’animal[76] et chez l’homme[77] suggèrent qu’une complémentation en leucine au moment du repas permet d’augmenter la synthèse protéique musculaire. Chez les personnes âgées l’effet stimulant de la leucine sur la synthèse protéique musculaire est limité en raison de l’augmentation de la séquestration splanchnique. Une étude chez le rat a montré que l’extraction splanchnique de la leucine est doublée chez les rats âgés[65]. Ainsi, plusieurs études, dont des méta-analyses, montrent que chez les personnes âgées, un enrichissement en leucine sur le long terme ne permet pas d’augmenter la force ou la fonction musculaire [78] ,[79],[80]
Les protéines rapides
[modifier | modifier le code]La vitesse d’absorption des protéines peut jouer un rôle important dans le biodisponibilité postprandiale des acides aminés et donc avoir une incidence sur la stimulation de la synthèse protéique musculaire[81]. Dans ce contexte, plus l’apparition des acides aminés dans le sang est massive et rapide, plus l’aire splanchnique a des chances d’être saturée. Une étude a montré que chez le sujet âgé l’ingestion de protéines rapides (telle que les protéines du lactosérum) permet un meilleur gain protéique post-prandial que l’ingestion de protéines lentes (telle que la caséine), à l’inverse de ce qui est observé chez le sujet jeune[82]. Cependant, des études montrent qu’une complémentation en protéines rapides chez des personnes âgées augmente la synthèse protéique musculaire [83] mais il n’y a pas d’augmentation de la force ou de la fonction musculaire.
Par ailleurs, des travaux de Claire Vinel, de l’Institut des maladies métaboliques et cardiovasculaires, à Toulouse, permettent d'envisager l'utilisation de l'Apeline — une hormone produite par le muscle en contraction — comme outil diagnostique et comme solution thérapeutique. Des essais cliniques seront menés dès 2019 pour en évaluer l’efficacité[84].
Vitamine D
[modifier | modifier le code]La vitamine D n’a pas montré d’efficacité sur la sarcopénie mais sur la réduction (de 19 à 23 %) du nombre de chutes liées à la faiblesse musculaire chez les personnes de plus de 65 ans [85]. Il est conseillé chez les personnes âgées de consommer 800 à 1 000 UI de vitamine D3 par jour (soit 20 µg), en pratique, cela peut être une dose de 100 000 UI tous les 3 mois) de façon à maintenir un bon niveau de vitamine D. Ceci est important car il est maintenant connu que la concentration sanguine de vitamine D est positivement associée à la vitesse de marche [86]. Cependant, une méta-analyse regroupant 15 études indique qu’une complémentation en vitamine D ne permet pas d’augmenter la force musculaire [87].
Notes et références
[modifier | modifier le code]- (en) Cruz-Jentoft AJ, Baeyens JP, Bauer JM, Boirie Y, Cederholm T, Landi F et al. « Sarcopenia: European Consensus on Definition and Diagnosis Report of the European Working Group on Sarcopenia in Older People » Age Ageing 2010 janv 7;39(4):412-23.
- (en) Buford TW, Anton SD, Judge AR, Marzetti E, Wohlgemuth SE, Carter CS et al. « Models of accelerated sarcopenia: Critical pieces for solving the puzzle of age-related muscle atrophy » Ageing Research Reviews 2010 oct;9(4):369-83.
- (en) Cruz-Jentoft et al. « Sarcopenia: revised European consensus on definition and diagnosis » Age Ageing 2019;48:16-31.
- (en) Goodpaster BH, Park SW, Harris TB, Kritchevsky SB, Nevitt M, Schwartz AV et al. « The Loss of Skeletal Muscle Strength, Mass, and Quality in Older Adults: The Health, Aging and Body Composition Study » J Gerontol A Biol Sci Med Sci. 2006 janv 10;61(10):1059-64.
- (en) Delmonico MJ, Harris TB, Lee J, Visser M, Nevitt M, Kritchevsky SB et al. « Alternative Definitions of Sarcopenia, Lower Extremity Performance, and Functional Impairment with Aging in Older Men and Women » Journal of the American Geriatrics Society 2007 mai 1;55(5):769-74.
- (en) Morley JE, Haren MT, Rolland Y, Kim MJ. « Frailty » Med. Clin. North Am. 2006 sept;90(5):837-47.
- (en) Kojima G. « Frailty as a predictor of disabilities among community-dwelling older people: a systematic review and meta-analysis » Disability and Rehabilitation 2017 Sep;39(19):1897-1908.
- (en) Janssen I, Heymsfield SB, Ross R. « Low relative skeletal muscle mass (sarcopenia) in older persons is associated with functional impairment and physical disability » J Am Geriatr Soc. 2002 mai;50(5):889-96.
- (en) Sirven N, Rapp T. « The cost of frailty in France. » Eur J Health Econ 2017 Mar;18(2):243-253.
- (en) Sousa AS, Guerra RS, Fonseca I et al. « Financial impact of sarcopenia on hospitalization costs. » Eur J Health Econ 2016 Sep;70(9):1046-51.
- (en) Janssen I, Shepard DS, Katzmarzyk PT, Roubenoff R. « The healthcare costs of sarcopenia in the United States. » J Am Geriatr Soc. 2004 Jan;52(1):80-5.
- (en) Gariballa S, Alessa A. « Sarcopenia: prevalence and prognostic significance in hospitalized patients. » Clinical Nutrition 2013 Oct;32(5):772-6.
- (en) Marcell TJ. « Sarcopenia: causes, consequences, and preventions. » J Gerontol A Biol Sci Med Sci 2003 Oct;58(10):M911-6.
- (en) Gallagher D, Ruts E, Visser M, Heshka S, Baumgartner RN, Wang J et al. « Weight stability masks sarcopenia in elderly men and women » Am J Physiol Endocrinol Metab. 2000 janv 8;279(2):E366-E375.
- (en) Roubenoff R, Hughes VA. « Sarcopenia: current concepts » J. Gerontol. A Biol. Sci. Med. Sci. 2000 déc;55(12):M716-724.
- (en) Baumgartner RN, Koehler KM, Gallagher D, Romero L, Heymsfield SB, Ross RR et al. « Epidemiology of Sarcopenia among the Elderly in New Mexico » Am. J. Epidemiol. 1998 avr 15;147(8):755-63.
- (en) Iannuzzi-Sucich M, Prestwood KM, Kenny AM. « Prevalence of sarcopenia and predictors of skeletal muscle mass in healthy, older men and women » J. Gerontol. A Biol. Sci. Med. Sci. 2002 déc;57(12):M772-777.
- Systematic review of sarcopenia in patients operated on for gastrointestinal and hepatopancreatobiliary malignancies
- Sarcopenia is associated with postoperative infection and delayed recovery from colorectal cancer resection surgery
- Sarcopenia is an independent predictor of complications following pancreatectomy for adenocarcinoma: Sarcopenia in Pancreatectomy
- The impact of sarcopenia on survival and complications in surgical oncology: A review of the current literature: Sarcopenia in Surgical Oncology
- (en) Casper Simonsen, Pieter de Heer, Eik D. Bjerre et Charlotte Suetta, « Sarcopenia and Postoperative Complication Risk in Gastrointestinal Surgical Oncology: A Meta-analysis », Annals of Surgery, vol. 268, no 1, , p. 58–69 (ISSN 0003-4932, DOI 10.1097/SLA.0000000000002679, lire en ligne, consulté le )
- (en) Munro HN. « Adaptation of body protein metabolism in adult and aging man » Clinical Nutrition 1982;1(2):95-108.
- Rolland Y, Vellas B. « La sarcopénie » La Revue de Médecine Interne 2009 févr;30(2):150-60.
- (en) Aniansson A, Grimby G, Hedberg M. « Compensatory muscle fiber hypertrophy in elderly men » J. Appl. Physiol. 1992 sept;73(3):812-6.
- (en) Aniansson A, Hedberg M, Henning GB, Grimby G. « Muscle morphology, enzymatic activity, and muscle strength in elderly men: a follow-up study » Muscle Nerve 1986;9(7):585-91.
- (en) Lexell J, Taylor CC, Sjöström M. « What is the cause of the ageing atrophy? Total number, size and proportion of different fiber types studied in whole vastus lateralis muscle from 15- to 83-year-old men » J. Neurol. Sci. 1988 avr;84(2-3):275-94.
- (en) Wilkinson DJ, Piasecki M, Atherton PJ. « The age-related loss of skeletal muscle mass and function: Measurement and physiology of muscle fibre atrophy and muscle fibre loss in humans. » Ageing. Res. Rev. 2018;Nov;47:123-132. https://doi.org/10.1016/j.arr.2018.07.005
- (en) Strasser H, Tiefenthaler M, Steinlechner M, Eder I, Bartsch G, Konwalinka G. « Age dependent apoptosis and loss of rhabdosphincter cells » J. Urol. 2000 nov;164(5):1781-5.
- (en) Dirks A, Leeuwenburgh C. « Apoptosis in skeletal muscle with aging » Am. J. Physiol. Regul. Integr. Comp. Physiol. 2002;282(2):R519-527.
- (en) Boirie Y, Gachon P, Beaufrère B. « Splanchnic and whole-body leucine kinetics in young and elderly men » Am. J. Clin. Nutr. 1997;65(2):489-95.
- (en) Jourdan M, Cynober L, Moinard C, Blanc MC, Neveux N, De Bandt JP et al. « Splanchnic sequestration of amino acids in aged rats: in vivo and ex vivo experiments using a model of isolated perfused liver » Am. J. Physiol. Regul. Integr. Comp. Physiol. 2008;294(3):R748-755.
- (en) Boirie Y. « Physiopathological mechanism of sarcopenia » J Nutr Health Aging. 2009 oct;13(8):717-23.
- Naiade Silveira Almeida, Raquel Rocha, Claudineia Almeida de Souza et Carla Daltro, « Energy and nutrient intake by people with and without sarcopenia diagnosed by the European Working Group on Sarcopenia in Older People: a systematic review and meta-analysis », Nutrition Reviews, , nuad154 (ISSN 1753-4887, PMID 38114090, DOI 10.1093/nutrit/nuad154, lire en ligne, consulté le )
- (en) Tenover JL. « Testosterone and the aging male » J. Androl. 1997;18(2):103-6.
- (en) Perrini S, Laviola L, Carreira MC, Cignarelli A, Natalicchio A, Giorgino F. « The GH/IGF1 axis and signaling pathways in the muscle and bone: mechanisms underlying age-related skeletal muscle wasting and osteoporosis » J. Endocrinol. 2010;205(3):201-10.
- (en) Guillet C, Boirie Y. « Insulin resistance: a contributing factor to age-related muscle mass loss? » Diabetes Metab. 2005;31 Spec no 2:5S20-25S26.
- (en) Vandervoort AA. « Aging of the human neuromuscular system ». Muscle Nerve 2002;25(1):17-25.
- (en) Hiona A, Leeuwenburgh C. « The role of mitochondrial DNA mutations in aging and sarcopenia: implications for the mitochondrial vicious cycle theory of aging » Exp. Gerontol. 2008 janv;43(1):24-33.
- Une équipe de l’Institut de Myologie identifie un mécanisme capable de préserver la masse musculaire
- Massiré Traoré et al., An embryonic CaVβ1 isoform promotes muscle mass maintenance via GDF5 signaling in adult mouse, 2019 DOI 10.1126/scitranslmed.aaw1131
- (en) Rolland Y, Lauwers-Cances V, Cournot M, Nourhashémi F, Reynish W, Rivière D et al. « Sarcopenia, calf circumference, and physical function of elderly women: a cross-sectional study » J Am Geriatr Soc. 2003 août;51(8):1120-4.
- (en) Rolland Y, Czerwinski S, Abellan Van Kan G, Morley JE, Cesari M, Onder G et al. « Sarcopenia: its assessment, etiology, pathogenesis, consequences and future perspectives » J Nutr Health Aging. 2008 sept;12(7):433-50.
- (en) Janssen I, Baumgartner RN, Ross R, Rosenberg IH, Roubenoff R. « Skeletal muscle cutpoints associated with elevated physical disability risk in older men and women » Am. J. Epidemiol. 2004 févr 15;159(4):413-21.
- (en) Baumgartner RN, Waters DL, Gallagher D, Morley JE, Garry PJ. « Predictors of skeletal muscle mass in elderly men and women » Mechanisms of Ageing and Development 1999 mars 1;107(2):123-36.
- (en) Melton LJ 3rd, Khosla S, Riggs BL. « Epidemiology of sarcopenia » Mayo Clin. Proc. 2000 janv;75 Suppl:S10-12; discussion S12-13.
- (en) Marina Mourtzakis, Carla M.M. Prado, Jessica R. Lieffers et Tony Reiman, « A practical and precise approach to quantification of body composition in cancer patients using computed tomography images acquired during routine care », Applied Physiology, Nutrition, and Metabolism, vol. 33, no 5, , p. 997–1006 (ISSN 1715-5312 et 1715-5320, DOI 10.1139/H08-075, lire en ligne, consulté le )
- (en) Norman K, Stobäus N, Gonzalez MC, Schulzke J-D, Pirlich M. « Hand grip strength: Outcome predictor and marker of nutritional status » Clinical Nutrition 2011 avr;30(2):135-42.
- (en) Lauretani F, Russo CR, Bandinelli S, Bartali B, Cavazzini C, Di Iorio A, et al. « Age-associated changes in skeletal muscles and their effect on mobility: an operational diagnosis of sarcopenia » J. Appl. Physiol. 2003 nov;95(5):1851-60.
- (en) Edwards RH, Young A, Hosking GP, Jones DA. « Human skeletal muscle function: description of tests and normal values » Clin Sci Mol Med. 1977 mars;52(3):283-90.
- (en) Guralnik JM, Seeman TE, Tinetti ME, Nevitt MC, Berkman LF. « Validation and use of performance measures of functioning in a non-disabled older population: MacArthur studies of successful aging » Aging (Milano) 1994 déc;6(6):410-9.
- (en) Guralnik JM, Ferrucci L, Pieper CF, Leveille SG, Markides KS, Ostir GV, et al. « Lower extremity function and subsequent disability: consistency across studies, predictive models, and value of gait speed alone compared with the short physical performance battery » J. Gerontol. A Biol. Sci. Med. Sci. 2000 avr;55(4):M221-231.
- (en) Cesari M, Kritchevsky SB, Newman AB, Simonsick EM, Harris TB, Penninx BW, et al. « Added value of physical performance measures in predicting adverse health-related events: results from the Health, Aging And Body Composition Study » J Am Geriatr Soc. 2009 févr;57(2):251-9.
- http://www.has-sante.fr/portail/upload/docs/application/pdf/argumentaire.pdf
- (en) Bean JF, Kiely DK, LaRose S, Alian J, Frontera WR. « Is Stair Climb Power a Clinically Relevant Measure of Leg Power Impairments in At-Risk Older Adults? » Archives of Physical Medicine and Rehabilitation 2007 mai;88(5):604-9.
- (en) Onambélé-Pearson GL, Breen L, Stewart CE. « Influence of exercise intensity in older persons with unchanged habitual nutritional intake: skeletal muscle and endocrine adaptations » Age (Dordr). 2010 juin;32(2):139-53.
- (en) Latham N, Anderson C, Bennett D, Stretton C. « Progressive resistance strength training for physical disability in older people » Cochrane Database Syst Rev. 2003;(2):CD002759.
- (en) Short KR, Vittone JL, Bigelow ML, Proctor DN, Nair KS. « Age and aerobic exercise training effects on whole body and muscle protein metabolism » Am. J. Physiol. Endocrinol. Metab. 2004;286(1):E92-101.
- (en) Buckinx F, Gouspillou G, Carvalho LP et al. « Effect of High-Intensity Interval Training Combined with L-Citrulline Supplementation on Functional Capacities and Muscle Function in Dynapenic-Obese Older Adults. » J Clin Med. 2018;7:561-575.
- (en) Buckinx F, Marcangeli V, Pinheiro Carvalho L et al. « Initial Dietary Protein Intake Influence Muscle Function Adaptations in Older Men and Women Following High-Intensity Interval Training Combined with Citrulline. » Nutrients. 2019. 11:1685-1704.
- (en) Jinhee Kim, Yunhwan Lee, Seunghee Kye et Yoon-Sok Chung, « Association of vegetables and fruits consumption with sarcopenia in older adults: the Fourth Korea National Health and Nutrition Examination Survey », Age and Ageing, vol. 44, no 1, , p. 96–102 (ISSN 1468-2834 et 0002-0729, DOI 10.1093/ageing/afu028, lire en ligne, consulté le )
- Cynober L, Alix E, Arnaud-Battandier F, Bonnefoy M, Brocker P, Cals M-J, et al. « Apports nutritionnels conseillés chez la personne âgée » Nutrition Clinique et Métabolisme 2000 sept;14, Supplément 1(0):3-60.
- (en) Arnal M-A, Mosoni L, Dardevet D, Ribeyre M-C, Bayle G, Prugnaud J et al. « Pulse protein feeding pattern restores stimulation of muscle protein synthesis during the feeding period in old rats » J. Nutr. 2002 mai;132(5):1002-8.
- (en) Guillet C, Prod’homme M, Balage M, Gachon P, Giraudet C, Morin L. et al. « Impaired Anabolic Response of Muscle Protein Synthesis Is Associated with S6K1 Dysregulation in Elderly Humans » FASEB J [Internet] 2004 août 19 [cité 2012 juin 5].
- Cynober L, Jourdan M, Aussel C, Guillet C, Walrand S, Boirie Y. « Sarcopénie des sujets âgés : libérez les acides aminés ! » Nutrition Clinique et Métabolisme 2004 déc;18(4):198-204.
- (en) Arnal MA, Mosoni L, Boirie Y, Houlier ML, Morin L, Verdier E. et al. « Protein pulse feeding improves protein retention in elderly women » Am. J. Clin. Nutr. 1999 juin;69(6):1202-8.
- (en) Le Plénier S, Walrand S, Noirt R, Cynober L, Moinard C. « Effects of leucine and citrulline versus non-essential amino acids on muscle protein synthesis in fasted rat: a common activation pathway? » Amino Acids 1-8.
- (en) Moinard C, Nicolis I, Neveux N, Darquy S, Bénazeth S, Cynober L. « Dose-ranging effects of citrulline administration on plasma amino acids and hormonal patterns in healthy subjects: the Citrudose pharmacokinetic study » Br. J. Nutr. 2008;99(4):855-62.
- (en) Rougé C, Des Robert C, Robins A, Le Bacquer O, Volteau C, De La Cochetière M-F. et al. « Manipulation of citrulline availability in humans » Am. J. Physiol. Gastrointest. Liver Physiol. 2007;293(5):G1061-1067.
- (en) Moinard C, Maccario J, Walrand S et al. « Arginine behaviour after arginine or citrulline administration in older subjects. » Br J Nutr. 2016;115(3):399-404.
- (en) Bouillanne O, Melchior JC, Faure C et al. « Impact of 3-week citrulline supplementation on postprandial protein metabolism in malnourished older patients: The Ciproage randomized controlled trial. » Clin Nutr. 2019;38(2):564-574.
- (en) Buckinx F, Gouspillou G, Carvalho LP et al. « Effect of High-Intensity Interval Training Combined with L-Citrulline Supplementation on Functional Capacities and Muscle Function in Dynapenic-Obese Older Adults. » J Clin Med. 2018;7:561-575.
- (en) Buckinx F, Marcangeli V, Pinheiro Carvalho L et al. « Initial Dietary Protein Intake Influence Muscle Function Adaptations in Older Men and Women Following High-Intensity Interval Training Combined with Citrulline. » Nutrients. 2019. 11:1685-1704.
- Andrew J. Chappell, Daniel M. Allwood, Rebecca Johns et Samantha Brown, « Citrulline malate supplementation does not improve German Volume Training performance or reduce muscle soreness in moderately trained males and females », Journal of the International Society of Sports Nutrition, vol. 15, (ISSN 1550-2783, PMID 30097067, PMCID 6086018, DOI 10.1186/s12970-018-0245-8, lire en ligne, consulté le )
- (en) Guillet C, Zangarelli A, Mishellany A, Rousset P, Sornet C, Dardevet D, et al. « Mitochondrial and sarcoplasmic proteins, but not myosin heavy chain, are sensitive to leucine supplementation in old rat skeletal muscle » Exp. Gerontol. 2004;39(5):745-51.
- (en) Rieu I, Sornet C, Bayle G, Prugnaud J, Pouyet C, Balage M, et al. « Leucine-supplemented meal feeding for ten days beneficially affects postprandial muscle protein synthesis in old rats » J. Nutr. 2003;133(4):1198-205.
- (en) Rieu I, Balage M, Sornet C, Giraudet C, Pujos E, Grizard J, et al. « Leucine supplementation improves muscle protein synthesis in elderly men independently of hyperaminoacidaemia » J. Physiol. (Lond.) 2006;575(Pt 1):305-15.
- (en) Verhoeven S, Vanschoonbeek K, Verdijk LB, Koopman R, Wodzig WKWH, Dendale P, et al. « Long-term leucine supplementation does not increase muscle mass or strength in healthy elderly men » Am. J. Clin. Nutr. 2009;89(5):1468-75.
- (en) Leenders M, Verdijk LB, van der Hoeven L et al. « Prolonged leucine supplementation does not augment muscle mass or affect glycemic control in elderly type 2 diabetic men. » J. Nutr. 2011;141(6):1070-6.
- (en) Xu ZR, Tan ZJ, Zhang Q et al. « The effectiveness of leucine on muscle protein synthesis, lean body mass and leg lean mass accretion in older people: a systematic review and meta-analysis. » Br J Nutr. 2015. 113:25-34.
- (en) Boirie Y, Dangin M, Gachon P, Vasson MP, Maubois JL, Beaufrère B. « Slow and fast dietary proteins differently modulate postprandial protein accretion » Proc. Natl. Acad. Sci. U S A. 1997;94(26):14930-5.
- (en) Dangin M, Guillet C, Garcia-Rodenas C, Gachon P, Bouteloup-Demange C, Reiffers-Magnani K, et al. « The rate of protein digestion affects protein gain differently during aging in humans » J. Physiol. (Lond.) 2003;549(Pt 2):635-44.
- (en) Devries MC, McGlory C1, Bolster DR et al. « Protein leucine content is a determinant of shorter- and longer-term muscle protein synthetic responses at rest and following resistance exercise in healthy older women: a randomized, controlled trial. » Am J Clin Nutr. 2018.107(2):217-226.
- Claire Vinel et al., « Apeline contre Sarcopénie », Nature Medicine, no 24, , p. 1360-1371, cité par Aline Gersterstner, Pour la science, n° 493, novembre 2018, p. 9
- (en) Bischoff-Ferrari HA, Dawson-Hughes B, Staehelin HB, Orav JE, Stuck AE, Theiler R, et al. « Fall prevention with supplemental and active forms of vitamin D: a meta-analysis of randomised controlled trials » BMJ 2009;339:b3692.
- (en) BAnnweiler C, Henni S2, Walrand S et al. « Vitamin D and walking speed in older adults: Systematic review and meta-analysis. » Maturitas 2017;106:8-25.
- (en) Rosendahl-Riise H, Spielau U, Ranhoff AH. « Vitamin D supplementation and its influence on muscle strength and mobility in community-dwelling older persons: a systematic review and meta-analysis. » J Hum Nutr Diet. 2017;30(1):3-15.
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- « GDF5, une protéine pour rajeunir les muscles », Avec Sciences, France Culture, 24 avril 2024.
- Cours de Marc Francaux consacré à la sarcopénie, au Collège Belgique (2009).
Bases de données et dictionnaires
[modifier | modifier le code]
- Ressources relatives à la santé :