Simarouba amara
| Règne | Plantae |
|---|---|
| Sous-règne | Tracheobionta |
| Division | Magnoliophyta |
| Classe | Magnoliopsida |
| Sous-classe | Rosidae |
| Ordre | Sapindales |
| Famille | Simaroubaceae |
| Genre | Simarouba |
- Quassia simaruba L. f.
- Simarouba amara var. opaca Engl.
- Simarouba amara var. typica Cronquist
- Simarouba glauca DC.
- Simarouba opaca (Engl.) Radlk. ex Engl.
- Zwingera amara (Aubl.) Willd.[2]
| Clade | Angiospermes |
|---|---|
| Clade | Dicotylédones vraies |
| Clade | Rosidées |
| Clade | Malvidées |
| Ordre | Sapindales |
| Famille | Simaroubaceae |
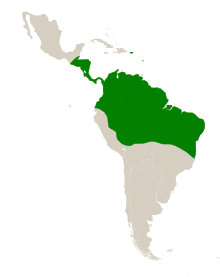
Répartition géographique
Simarouba amara est une espèce de plantes à fleurs de la famille des Simaroubaceae. C'est un arbre présent dans les forêts tropicales et les savanes d' Amérique du Sud et centrale et des Caraïbes. Il a été décrit pour la première fois par Aublet en Guyane française en 1775[4] et est l'une des six espèces de Simarouba. L'arbre est à feuilles persistantes, mais produit une nouvelle série de feuilles une fois par an. Il nécessite beaucoup de lumière pour se développer et se développe rapidement dans ces conditions, mais vit pendant une période relativement courte. Au Panama, il fleurit pendant la saison sèche en février et mars, tandis qu'au Costa Rica, où il n'y a pas de saison sèche, il fleurit plus tard, entre mars et juillet. Comme l'espèce est dioïque, les arbres sont mâles ou femelles et ne produisent que des fleurs mâles ou femelles. On pense que les petites fleurs jaunes sont pollinisées par des insectes, les fruits qui en résultent sont dispersés par des animaux, notamment des singes, des oiseaux et des chauves-souris frugivores, et les graines sont également dispersées par les fourmis coupeuses de feuilles .
Simarouba amara a été largement étudié par les scientifiques dans le but de comprendre l'arbre et également d'acquérir une meilleure compréhension de l'écologie de la forêt tropicale en général. Beaucoup de ces études ont été menées sur l'île de Barro Colorado (BCI) au Panama ou à la station biologique de La Selva au Costa Rica. Il est particulièrement intéressant de savoir comment il entre en compétition avec d'autres espèces et avec des individus de la même espèce à différents stades de son cycle de vie. Les semis sont normalement limités par la quantité de lumière et de nutriments trouvés là où ils poussent et les gaules sont considérées comme relativement exigeantes en lumière. Les jeunes individus ont plus de chances de survivre lorsqu'ils s'éloignent de leurs parents et lorsqu'il y a peu d'autres individus qui poussent près d'eux, ce qui peut être dû à leur capacité à échapper aux maladies. Les physiologistes des plantes ont étudié comment les feuilles de l'arbre diffèrent en fonction de leur emplacement dans la canopée forestière, trouvant qu'elles sont plus épaisses dans la canopée et plus minces dans le sous-bois. Ils ont également mesuré comment le potentiel hydrique de leurs feuilles change et quand leurs stomates s'ouvrent et se ferment pendant la journée; les résultats suggèrent que plutôt que de fermer leurs stomates pour contrôler la perte d'eau, elle est plutôt contrôlée par la surface foliaire. Les généticiens des populations ont examiné la manière dont ses gènes varient, à la fois à l'échelle locale et dans son aire de répartition, à l' aide de microsatellites. Il est génétiquement diversifié, ce qui indique que le flux génétique se produit entre les populations et que les graines peuvent être dispersées jusqu'à 1 km. Les feuilles de S. amara sont mangés par plusieurs espèces de chenilles, en particulier celles du genre Atteva . Plusieurs espèces de termites et de fourmis vivent sur ou autour de l'arbre et des lianes et des épiphytes poussent sur l'arbre.
L'écorce de S. amara a été utilisé pour traiter la dysenterie et la diarrhée, ainsi que d'autres maladies, et a également été exportée vers l'Europe au XVIIIe siècle pour traiter ces maladies. Un certain nombre de composés ont depuis été isolés de l'écorce et se sont avérés avoir des effets antimicrobiens. Les populations locales utilisent le bois de l'arbre à des fins diverses et il est également cultivé dans des plantations et récolté pour son bois, dont une partie est exportée.
Description
[modifier | modifier le code]Simarouba amara atteint des hauteurs allant jusqu'à 35 mètres, avec un diamètre maximal du tronc de 125 cm et un âge maximum estimé à 121 ans[5],[6],[7]. Il a des feuilles composées d'environ 60 cm de long, les pétioles mesurent 4–7 cm de long et chaque feuille a 9–16 folioles. Chaque dépliant est de 2,5 à 11 cm de long et 12–45 mm de large, celles vers l'extrémité de la feuille composée ayant tendance à être plus petites. Les fleurs se produisent sur une panicule staminée d'environ 30 cm de longueur, largement ramifié et densément couvert de fleurs[8]. Les fleurs sont unisexuées, petites (<1 cm de long) et de couleur jaune pâle. On pense qu'ils sont pollinisés par des insectes tels que des petites abeilles et des papillons de nuit . Sur l'île Barro Colorado, au Panama, il a tendance à fleurir pendant la saison sèche de fin janvier à fin avril, persistant pendant 11 à 15 semaines chaque année. Au Costa Rica, il fleurit un peu plus tard, entre mars et juillet, avec un pic en avril[9]. Les fruits se forment entre 1 et 3 mois après la pollinisation. Les fruits sont de couleur vert vif à noir violacé, ont environ 17 mm de long et contiennent de grosses graines (10–14 mm), ils se présentent en groupes de 3 à 5 drupes. Les graines ne peuvent pas rester dormantes et sont dispersées par les vertébrés. Chaque graine pèse environ 0,25 g.
C'est une espèce à feuilles persistantes, avec une nouvelle poussée de feuilles qui pousse entre janvier et avril, pendant la saison sèche, lorsque les niveaux de lumière les plus élevés se produisent dans la forêt tropicale. On pense que cette phénologie permet à S. amara d'optimiser sa photosynthèse, car les nouvelles feuilles sont plus efficaces que celles qu'elles remplacent[7],[9]. Il a des anneaux de croissance visibles, mais indistincts qui ont en moyenne 7 mm de large. Une étude sur des individus au Panama a révélé qu'ils grandissaient en moyenne de 8,4 mm de diamètre chaque année[10], au Costa Rica, des taux de croissance jusque 18 mm par an ont été enregistrés, et la tige pousse constamment tout au long de l'année. Les vaisseaux du xylème dans les arbres matures vont de 20 à 90 μm de diamètre, avec environ 50 vaisseaux présents par mm2 de branche[11]. La densité du bois est comprise entre 0,37 et 0,44 g/cm 3[6], inférieure à celle de nombreuses autres espèces de la forêt tropicale[12].
C'est une espèce à croissance rapide, exigeante en lumière et intolérante à l'ombre . Les jeunes arbres sont généralement un pôle droit, avec plusieurs feuilles composées et un seul point de croissance. Cela permet au jeune arbre d'obtenir la plus grande croissance verticale avec une quantité minimale de biomasse[13]. Ils commencent à se ramifier une fois qu'ils ont 2 à 5 m de haut[14].
Une étude du diagramme de dynamique forestière sur l'île a révélé qu'entre 1982 et 2000, environ 65% des individus sont morts, la mortalité étant la plus élevée parmi les petits individus (<1 cm dhp ). Les grands arbres (> 20 cm dhp) sont relativement rares, avec en moyenne 2,4 arbres par hectare, contre 40 arbres par hectare de> 1 cm dbh[5].
Histoire naturelle
[modifier | modifier le code]
En 1775, le botaniste Aublet propose la diagnose suivante[15] :
« "SIMAROUBA amara.. (TABULA 331 & 331.)
Euonymus fructu nigro, tetragono, vulgo Simarouba. Barr. Fran. Equinox.
Arbor trunco ſexaginta-pedali, ad ſummitatem ramoſo ; RAMIS longis, late & undique ſparſis ; ramulis folioſis. Folia alterna, pinnata, foliolis utrinque binis, quatuor uſque ad novem, ovatis, acutis, glabris, rigidis, integerrimis, ſubſeſſilibus, utrinque alternatim coſtæ cylindraceæ in acumen longum deſinenti adnexis. Flores in amplas paniculas diſpoſiti, axillares & terminales. Ramis, ramuſculis & pedunculis florum, ad baſim ſquamula munitis. E floribus alii ſunt malculi, alii ſeminei, in câdem panicula.
Cortex trunci & radicum inciſus, ladeum & amarum ſuccum eſſundit : lignum leve, album, amareſcit ; horum decoctum uſurpatur ad dyſenterias ſanandas.
Floret Novembri & Decembri ; fructum ſert maturum Martio & Aprili.
Habitat locis arenoſis Caiennæ & Guianæ, & in inſulâ Sandominicanâ, loco dicto Mirebalais, & in via quæ ducit à Jambrabel ad portum pacis.
Nomen Caribæam simarouba. »

« LE SIMAROUBA amer. (PLANCHE 331-332.)
Le tronc de cet arbre a ſoixante pieds de hauteur & plus, ſur deux pieds & demi de diamètre. Son écorce eſt liſſe, griſâtre. Son bois eſt léger, blanchâtre & peu compacte. Il pouſſe à ſon ſommet de groſſes & longues branches éparſes, les unes droites, les autres inclinées, chargées à leur extrémité, de rameaux garnis de feuilles alternes, & ailées à deux rangs de folioles alternes. Le nombre de ces folioles varie ; l'on en compte depuis deux juſqu'à neuf ſur chaque rang. La côte ſur laquelle elles ſont attachées, eſt cylindrique, renflée par le bas : elle eſt terminée par une longue pointe. La côte des plus grandes feuilles eſt longue de quatorze pouces.
Les folioles ſont ovales, liſſes, fermes, vertes en deſſus, & plus pâles en deſſous. A leur extrémité ſupérieure, la nervure qui les partage, forme une petite pointe charnue. Leur pédicule eſt court & cylindrique. On a repréſenté une Foliole de grandeur naturelle.
Les fleurs ſont les unes mâles, & les autres femelles. Elles naiſſent entremêlées ſur des panicules rameuſes & éparſes. Les rameaux ont au deſſous de leur naiſſance une foliole fort courte, & les pédoncules de chaque fleur ont une petite écaille. La fleur eſt très petite.
Les fleurs mâles ont le calice d'une ſeule pièce ; il eſt charnu & à cinq petites dentelures.
La corolle eſt à cinq pétales, roides, fermes, aigus, blanchâtres, attachés entre un diſque membraneux, & le calice, au deſſous de ſes divisions.
Les étamines ſont au nombre de dix, portées ſur le diſque qui entoure l'ovaire. Leurs filets ſont courts, garnis chacun à leur baſe interne d'une petite écaille arrondie & velue. Les anthères ſont oblongues, attachées par leur dos, & ſéparées en deux bourſes par un ſillon.
Le piſtil, qui occupe le centre, eſt un ovaire ſtérile, arrondi, comprimé, à cinq côtes. Il eſt couvert par les écailles qui ſont à la baſe des étamines.
Les fleurs femelles ont le calice ſemblable à celui des mâles.
La corolle eſt de même. Au lieu d'étamines, il y a dix écailles velues qui entourent l'ovaire.
Le piſtil eſt placé ſur un diſque charnu, arrondi ; il eſt compoſé de cinq ovaires ovoïdes, comme unis enſemble. Ils ſont ſurmontés chacun d'un style terminé par un stigmate obtus. Ces cinq ſtyles ſont comme réunis, & ont l’apparence en cet état d’un ſtyle à cinq cannelures, terminé par un stigmate à cinq rayons.
Les ovaires deviennent, en muriſſant, un fruit à cinq capſules ovoïdes, noirâtres, écartées les unes des autres, & portées ſur un corps charnu. Elles ſont marquées de la pointe à la baſe, ſur l’une & l’autre face, d'une petite arrête arrondie & ſaillante. La ſubſtance de l’écorce eſt peu ſucculente. La coque eſt mince & caſſante ; elle renferme une amande couverte d'une fine membrane blanchâtre.
Avant la maturité du fruit, les ovaires ſe ſéparent ; ils portent chacun un style.
On a repréſenté le fruit de grandeur naturelle. Les fleurs détachées ſont très groſſies. La Figure, planche 331, repréſente un jeune plan d'environ ſix mois, élevé a Paris au jardin du Roi, l'année 1767.
Les racines de cet arbre ſont fort groſſes, elles s'étendent au loin près la ſurface de la terre : on les trouvé ſouvent à moitié découvertes. Leur écorce eſt jaunâtre extérieurement, intérieurement blanchâtre, ainſi que leur partie ligneuſe. lorſqu'on entame l'écorce du tronc ou des racines, il en ſuinte un ſuc blanchâtre. On enlève l'écorce des racines ; on la fait fécher, on l'envoie enſuite en Europe pour, être vendue aux Droguiſtes. Dans le pays on s'en ſert en décoction pour guérir les fièvres & arrêter les dévoiements. Cette décoction eſt amère ; elle eſt purgative, & quelquefois vomitive. Cet uſage s'eſt communiqué en Europe, ou il a eu de grands succès dans les hôpitaux & les armées, pour la cure des dyſenteries & des longs dévoiements. Le bois de cet arbre a la même propriété, mais il eſt moins amer & moins actif que l'écorce. On le fait raper, & on le donne à la doſe de deux gros, bouilli dans une pinte d'eau, réduite à trois demi-ſetiers. Cette décoction réuſſit le plus ſouvent pour guérir le flux de ſang & les longues diarrhées, pour arrêter les pertes, & pour rétablir les digeſtions.
Cet arbre eſt nommé SIMAROUBA par les Galibis.
Le Quaſſia dont M. Linnaeus fait mention dans le ſixième Recueil de ſes Diſſertations, pag. 416, paroit avoir du rapport avec le genre du SIMAROUBA. Les uſages qu'on fait, du Quaſſia à Surinam, ſont les mêmes que ceux du Simarouba à Caïenne, parmi les Créoles, les Nègres & les Galibis.
Ces derniers font, avec une pierre tranchante de la nature de la lave, des entailles dans le bois de cet arbre coupé en planches, & ſe fervent de ces planches ainſi entaillées en façon & au lieu de rape, pour raper le manioc.
Cet arbre croît dans les lieux ſablonneux & humides, tant dans l'île de Caïenne que dans la Guiane, ou il n'eſt pas rare.
II étoit en fleur au mois de Novembre & de Décembre ; & en fruit en Mars & Avril. »
Taxonomie
[modifier | modifier le code]Simarouba amara a été décrit pour la première fois par Jean Baptiste Christophore Fusée Aublet en Guyane française en 1775 et est l'espèce type du genre Simarouba. En 1790, William Wright a décrit Quassia simarouba[16], qui, selon Auguste Pyrame de Candolle, était la même espèce que S. amara. Cependant, parce que S. amara a été décrit comme monoïque par Aublet et Q. simarouba a été décrit comme dioïque par Wright, ils étaient toujours considérés comme des espèces distinctes en 1829[17]. En 1874, lorsque la Flora Brasiliensis a été publiée, elles étaient considérées comme synonymes[18].
Parmi les six espèces de Simarouba, deux autres que S. amara se trouvent sur le continent: S. glauca et S. versicolor. S. amara se distingue des autres espèces continentales par ses fleurs, anthères et fruits plus petits et ses pétales droits plutôt que courbes[3]. Les feuilles de Simarouba amara subsp. les opaca ne sont pas glauques (une couleur gris bleuâtre ou verte) sur leur face inférieure, alors que ceux de Simarouba amara subsp. typica sont.
| Structure | S. Amara | S. glauca | S. versicolor |
|---|---|---|---|
| Fleur | 3–5 mm de long | 4–7,5 mm de long | 4–7,5 mm de long |
| Anthères | 0,4 à 1,2 mm de long | 1,3 à 2,0 mm de long | 1,0 à 1,5 mm de long |
| Pétales | Droit, jaune-vert terne à blanc | Jaune incurvé et plus clair avec une touche d'orange ou de rouge | Incurvé |
| Des fruits | 1,0–1,5 x 0,6–1,0 cm | 2,0–2,5 x 1,2–1,5 cm | 2,0–2,5 x 1,5–2,0 cm |
Noms communs
[modifier | modifier le code]Simarouba amara est connu sous de nombreux noms vernaculaires : En Bolivie, il est connu sous le nom de chiriuana, au Brésil sous le nom de marupa, marupuaba, parahyba, paraiba et tamanqueira. En Colombie, on l'appelle simaruba, en Équateur cedro amargo, cuna et guitarro, au Guyana simarupa, au Pérou marupa, au Suriname soemaroeba et au Venezuela cedro blanco et simarouba[19]. En Guyane, on l'appelle simarouba, acajou blanc (créole), ɨwë'ɨ (Wayãpi), tima aβain (Palikur), marupa, paraíba (Portugais), asumaipa (Paramaka, Ndjuka) ou simarupa (Kali'na)[20],[21].
Répartition
[modifier | modifier le code]L'aire naturelle de S. amara est dans les néotropiques, l'écorégion de l' Amérique centrale et du sud. Son aire de répartition s'étend du Guatemala au nord, à la Bolivie au sud et de l' Équateur à l'ouest, à la côte est du Brésil[3]. Il a été introduit dans les îles de la Dominique et de Porto Rico dans la mer des Caraïbes, devenant naturalisé à Porto Rico[22],[23]. Sur BCI, les arbres matures (> 10 cm dhp) se retrouvent à une fréquence de 5 par hectare, en Équateur à 0,7 par hectare et en Guyane à 0,4 par hectare. L'analyse génétique des populations suggère qu'il a toujours été relativement commun dans son aire de répartition[24]. Il pousse dans les forêts tropicales et dans les savanes[25]. Les plants de S. les amara sont rares dans la forêt primaire en raison de leur exigence en lumière[13].
Génétique
[modifier | modifier le code]Les populations de S. amara affichent des niveaux élevés d'hétérozygotie, ce qui indique qu'il est génétiquement diversifié. Cela est cohérent avec le croisement des arbres par un flux de pollen sur de longues distances, créant suffisamment de flux de gènes entre les populations pour contrer les effets de la dérive génétique. Une étude de 478 plantes de 14 populations à travers l'Amérique du Sud a révélé que 24% de tous les allèles se trouvaient dans une seule population[24]. Une étude de 300 plantes sur l'île de Barro Colorado a révélé que l'hétérozygosité à 5 locus microsatellites variait entre 0,12 et 0,75. 8 des 50 allèles marqués ont été trouvés dans une seule plante[5].
Reproduction
[modifier | modifier le code]Les individus ne se reproduisent généralement pas avant d'avoir un diamètre de tronc de 30 cm. Une fois arrivés à maturité, les arbres produisent des fleurs chaque année, mais toutes les femelles ne produisent pas de fruits chaque année[5]. Leur morphologie florale est typique de la pollinisation de petits insectes généralistes tels que les abeilles et les papillons de nuit. Il a été rapporté qu'il était pollinisé par des papillons de nuit non sphingidés[26], mais d'autres auteurs se sont demandé si cela était correct[27].
Dispersion des graines
[modifier | modifier le code]
Les graines de S. amara sont dispersés par des vertébrés, principalement des grands oiseaux et des mammifères, y compris les chachalacas, les moucherons, les motmots, les grives, les singes hurleurs, les tamarins[28] et les singes araignées. On a également observé que les fourmis coupeuses de feuilles dispersent les graines et que des tapis de semis denses se forment dans les zones où elles déversent des déchets[5] mais la plupart des semis meurent et la dispersion par les fourmis est considérée comme sans importance pour la dispersion[29]. Les graines qui sont mangées par les singes sont plus susceptibles de germer que les autres[30]. On a également noté que les chauves-souris phyllostomidés mangeuses de fruits dispersent leurs graines; cela peut aider à la régénération des forêts car elles dispersent les graines des espèces successives ultérieures alors qu'elles se nourrissent de S. amara[31].
Sur la base de la modélisation inverse des données des pièges à graines sur BCI, la distance de dispersion moyenne estimée pour les graines est de 39 m[5]. L'étude des semis et des arbres parents sur BCI à l'aide de microsatellites d'ADN a révélé qu'en moyenne, les semis poussent àn392 m de leurs parents, avec un écart type de ± 234 m et une plage comprise entre 9 m et 1 km. Dans la forêt, il y a beaucoup de graines et de semis sous les femelles reproductrices; les données génétiques indiquent qu'il est peu probable que les semis proviennent d'adultes proches, mais qu'ils y soient plutôt dispersés par des vertébrés qui se sont nourris d'un arbre puis se sont déplacés pour se nourrir d'un autre, déféquant dans la canopée et déposant les graines[28].
Physiologie
[modifier | modifier le code]Divers aspects de la physiologie ou S. amara ont été étudiés. La conductance stomatique des feuilles, une indication de la vitesse à laquelle l'eau s'évapore, des arbres matures à midi varie de 200 à 270 mmol H 2 O m −2 s −1 . Le potentiel hydrique des feuilles à midi varie de −0,56 à −1,85 M Pa, avec une moyenne d'environ −1,2 MPa. La cavitation est répandue dans le tronc et les stomates ne se ferment pas avant que la cavitation ne se produise. Bien que cela soit normalement considéré comme nocif pour l'arbre, cela peut amortir le potentiel hydrique des feuilles et donc être bénéfique. La conductance stomatique et la conductance hydraulique des branches d'arbres plus grands (~ 30 m) sont beaucoup plus hauts que dans les branches d'arbres plus petits (~ 20 m). Phillips, Bond et Ryan ont suggéré que cela était probablement dû aux branches d'arbres plus grands ayant un rapport feuille / aubier inférieur à celui des petites branches. La coloration des colorants montre que la cavitation est courante dans les branches de S. amara . Ils ont conclu que le flux d'eau dans S. amara est contrôlé par des moyens structurels (surface foliaire) plutôt que physiologiques (fermant les stomates)[11].
Les feuilles absorbent la lumière dans le spectre du rayonnement photosynthétiquement actif (PAR) à des longueurs d'onde comprises entre 400 nm et 700 nm avec un rendement élevé, mais le rendement diminue à des longueurs d'onde plus longues. En général, les usines absorbent le PAR à des rendements d'environ 85%; les valeurs plus élevées trouvées dans S. on pense que l' amara est due à la forte humidité de son habitat. La réflectance et la transmittance des feuilles sont faibles entre 400 et 700 nm. Les propriétés optiques et la masse des feuilles varient en fonction de leur emplacement dans le couvert forestier, les feuilles devenant plus épaisses et plus efficaces à mesure que leur hauteur dans la canopée augmente. Cependant, pour leur poids, les feuilles du sous-étage sont plus efficaces pour capter la lumière que les feuilles de la canopée[32].
| Absorbance (400-700 nm) | Absorbance (700-750 nm) | Réflectance (400-700 nm) | Transmission (400-700 nm) | Masse foliaire (g / m 2 ) | |
|---|---|---|---|---|---|
| Strate basse (~ 2m) | 91,7% | 37,3% | 6,3% | 2,1% | 36,9 |
| Strate moyenne (~ 10m) | 92,8% | 41,6% | 6,1% | 1,2% | 55,4 |
| Canopée haute (> 20m) | 93,1% | 46,1% | 5,2% | 0,5% | 135,2 |
La concentration de phosphate biodisponible s'est avérée plus élevée sous les individus femelles que sous les mâles, même si la concentration totale de phosphate est égale. Rhoades et coll. a conclu que cette différence était due au fait que les femelles modifiaient la disponibilité du phosphate, plutôt que les femelles ne grandissant que dans des zones à forte disponibilité de phosphate. On pense que cela est causé soit par les fruits contenant des niveaux élevés de phosphate qui tomberaient de l'arbre et pourriraient, soit par les fruits attirant les animaux qui déposent du phosphate sous les femelles. Il est également possible que les sexes produisent des exsudats racinaires différents, qui affectent la communauté microbienne de leur rhizosphère, affectant ainsi la disponibilité du phosphate[33].
Physiologie des semis
[modifier | modifier le code]| Nutritif | Concentration (mg/g feuille)
(poids sec) |
|---|---|
| Azote | 20 |
| Phosphore | 1 |
| Potassium | 16 |
| Calcium | 2 |
| Magnésium | 5 |
Des expériences réalisées sur BCI où des tranchées ont été creusées autour de semis de S. amara, ou lorsque des trous dans la canopée ont été créés au-dessus d'eux, montrent que leur taux de croissance relatif peut être augmenté par les deux. Cela montre que leur croissance est normalement limitée à la fois par la compétition aérienne pour la lumière et par la compétition souterraine pour les nutriments et l'eau. La compétition pour la lumière est normalement plus importante, comme le montre le taux de croissance augmentant de près de 7 fois et la mortalité diminuant, lorsque les semis étaient placés dans des trous, par rapport au sous-étage. Lorsque les semis dans les interstices avaient une tranchée creusée autour d'eux pour empêcher la compétition souterraine, leur croissance augmentait encore, de 50%, ce qui démontre que dans les interstices, les plants sont limités par la compétition souterraine. Les tranchées autour des semis dans le sous-étage n'ont pas augmenté de manière significative leur croissance, montrant qu'ils ne sont normalement limités que par la concurrence pour la lumière[34].
Les plus gros plants ont plus de chances de survivre à la saison sèche sur BCI que les petits plants[35]. Une inhibition dépendante de la densité se produit entre les semis: ils sont plus susceptibles de survivre dans les zones où moins de semis de S. Amara grandit. Une étude sur des individus sur BCI a révélé que ce modèle peut être causé par des différences dans le biote du sol plutôt que par des insectes herbivores ou des champignons pathogènes. Les observations basées sur la distance entre les semis et leurs parents indiquent que l' hypothèse de Janzen-Connell s'applique aux semis de S. amara : ils sont plus susceptibles de survivre loin de leurs parents car ils échappent à des ravageurs tels que les herbivores et les agents pathogènes des plantes qui sont plus courants sous les arbres parents[28].
Physiologie des jeunes arbres
[modifier | modifier le code]Les jeunes arbres de S. Les amara sont exigeants en termes de lumière et se trouvent dans les zones plus lumineuses de la forêt tropicale par rapport aux plants de Pitheullobium elegans et de Lecythis ampla . Une étude à la station biologique de La Selva a révélé que les feuilles pèsent environ 30 g / m 2 (poids sec), similaire à P. elegans, mais environ le double du poids de L. ampla . La capacité photosynthétique des feuilles de S. amara est supérieur à celui des deux autres espèces, avec une moyenne d'environ 6 μmol m −1 s −1 . La respiration sombre est en moyenne de 0,72 μmol m -1 s -1, supérieure à celle des deux autres espèces. Le taux de photosynthèse maximal est en corrélation avec le diamètre de la tige et la croissance verticale. On pense que la lumière diffuse est plus importante pour la croissance des semis que les taches de soleil[13]. Une autre étude sur les jeunes arbres à La Selva a révélé qu'ils poussaient 7 cm an-1 en hauteur et 0,25 mm an-1 de diamètre. En moyenne, ils avaient neuf feuilles composées, un indice de surface foliaire de 0,54 et la surface totale de leurs feuilles était de 124 cm2. Les jeunes arbres qui avaient la plus faible surface foliaire étaient les plus susceptibles de mourir pendant l'étude et ceux qui avaient une plus grande surface foliaire poussaient plus vite que les autres jeunes arbres[14].
Une étude de jeunes arbres de un à quatre centimètres de diamètre sur BCI a révélé que la croissance des jeunes arbres ne variait pas selon les espèces qui poussaient à proximité, contrairement aux prévisions selon lesquelles une inhibition de la dépendance à la densité se produirait. Un modèle basé sur ces résultats a prédit que les jeunes arbres d'un diamètre de 2 cm sont capables de croître à un taux maximum de 13 mm an−1 et que si un autre arbre d'un diamètre de 10 cm grandit dans les 5 m du jeune arbre, sa croissance n'est réduite qu'à 12 mm an-1, indiquant qu'ils ne sont pas affectés par l'encombrement. Les arbres à plus de 15 m d'un jeune arbre n'affectent pas leur croissance[36].
Écologie
[modifier | modifier le code]
Les lianes sont relativement rares sur les S. amara à maturité (> 20 cm dhp), par rapport à d'autres arbres sur BCI, avec seulement environ 25% ayant des lianes qui poussent dessus. Putz a suggéré que cela pourrait être dû aux grandes feuilles, mais le mécanisme par lequel cela réduirait le nombre de lianes est inconnu[10]. Les petits individus ont aussi moins de lianes et d'hémi-épiphytes que d'autres espèces d'arbres dans les mêmes forêts[37].
On a signalé que le ver Atteva aurea et d'autres membres du genre Atteva mangeaient les nouvelles pointes de pousses de S. amara au Costa Rica[38]. Les larves de l'espèce de papillon, Bungalotis diophorus, se nourrissent exclusivement de jeunes arbres S. amara[39]. Deux espèces de termites ont été observées vivant sur S. amara au Panama, Calcaritermes brevicollis sur bois mort et Microcerotermes arboreus nichant dans une galerie sur une branche[40]. Des fourmis Paraponera clavata nichent à la base de S. amara[41]. L'Hemiptera, Enchophora sanguinea (Fulgoridae) a été trouvé préférentiellement sur les troncs de S. amara[42],[43].
Usages
[modifier | modifier le code]Matériaux
[modifier | modifier le code]Sensible aux insectes et aux champignons, le bois de Simarouba amara est utilisé pour le déroulage, les lambris, la sculpture, le bordage et la décoration[21], mais aussi localement pour la production de papier, de meubles, de contreplaqué et d'allumettes et est également utilisé dans la construction[5]. Il est également cultivé dans les plantations, car son bois clair et léger est très recherché sur les marchés européens pour la fabrication de meubles et de placages de qualité[6],[44]. Le bois sèche rapidement et est facile à travailler avec des outils normaux. Il est de couleur blanc crème à jaune clair, avec une texture grossière et un fil droit. Il doit être traité pour empêcher les champignons, les foreurs du bois et les termites de le manger. Le bois de cœur a une densité de 0,35–0,45 g/cm3[19]. Il a été noté comme l'une des meilleures essences de bois pouvant être cultivées en Amazonie péruvienne, avec Cedrelinga catenaeformis, en raison de ses caractéristiques de croissance rapide[45]. Le Fonds mondial pour la nature recommande aux consommateurs de s'assurer que le bois est certifié par le Forest Stewardship Council afin de ne pas contribuer à la déforestation[46].
Les copeaux de bois de Simarouba amara utilisés comme litière d'animaux, ont provoqué l'empoisonnement de chevaux et de chiens[47].
Médical
[modifier | modifier le code]Les feuilles et l'écorce de S. amara ont été utilisées comme plante médicinale pour traiter la dysenterie, la diarrhée, le paludisme et d'autres maladies dans les régions où il se développe[réf. nécessaire]. En 1713, il a été exporté en France où il a été utilisé pour traiter la dysenterie pendant les épidémies entre 1718 et 1725. En 1918, son efficacité a été validée par une étude où des soldats dans un hôpital militaire ont reçu un thé à base d'écorce pour traiter la dysenterie amibienne. Dans une étude de 1944, l'Institut Merck a trouvé qu'il était efficace à 92% dans le traitement de l'amibiase intestinale chez les humains. Au cours des années 1990, les scientifiques ont démontré qu'il pouvait tuer la cause la plus courante de dysenterie, Entamoeba histolytica et les espèces de bactéries Salmonella et Shigella qui causent la diarrhée[48]. Une plus grande quantité de preuves[49] est nécessaire pour prouver l'efficacité de Simarouba.
Les principaux composés biologiquement actifs trouvés dans S. amara sont les quassinoïdes, un groupe de triterpènes comprenant l'ailanthinone, la glaucarubinone et l'holacanthone. Il a été rapporté que ceux-ci tuent les protozoaires, les amibes et le Plasmodium (la cause du paludisme). Les propriétés antipaludiques ont été étudiées pour la première fois par des scientifiques en 1947; ils ont trouvé que chez les poulets, 1 mg d'extrait d'écorce pour 1 kg de poids corporel avaient une forte activité antipaludique. En 1997, un brevet a été déposé aux États-Unis pour l'utilisation d'un extrait dans un produit de soin de la peau[48]. Simarouba amara ne doit pas être confondu avec Simarouba glauca, connu sous le nom de Lakshmi Taru en Inde.
En Guyane, les Créoles et les Palikur confectionnent un tonique amer réputé soigner la dysenterie et paludisme en macérant son écorce dans le rhum[20]. Il aurait aussi des propriétés fébrifuges, vermifuges, répulsives contre moustiques et poux d'agouti. Les Waikas de haute Amazonie en tirent une peinture corporelle noire[21].
-
Quassia simarouba (syn. S. amara) dessiné par Adolphus Ypey, 1813. Noter les fleurs mal colorées qui devraient être jaunes.
-
feuille de Simarouba amara (face supérieur luisante)
-
feuille de Simarouba amara (face inférieur claire)
-
folioles de Simarouba amara (face inférieur claire)
-
inflorescence de Simarouba amara
-
fleurs de Simarouba amara
-
fruits immatures de Simarouba amara
-
tronc immatures de Simarouba amara
-
écorce de Simarouba amara
-
houppier de Simarouba amara
-
houppier de Simarouba amara
-
rameau feuillé et fertile de Simarouba amara
-
Phrictus quinqueparitus (Fulgoridae) sur Simarouba amara) à la station biologique de La Selva (province de Heredia, Costa Rica).
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Simarouba amara » (voir la liste des auteurs).
- ↑ The Plant List (2013). Version 1.1. Published on the Internet; http://www.theplantlist.org/, consulté le 01 février 2021.
- ↑ (en-US) « Simarouba amara Aubl. - synonyms », Tropicos, Saint Louis, Missouri, Missouri Botanical Garden (consulté le )
- Franceschinelli, Yamamoto et Shepherd, « Distinctions among Three Simarouba Species », Systematic Botany, vol. 23, no 4, , p. 479–488 (DOI 10.2307/2419379, JSTOR 2419379)
- Jean Baptiste Christian Fusée-Aublet, HISTOIRE DES PLANTES DE LA GUIANE FRANÇOISE, rangées suivant la méthode sexuelle, avec plusieurs mémoires sur les différents objets intéreſſants, relatifs à la culture & au commerce de la Guiane françoiſe, & une Notice des plantes de l'Iſle de France. volume II, Londres et Paris, P.-F. Didot jeune, Librairie de la Faculté de Médecine, quai des Augustins, , p.537
- Hardesty, Dick, Kremer et Hubbell, « Spatial genetic structure of Simarouba amara Aubl. (Simaroubaceae), a dioecious, animal-dispersed Neotropical tree, on Barro Colorado Island, Panama », Heredity, vol. 95, no 4, , p. 290–297 (PMID 16094303, DOI 10.1038/sj.hdy.6800714, lire en ligne [archive du ], consulté le )
- Schulze, Grogan, Landis et Vidal, « How rare is too rare to harvest?Management challenges posed by timber species occurring at low densities in the Brazilian Amazon », Forest Ecology and Management, vol. 256, no 7, , p. 1443 (DOI 10.1016/j.foreco.2008.02.051)
- Fichtler, Clark et Worbes, « Age and Long-term Growth of Trees in an Old-growth Tropical Rain Forest, Based on Analyses of Tree Rings and 14C », Biotropica, vol. 35, no 3, , p. 306–317 (DOI 10.1111/j.1744-7429.2003.tb00585.x, JSTOR 30043047)
- ↑ Woodson, Schery et Porter, « Flora of Panama. Part VI. Family 90. Simaroubaceae », Annals of the Missouri Botanical Garden, vol. 60, no 1, , p. 23–39 (DOI 10.2307/2394767, JSTOR 2394767)
- O'Brien, Oberbauer, Clark et Clark, « Phenology and Stem Diameter Increment Seasonality in a Costa Rican Wet Tropical Forest », Biotropica, vol. 40, no 2, , p. 151 (DOI 10.1111/j.1744-7429.2007.00354.x)
- Putz, « How Trees Avoid and Shed Lianas », Biotropica, vol. 16, no 1, , p. 19–23 (DOI 10.2307/2387889, JSTOR 2387889)
- Phillips, Bond et Ryan, « Gas exchange and hydraulic properties in the crowns of two tree species in a Panamanian moist forest », Trees, vol. 15, no 2, , p. 123–130 (DOI 10.1007/s004680000077, lire en ligne [archive du ], consulté le )
- ↑ Santiago, Goldstein, Meinzer et Fisher, « Leaf photosynthetic traits scale with hydraulic conductivity and wood density in Panamanian forest canopy trees », Oecologia, vol. 140, no 4, , p. 543–550 (PMID 15232729, DOI 10.1007/s00442-004-1624-1, Bibcode 2004Oecol.140..543S)
- Oberbauer, Clark, Clark et Rich, « Light environment, gas exchange, and annual growth of saplings of three species of rain forest trees in Costa Rica », Journal of Tropical Ecology, vol. 9, no 4, , p. 511–523 (DOI 10.1017/S0266467400007586)
- Sterck, Clark, Clark et Bongers, « Light Fluctuations, Crown Traits, and Response Delays for Tree Saplings in a Costa Rican Lowland Rain Forest », Journal of Tropical Ecology, vol. 15, no 1, , p. 83–95 (DOI 10.1017/S0266467499000681, JSTOR 2560198, lire en ligne)
- ↑ Jean Baptiste Christian Fusée-Aublet, HISTOIRE DES PLANTES DE LA GUIANE FRANÇOISE, rangées suivant la méthode sexuelle, avec plusieurs mémoires sur les différents objets intéreſſants, relatifs à la culture & au commerce de la Guiane françoiſe, & une Notice des plantes de l'Iſle de France. volume II, Londres et Paris, P.-F. Didot jeune, Librairie de la Faculté de Médecine, quai des Augustins, , pp. 538
- ↑ « Quassia simarouba », Zipcodezoo.com (consulté le )
- ↑ Andrew Duncan, Supplement to The Edinburgh new dispensatory, Printed for Bell & Bradfute, , 85–86 (lire en ligne)
- ↑ Nolan et Jones, « Flora brasiliensis », Science, vol. 35, no 909, , p. 864–5 (PMID 17820223, DOI 10.1126/science.35.909.864, Bibcode 1912Sci....35..864N, lire en ligne, consulté le )
- « Tropix 6.0 – Marupa », TROPIX, CIRAD, (consulté le )
- Pierre Grenand, Christian Moretti, Henri Jacquemin et Marie-Françoise Prévost, Pharmacopées traditionnelles en Guyane : Créoles. Wayãpi, Palikur, Paris, IRD Editions, , 663 p. (ISBN 978-2-7099-1545-8, lire en ligne), p. 629-630
- ONF, Guide de reconnaissance des arbres de Guyane : 2e édition, ONF, 16/122004, 374 p. (ISBN 978-2842072957), p. 318-319
- ↑ Moses Kairo, Bibi Ali, Oliver Cheesman, Karen Haysom and Sean Murphy, « Invasive Species Threats in the Caribbean Region », CABI, (consulté le ), p. 122
- ↑ « Invasive and introduced tree species on Dominica », Food and Agriculture Organisation of the United Nations, (consulté le )
- Hardesty, Dick, Hamrick et Degen, « Geographic Influence on Genetic Structure in the Widespread Neotropical Tree Simarouba amara (Simaroubaceae) », Tropical Plant Biology, vol. 3, , p. 28–39 (DOI 10.1007/s12042-010-9044-3)
- ↑ Sanaiotti et Magnusson, « Effects of Annual Fires on the Production of Fleshy Fruits Eaten by Birds in a Brazilian Amazonian Savanna », Journal of Tropical Ecology, vol. 11, no 1, , p. 53–65 (DOI 10.1017/S0266467400008397, JSTOR 2560140)
- ↑ Renner et Feil, « Pollinators of Tropical Dioecious Angiosperms », American Journal of Botany, vol. 80, no 9, , p. 1100–1107 (DOI 10.2307/2445757, JSTOR 2445757, lire en ligne)
- ↑ Bawa, « Pollinators of Tropical Dioecious Angiosperms: A Reassessment? No, not yet », American Journal of Botany, vol. 81, no 4, , p. 456–460 (DOI 10.2307/2445495, JSTOR 2445495)
- Hardesty, B. D., Hubbell, S. P. et Bermingham, E., « Genetic evidence of frequent long-distance recruitment in a vertebrate-dispersed tree », Ecology Letters, vol. 9, no 5, , p. 516–525 (PMID 16643297, DOI 10.1111/j.1461-0248.2006.00897.x)
- ↑ Hardesty, « Effectiveness of seed dispersal by ants in a Neotropical tree », Integrative Zoology, vol. 6, no 3, , p. 222–6 (PMID 21910841, DOI 10.1111/j.1749-4877.2011.00246.x)
- ↑ Stevenson, Castellanos, Pizarro et Garavito, « Effects of Seed Dispersal by Three Ateline Monkey Species on Seed Germination at Tinigua National Park, Colombia », International Journal of Primatology, vol. 23, no 6, , p. 1187 (DOI 10.1023/A:1021118618936)
- ↑ Kelm, Wiesner et Von Helversen, « Effects of artificial roosts for frugivorous bats on seed dispersal in a neotropical forest pasture mosaic », Conservation Biology, vol. 22, no 3, , p. 733–741 (PMID 18445078, DOI 10.1111/j.1523-1739.2008.00925.x)
- Poorter, Oberbauer et Clark, « Leaf Optical Properties Along a Vertical Gradient in a Tropical Rain Forest Canopy in Costa Rica », American Journal of Botany, vol. 82, no 10, , p. 1257–1263 (DOI 10.2307/2446248, JSTOR 2446248)
- ↑ Rhoades, Sanford et Clark, « Gender Dependent Influences on Soil Phosphorus by the Dioecious Lowland Tropical Tree Simarouba amara », Biotropica, vol. 26, no 4, , p. 362–368 (DOI 10.2307/2389229, JSTOR 2389229, lire en ligne)
- Barberis et Tanner, « Gaps and Root Trenching Increase Tree Seedling Growth in Panamanian Semi-Evergreen Forest », Ecology, vol. 86, no 3, , p. 667–674 (DOI 10.1890/04-0677, JSTOR 3450661, lire en ligne)
- ↑ Mangan, Schnitzer, Herre et Mack, « Negative plant-soil feedback predicts tree-species relative abundance in a tropical forest », Nature, vol. 466, no 7307, , p. 752–755 (PMID 20581819, DOI 10.1038/nature09273, Bibcode 2010Natur.466..752M, lire en ligne)
- ↑ Uriarte, Condit, Canham et Hubbell, « A Spatially Explicit Model of Sapling Growth in a Tropical Forest: Does the Identity of Neighbours Matter? », Journal of Ecology, vol. 92, no 2, , p. 348–360 (DOI 10.1111/j.0022-0477.2004.00867.x, JSTOR 3599599)
- ↑ Clark et Clark, « Distribution and Effects on Tree Growth of Lianas and Woody Hemiepiphytes in a Costa Rican Tropical Wet Forest », Journal of Tropical Ecology, vol. 6, no 3, , p. 321–331 (DOI 10.1017/S0266467400004570, JSTOR 2559832)
- ↑ Wilson, Landry, Janzen et Hallwachs, « Identity of the ailanthus webworm moth (Lepidoptera, Yponomeutidae), a complex of two species: evidence from DNA barcoding, morphology and ecology », ZooKeys, no 46, , p. 41–60 (DOI 10.3897/zookeys.46.406)
- ↑ Miller Jeff, Daniel H. Janzen et Winifred Hallwachs, One hundred butterflies and moths, Harvard University Press, (ISBN 978-0-674-02334-5, lire en ligne)
- ↑ Roisin, Dejean, Corbara et Orivel, « Vertical stratification of the termite assemblage in a neotropical rainforest », Oecologia, vol. 149, no 2, , p. 301–311 (PMID 16791633, DOI 10.1007/s00442-006-0449-5, Bibcode 2006Oecol.149..301R, lire en ligne)
- ↑ Belk, Black, Jorgensen et Hubbell, « Nest Tree Selectivity by the Tropical Ant, Paraponera clavata », Biotropica, vol. 21, no 2, , p. 173–177 (DOI 10.2307/2388707, JSTOR 2388707)
- ↑ Johnson et Foster, « Associations of Large Homoptera and Trees in a Tropical Forest », Journal of the Kansas Entomological Society, vol. 58, no 3, , p. 565 (JSTOR 25084689)
- ↑ Naskrecki et Nishida, « Novel trophobiotic interactions in lantern bugs (Insecta: Auchenorrhyncha: Fulgoridae) », Journal of Natural History, vol. 41, nos 37–40, , p. 2397 (DOI 10.1080/00222930701633570, lire en ligne)
- ↑ Granier, Huc et Colin, « Transpiration and stomatal conductance of two rain forest species growing in plantations (Simarouba amara and Goupia glabra) in French Guyana », Annales des Sciences Forestières, vol. 49, no 1, , p. 17 (DOI 10.1051/forest:19920102)
- ↑ Michael McClain, Reynaldo L. Victoria et Jeffrey Edward Richey, The biogeochemistry of the Amazon Basin, Oxford University Press, (ISBN 978-0-19-511431-7, lire en ligne), p. 111
- ↑ « Photographic guide to identify your timber », Worldwide Fund for Nature (WWF) (consulté le )
- ↑ (en) Declercq, « Suspected wood poisoning caused by Simarouba amara (marupá/caixeta) shavings in two dogs with erosive stomatitis and dermatitis », Veterinary Dermatology, vol. 15, no 3, , p. 188–193 (PMID 15214956, DOI 10.1111/j.1365-3164.2004.00377.x)
- The Virtual Field Herbarium, « Simaroubaceae Simarouba amara Aublet » [archive du ], Oxford University Herbarium (consulté le )
- ↑ plus grande quantité de preuves
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- « Simarouba amara (simarouba) », sur La Chaussette rouge rencontres amazoniennes : flore /(faune) de Guyane - blog de photos botaniques de Guyane, (consulté le )
- (en) The Plant List : Simarouba amara Aubl. (source : KewGarden WCSP)
- (en) Tropicos : Simarouba amara Aubl. (+ liste sous-taxons)
- (en) IPNI : Simarouba amara
- (fr + en) GBIF : Simarouba amara Aubl.
- (fr + en) EOL : Simarouba amara Aubl.
- (en) Catalogue of Life : Simarouba amara Aubl. (consulté le )
- (en) UICN : espèce Simarouba amara Aubl. (consulté le )
- (en) NCBI : Simarouba amara (taxons inclus)
- (fr) INPN : Simarouba amara Aubl. (TAXREF)