Aspergillus terreus
| Aspergillus terreus | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||
| Clasificación científica | |||||||||||||||||
| |||||||||||||||||
Aspergillus terreus, tamén coñecido como Aspergillus terrestris, é un fungo tipo mofo que se atopa nos solos de todo o mundo. Aínda que ata hai pouco se pensaba que era estritamente asexual, agora sábese que pode realizar a reprodución sexual.[2] É un fungo saprotrófico frecuente en climas cálidos como as rexións tropicais e subtropicais.[3] Ademais de no solo, tamén se pode atopar en hábitats como vexetación en descomposición e po.[4] A. terreus utilízase comunmente na industria para producir importantes ácidos orgánicos, como o ácido itacónico e o ácido cis-aconítico, así como encimas, como a xilanase.[3] Tamén era a fonte inicial do fármaco mevinolina (lovastatina), utilizado para rebaixar o nivel de colesterol sérico.
Aspergillus terreus pode causar infeccións oportunistas en persoas con sistemas inmunitarios deficientes. É relativamente resistente á anfotericina B, un fármaco antifúnxico moi utilizado.[5] Aspergillus terreus tamén produce ácido asptérrico e 6-hidroximeleína, inhibidores do desenvolvemento do pole na planta Arabidopsis thaliana.[6]
En 2023 científicos australianos descubriron a capacidade de A. terreus de descompoñer completamente o plástico polipropileno en 140 días.[7]
Descrición
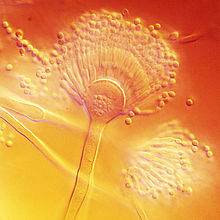
[editar | editar a fonte]A. terreus é de cor marrón e faise máis escuro a medida que pasa o tempo no medio de cultivo.[3][8] En ágar Czapek ou ágar de extracto de malta a 25 °C, as colonias teñen as condicións para poder crecer rapidamente e crear paredes de aspecto liso. Nalgúns casos, poden facerse flocosas, formando penachos suaves parecidos a pelos.[9] As colonias en ágar de extracto de malta crecen máis rápido e esporulan máis densamente que en moitos outros medios.[8]
A. terreus ten cabezas conidiais que son compactas, biseriadas e densamente columnares, chegando aos 500 × 30–50 μm de diámetro. Os seus conidióforos son lisos e hialinos de ata 100–250 × 4–6 μm de diámetro. Os seus conidios son pequenos, duns 2 μm de diámetro, de forma globosa, paredes lisas e poden variar de cor amarela clara a hialinos.[10] Unha característica exclusiva desta especie é a produción de aleurioconidios, que son esporas asexuais producidas directamente nas hifas, que son maiores que os fialoconidios (por exemplo, 6–7 μm de diámetro). Esta estrutura pode influír na forma en que A. terreus se presenta clinicamente, xa que pode inducir respostas inflamatorias elevadas.[4][11][12]
Este fungo é doadamente distinguible doutras especies de Aspergillus pola súa cor marrón canela e a súa produción de aleurioconidios. A. terreus é unha especie termotolerante, xa que o seu crecemento óptimo ten lugar a temperaturas entre 35–40 °C, e o crecemento máximo a 45–48 °C.[13]
Ecoloxía
[editar | editar a fonte]A. terreus, igual que outras especies de Aspergillus, produce esporas que se dispersan eficientemente no aire a diversas distancias.[14][15] A morfoloxía deste fungo proporciona unha forma accesible de dispersión das esporas nas correntes de aire globalmente.[16] A elevación da cabeza esporulante no alto dun longo talo sobre a superficie de crecemento pode facilitar a dispersión das espeoras polo aire.[17] Normalmente, as esporas dos fungos descárganse no aire calmo, pero en A. terreus, este problema resólvese cos seus longos talos, que permiten que as esporas se descarguen en correntes de aire ou vento.[18] A. terreus ten mellores posibilidades para dispersar as súas esporas por unha vasta xeografía, o que explica a prevalencia en todo o mundo deste fungo.
Malia que A. terreus se encontra por todo o mundo en solo agrícola cálido, foi localizado en moitos hábitats diferentes como o compost e o po.[3] Finalmente, as esporas dispersadas do fungo entran en contacto cun material líquido ou sólido e establécense nel, pero só cando as condicións son axeitadas para a xerminación das esporas. Unha das condicións importantes para o fungo é o nivel de humidade presente no material. A menor actividade acuosa (Aw) capaz de soportar o crecemento do fungo da que se informou foi 0,78.[4] A tolerancia a condicións de Aw relativamente baixas pode explicar en parte a natureza ubicua desta especie dada a súa capacidade de crecer nunha ampla variedade de lugares.[15] A terra de testos de plantas é un hábitat común que permite o seu crecemento e a terra colonizada pode ser un importante reservorio de infeccións nosocomiais.[19] Outros hábitats inclúen o algodón, grans de cereais e vexetación en decomposición.[4]
Xenoma
[editar | editar a fonte]A Broad Fungal Genome Initiative financiada polo Instituto Nacional da Alerxia e Enfermidades Infecciosas de EUA reslizou a secuenciación de A. terreus en 2006. O resultado foi unha cobertura da secuencia de 11,05 ×. A. terreus contén de 30-35 Mbp e aproximadamente 10.000 xenes codificantes de proteínas.[12][20] A identificación de determinantes da virulencia no xenoma de A. terreus pode facilitar o desenvolvemento de novas estratexias para o tratamento de doenzas relacionadas con A. terreus. Ademais, como A. terreus é resistente ao fármaco antifúnxico común anfotericina B, os mecanismos que subxacen na súa resistencia poden comprenderse mellor por investigacións a nivel xenómico.[12][21]
O xene da policétido sintase atX produce o ácido 6-metilsalicílico en A. terreus.[22][23]
Infección
[editar | editar a fonte]Non é tan común que A. terreus cause infeccións oportunistas en humanos e outros animais coma outras especies de Aspergillus. Porén, a incidencia das infeccións por A. terreus está incrementándose máis repidamente do que a de calquera outro Aspergillus e por esa razón considérase un axente emerxente de infección.[24]
Como patóxeno oportunista pode causar tanto infeccións sistémicas coma superficiais.[25] A inhalación de esporas fúnxicas, que baixan polo tracto respiratorio, causan a infección respiratoria típica. Poden producirse tamén outras infeccións, como as onicomicoses (nas uñas) e otomicoses (nos oídos).[25][26] A. terreus ten a capacidade de causar efectos graves en pacientes inmunocomprometidos que carecen de células inmunes específicas. Concretamente, a neutropenia prolongada predispón a humanos e outros animais a estas doenzas fúnxicas.[17][24]
A. terreus non ten adaptacións para cambiar a súa estrutura física cando infecta humanos ou outros animais. O fungo continúa crecendo formando os característicos filamentos hifais. Outros fungos patóxenos adoitan cambiar a un diferente estado de crecemento, conversión de micelio a lévedo, para adaptarse mellor ao seu novo ambiente. Este proceso non ocorre en A. terreus.[17]
Plantas
[editar | editar a fonte]A. terreus leva utilizándose durante décadas en agricultura como un medio de control de fungos patóxenos de plantas que destrúen as colleitas. Porén, ao final da década de 1980, describiuse A. terreus como patóxeno fúnxico en plantas. Cultivos como o trigo e Lolium enferman cando os infecta A. terreus. Máis recentemente, descubriuse que a especie pode tamén causar doenzas foliares nas patacas. Isto describiuse primeiro na India.[27] A infección por A. terreus pode ter importantes implicacións alimentarias porque as patacas considéranse o terceiro cultivo agrícola máis importante para alimentar o mundo.[28]
A. terreus tamén perturba o ciclo reprodutivo sexual masculino do organismo modelo de plantas Arabidopsis thaliana. Os seus metabolitos secundarios ácido asptérrico e 6-hidroximeleína, liberados polo fungo inhiben a produción de pole, que contén os gametos masculinos da planta. Como así Arabidopsis thaliana non pode reproducirse, é estéril e non pode contribuír con descendentes para a seguinte xeración. Ao final, isto ten un efecto na diversidade xenética desta especie de plantas.[6]
Animais
[editar | editar a fonte]A. terreus pode causar infección en animais, pero está restrinxida a poucas especies, como cans e vacas. Son comúns os casos de abortos micóticos causados por A. terreus en vacas.[9][10][17] En cans, especialmente na raza pastor alemán, este fungo é tamén responsable de sinusite.[17] Pode afectar os cans pola súa diseminación noutras partes do corpo, incluíndo órganos como o bazo e riles.[9] Ademais, tamén pode afectar aosósos, o cal pode orixinar osteomielite espiñal.[12]
Moi poucos modelos animais presentan infeccións por A. terreus. Algúns modelos animais exitosos son o rato e o coello, onde A. terreus orixinou asperxilose pulmonar. Esrtes estudos son importantes porque proporcionan evidencias de que esta infección fúnxica pode causar doenzas.[29]
Humanos
[editar | editar a fonte]En humanos A. terreus é un patóxeno menos común que outras especies de Aspergillus, especialmente que A. fumigatus, A. flavus e A. niger.[24][26] Aínda que se observa con menos frecuencia nas mostras clínicas, A. terreus presenta evidencias de resistencia á anfotericina B, que se correlaciona cun alto grao de diseminación e un prognóstico global malo.[24][30]
A. terreus causa infeccións oportunistas, principalmente en persoas inmunocomprometidas como os pacientes de EPOC que están tomando corticosteroides, pacientes de cancro que reciben quimioterapia ou pacientes de VIH/SIDA.[17] Nun individuo inmunocompetente a inhalación de esporas inicia a inmediata liberación de macrófagos e neutrófilos. Nun individuo inmunosuprimido esta resposta é menos vigorosa. A maioría destes individuos sofren de neutropenia, o que os fai menos capaces de defenderse. Ademais, A. terreus libera metabolitos tóxicos que atacan as células inmunitarias, como os neutrófilos, que proporcionan as condicións axeitadas para que este fungo prospere.[26]
A infección por A. terreus pode orixinar infeccións superficiais en humanos. Isto afecta a capa externa do corpo. Íllase comunmente en onicomicoses nas uñas humanas.[9][10] A incidencia de onicomicoses como resultado de A. terreus (que non é o axente dermatófito común) está incrementándose. Algunhas veces pode chegar a ser a infección superficial da que se informa máis frecuentemente en clínicas e hospitais.[25] Outras infeccións superficiais comúns causadas por A. terreus son as otomicoses (infeccións de oído), que se dan sobre todo en pacientes que sufriron operacións recentes.[4][10]
Ademais, a infección por A. terreus pode orixinar catro enfermidades sistémicas:[3]
- Asperxilose broncopulmonar alérxica
- Bronquite por Aspergillus e traquobronquite por Aspergillus invasiva
- Asperxilose (pulmonar) invasiva
- Asperxilose diseminada.
Aínda que estas catro enfermidades resultantes poden supoñer un gran risco para a saúde en humanos; a asperxilose invasiva adoita ser a que ten o maior risco de mortalidade e morbilidade en ratas e humanos.[12] Os estudos epidemiolóxicos mostraron que a incidencia de A. terreus como causa de asperxilose invasiva incrementouse en relación con outras especies do xénero.[31] A infección por A. terreus causa un 100% de taxa de mortalidade en persoas que enferman de asperxilose invasiva. Comparada con outras 20 especies de Aspergillus, a infección por A. terreus está asociada cun peor prognóstico e alta mortalidade. De feito, a asperxilose invasiva é unha salientable causa de morte en pacientes de leucemia e transplante de células nai.[12]
Tratamento e prevención
[editar | editar a fonte]O tratamento das infeccións por A. terreus é complicada clinicamente debido á súa case completa resistencia á anfotericina B, o fármaco de último recurso para as infeccións fúnxicas graves.[12][24] Porén, algúns fármacos novos, como o voriconazol, posaconazol e caspofunxina, parecen prometedores no tratamento deste axente.[32]
A identificación de laboratorio de A. terreus a partir de mostras clínicas pode ser tamén difícil. Actualmente, non se dispón de tests inmunolóxicos rápidos para esta especie e a súa correcta identificación segue dependendo do cultivo. As cepas de A. terreus teñen a tendencia a mutar mentres están dentro do animal hóspede, o que ten como resultado unha redución substancial ou perda de cabezas con esporas características nos cultivos primarios. Ditas cepas continúan producindo pequenos aleuroconidios similares en aparencia aos aleurioconidios de Blastomyces dermatitidis.
Nun estudo, case un terzo das infeccións por A. terreus en hospitais estaban asociadas coa presenza de testos con plantas, en cuxa terra pode estar o fungo.[24] A eliminación de testos de plantas das habitacións de pacientes inmunodeficientes pode ter un papel na prevención da enfermidade. A. terreus foi tamén descrito en moitos estudos como axente común en instalacións hospitalarias debido a obras de construción e renovación levadas a cabo no exterior do hospial. A gran cantidade de terra e restos que pasan ao aire por causa das obras pode viaxar polo aire e infectar a pacientes inmunosuprimidos.[33] Unha maneira simple de tomar accións preventivas é ter unha boa filtración de aire e boa ventilación en todas as habitacións do hospital. A eliminación do inóculo é clave na prevención de infeccións nosocomiais por A. terreus.[34]
Usos industriais
[editar | editar a fonte]A. terreus produce varios metabolitos secundarios e micotoxinas, incluíndo os seguintes: territrem A, citreoviridina, citrinina, gliotoxina, patulina, terreína, ácido terreico e terretonina.[12] O fungo tamén produce un metabolito secundario chamado lovastatina, un potente fármaco que rebaixa os niveis séricos de colesterol en humanos e animais. É un inhibidor dun dos encimas responsables das etapas de catalización da biosíntese do colesterol. A lovastatina prodúcese nas condicións axeitadas de fermentación do fungo. O crecemento rápido de hifas filamentosas na especie A. terreus pode resultar nunha baixa produción de lovastatina. Para incrementar a produción deste metabolito A. terreus require nutrientes importantes durante a fermentación. Neste caso, o carbono e o nitróxeno son moi importantes na produtividade da fermentación, o cal, á súa vez, tamén incrementa a cantidade do metabolito lovastativa.[35] As cepas de A. terreus usan glicerol e glicosa como as súas mellores fontes de carbono para a produción de lovastatina.[36]
Tamén se usa para producir o fármaco simvastatina, que está quimicamente relacionado coa lovastatina.[37]
Notas
[editar | editar a fonte]- ↑ Thom C, Church M.B. (1918). "Aspergillus fumigatus, A. nidulans, A. terreus n. sp. and their allies". American Journal of Botany 5 (2): 84–104. JSTOR 2435130. doi:10.2307/2435130.
- ↑ Arabatzis M, Velegraki A (2013). "Sexual reproduction in the opportunistic human pathogen Aspergillus terreus". Mycologia 105 (1): 71–9. PMID 23074177. doi:10.3852/11-426.
- ↑ 3,0 3,1 3,2 3,3 3,4 "Fungal Infections Aspergillus terreus". Leading International Fungal Education. Arquivado dende o orixinal o 02 de decembro de 2013. Consultado o 13 de outubro de 2013.
- ↑ 4,0 4,1 4,2 4,3 4,4 "Aspergillus terreus". University of Minnesota. Arquivado dende o orixinal o 23 September 2015. Consultado o 13 de outubro de 2013.
- ↑ "Aspergillus terreus". Doctor of Fungus. Arquivado dende o orixinal o 3 de decembro de 2013. Consultado o 14 de outubro de 2013.
- ↑ 6,0 6,1 Shimada, A; Kusano,M; Takeuchi,S; Fujioka,S; Inokuchi,T; Kimura, Y (2002). "Aspterric acid and 6-hydroxymellein, inhibitors of pollen development in Arabidopsis thaliana, produced by Aspergillus terreus". Journal of Biosciences 57 (5–6): 459–464. PMID 12132685. doi:10.1515/znc-2002-5-610.
- ↑ Tran, Danny (14 de abril de 2023). "Plastic-eating backyard fungi discovery boosts hopes for a solution to the recycling crisis". Australian Broadcasting Corporation News. Consultado o 26 de abril de 2023.
- ↑ 8,0 8,1 Samson, R.A.; Hoekstra, E.S.; Frisvad, J.C. (2004). Introduction to food- and airborne fungi.
- ↑ 9,0 9,1 9,2 9,3 "ASPERGILLUS TERREUS" (PDF). IMI Descriptions of Fungi and Bacteria No. 1253. Consultado o 14 de outubro de 2013.
- ↑ 10,0 10,1 10,2 10,3 "ASPERGILLUS TERREUS" (PDF). C.M.I. Descriptions of Pathogenic Fungi and Bacteria No. 95. Consultado o 13 de outubro de 2013.
- ↑ Lass-Florl, Cornelia (2012). "Aspergillus terreus: How Inoculum Size and Host Characteristics Affect Its Virulence". The Journal of Infectious Diseases 205 (8): 1192–1194. PMID 22438395. doi:10.1093/infdis/jis185.
- ↑ 12,0 12,1 12,2 12,3 12,4 12,5 12,6 12,7 "Comparative analysis of an emerging fungal pathogen, Aspergillus terreus" (PDF). 2006. Arquivado dende o orixinal (PDF) o 2006-08-15.
- ↑ Anderson, K.H. Domsch ; W. Gams ; Traute-Heidi (1980). Compendium of soil fungi (2ª impresión. ed.). London, UK: Academic Press. ISBN 9780122204029.
- ↑ Hedayati, M.T.; Pasqualotto, Warn; Bowyer, Denning (2007). "Aspergillus flavus: human pathogen, allergen and mycotoxin producer". Journal of Medical Microbiology 153 (6): 1677–1692. PMID 17526826. doi:10.1099/mic.0.2007/007641-0. Consultado o 9 de novembro de 2013.
- ↑ 15,0 15,1 "Aspergillus". Consultado o 9 de novembro de 2013.
- ↑ "FUNGI REPRODUCING ASEXUALLY BY MEANS OF CONIDIA". New Brunswick Museum. Arquivado dende o orixinal o 13 de novembro de 2013. Consultado o 10 de novembro de 2013.
- ↑ 17,0 17,1 17,2 17,3 17,4 17,5 Summerbell, Richard. "Lecture 9 – Opportunistic mycoses I: Aspergillosis, Sporotrichosis, Zygomycosis & Rhinosporidiosis" (PDF). Arquivado dende o orixinal (PDF) o 2013-12-02.
- ↑ Fogel, Robert. "Spore dispersal: The big gamble". Arquivado dende o orixinal o 18 de xaneirode 2004. Consultado o 10 de novembro de 2013.
- ↑ Hedayati, M.T.; Mohseni-Bandpi, Moradi (2004). "A survey on the pathogenic fungi in soil samples of potted plants from Sari hospitals, Iran". Journal of Hospital Infection 58 (1): 59–62. PMID 15350715. doi:10.1016/j.jhin.2004.04.011.
- ↑ "Genomes". CADRE. Arquivado dende o orixinal o 27 de xullo de 2012. Consultado o 15 October 2013.
- ↑ "Descriptions". BROAD Institute. Consultado o 15 de outubro de 2013.
- ↑ Anyaogu, Diana Chinyere; Mortensen, Uffe Hasbro (2015-02-10). "Heterologous production of fungal secondary metabolites in Aspergilli". Frontiers in Microbiology (Frontiers) 6: 77. ISSN 1664-302X. PMC 4322707. PMID 25713568. doi:10.3389/fmicb.2015.00077.
- ↑ Atanasov, Atanas G.; Zotchev, Sergey B.; Dirsch, Verena M.; Supuran, Claudiu T. (2021-01-28). "Natural products in drug discovery: advances and opportunities (The International Natural Product Sciences Taskforce)". Nature Reviews Drug Discovery (Nature Portfolio) 20 (3): 200–216. ISSN 1474-1776. PMC 7841765. PMID 33510482. doi:10.1038/s41573-020-00114-z.
- ↑ 24,0 24,1 24,2 24,3 24,4 24,5 Lass-Florl, Cornelia; Griff K.; Mayr A.; Petzer A.; Gastl G.; Bonatti H.; Freund M.; Kropshofer G.; Dierich M.; Nachbaur D. (2005). "Epidemiology and outcome of infections due to Aspergillus terreus: 10-year single centre experience". British Journal of Haematology 131 (2): 20–207. PMID 16197450. doi:10.1111/j.1365-2141.2005.05763.x.
- ↑ 25,0 25,1 25,2 Fernandez, Mariana; Rojas F.; Cattana M.; Sosa M.; Mangiaterra M.; Giusiano G. (2013). "Aspergillus terreus complex: an emergent opportunistic agent of Onychomycosis". Mycoses 56 (4): 477–481. PMID 23448599. doi:10.1111/myc.12061.
- ↑ 26,0 26,1 26,2 "Aspergillosis". Consultado o 10 de novembro de 2013.
- ↑ Louis, B; Roy P.; Sayanika D.; Talukdar N (2013). "Aspergillus terreus Thom a new pathogen that causes foliar blight of potato" (PDF). Plant Pathology & Quarantine 3: 29–33. doi:10.5943/ppq/3/1/5.
- ↑ Molina, La. "Facts & figures". International Potato Center. Consultado o 12 de novembro de 2013.
- ↑ Lass-Florl, Cornelia (20 de marzo de 2012). "Aspergillus terreus: How Inoculum Size and Host Characteristics Affect Its Virulence". Journal of Infectious Diseases 205 (8): 1192–1194. PMID 22438395. doi:10.1093/infdis/jis185.
- ↑ Slesiona, S.; Ibrahim-Granet, O.; Olias, P.; Brock, M.; Jacobsen, I. D. (20 de marzo de 2012). "Murine Infection Models for Aspergillus terreus Pulmonary Aspergillosis Reveal Long-term Persistence of Conidia and Liver Degeneration". Journal of Infectious Diseases 205 (8): 1268–1277. PMID 22438397. doi:10.1093/infdis/jis193.
- ↑ Baddley, J. W.; Pappas, P. G.; Smith, A. C.; Moser, S. A. (8 December 2003). "Epidemiology of Aspergillus terreus at a University Hospital". Journal of Clinical Microbiology 41 (12): 5525–5529. PMC 308992. PMID 14662934. doi:10.1128/JCM.41.12.5525-5529.2003.
- ↑ Goldberg, S. L.; Geha, D. J.; Marshall, W. F.; Inwards, D. J.; Hoagland, H. C. (1 de xuño de 1993). "Successful Treatment of Simultaneous Pulmonary Pseudallescheria boydii and Aspergillus terreus Infection with Oral Itraconazole". Clinical Infectious Diseases 16 (6): 803–805. PMID 8392389. doi:10.1093/clind/16.6.803.
- ↑ Flynn, Patricia; Williams B.; Hetherington S.; Williams B.; Giannini M.; Pearson T. (1993). "Aspergillus terreus During Hospital Renovation". Infection Control and Hospital Epidemiology 14 (7): 363–365. JSTOR 30148315. PMID 8354865. doi:10.1086/646761.
- ↑ Hoog, G.S. "Pathogenicity". Mycobank. Consultado o 4 de novembro de 2013.
- ↑ Lopez, J.L; Perez J.L.; Sevilla J.M.; Fernandez FG.; Grima E.; Chisti Y (2003). "Production of lovastatin by Aspergillus terreus: effects of the C:N ratio and the principal nutrients on growth and metabolite production" (PDF). Enzyme and Microbial Technology 33 (2–3): 270–277. doi:10.1016/s0141-0229(03)00130-3. Arquivado dende o orixinal (PDF) o 20 de febreiro de 2018. Consultado o 05 de agosto de 2023.
- ↑ Szakacs, G; Morovjan G.; Tengerdy R (1998). "Production of lovastatin by a wild strain of Aspergillus terreus". Biotechnology Letters 20 (4): 411–415. doi:10.1023/A:1005391716830.
- ↑ Cechinel-Filho, Valdir (2012). Plant bioactives and drug discovery: principles, practice, and perspectives. Hoboken, N.J.: John Wiley & Sons. p. 104. ISBN 9780470582268. Arquivado dende o orixinal o 2016-03-05.

