Vesícula sináptica
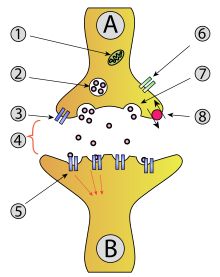
1. Mitocondrias;
2. Vesícula sináptica con neurotransmiores;
3. Autorreceptor
4. Sinapse co neurotransmisor liberado (serotonina);
5. Receptores postsinápticos activados por un neurotransmisor (indución dun potencial postsináptico);
6. Canle de calcio;
7. Exocitose dunha vesícula;
8. Neurotransmisor recapturado.
As vesículas sinápticas ou vesículas de neurotransmisor son vesículas presentes nas neuronas que almacenan varios neurotransmisores que son liberados na sinapse. A liberación está regulada por unha canle de calcio dependente de voltaxe. As vesículas son esenciais para propagar o impulso nervioso entre neuronas e están sendo constantemente xeradas pola célula. A área do axón que contén grupos de vesículas é o terminal axónico ou "botón terminal". En cada botón poden libberarse ata unhas 130 vesículas nun período de dez minutos de estimulación a 0,2 Hz.[1] No córtex visual do cerebro humano, as vesículas sinápticas teñen un diámetro medio de 39,5 nanómetros (nm) cunha desviación estándar de 5,1 nm.[2]
Estrutura
[editar | editar a fonte]
As vesículas sinápticas son relativamente simples porque só caben un limitado número de proteínas dentro dunha esfera de 40 nm de diámetro. As vesículas purificadas teñen unha proporción proteína:fosfolípido de 1:3 cunha composición de lípidos de 40% de fosfatidilcolina, 32% de fosfatidiletanolamina, 12% de fosfatidilserina, 5% de fosfatidilinositol e 10% de colesterol.[4]
As vesículas sinápticas conteñen dúas clases de compoñentes obrigatorios: proteínas de transporte implicadas na captación do neurotransmisor e proteínas de tráfico que participan na exocitose da vesícula sináptica e na súa reciclaxe.
- As proteínas de transporte están compostas de bombas de protóns que xeran gradientes electroquímicos, que permiten a captación do neurotransmisor, e transportadores de neurotransmisores que regulan a captación real do neurotransmisor. O gradiente protónico necesario é creado pola V-ATPase, que utiliza o ATP como fonte de enerxía. Os transportadores vesiculares moven os neurotransmisores desde o citoplasma das células ás vesículas sinápticas. Os transportadores de glutamato vesiculares, por exemplo, secuestran o glutamato nas vesículas por medio deste proceso.
- As proteínas de tráfico son máis complexas. Inclúen proteínas intrínsecas de membrana, proteínas unidas perifericamente, e proteínas como as SNARE. Estas proteínas non comparten unha característica distintiva que as poida identificar como proteínas das vesículas sinápticas e pouco se sabe sobre como se depositan estas proteínas especificamente nas vesículas sinápticas. Moitas, pero non todas, das proteínas das vesículas sinápticas coñecidas interaccionan con proteínas non vesiculares e están asociadas a determinadas funcións.[4]
A estequiometría do movemento de diferentes neurotransmisores a unha vesícula dáse na seguinte táboa:
| Tipo(s) de neurotransmisor | Movemento cara ao interior | Movemento cara ao exterior |
|---|---|---|
| noradrenalina (norepinefrina), dopamina, histamina, serotonina e acetilcolina | neurotransmisor+ | 2 H+ |
| GABA e glicina | neurotransmisor | 1 H+ |
| glutamato | neurotransmisor− + Cl− | 1 H+ |
Recentemente, descubriuse que as vesículas sinápticas tamén conteñen pequenas moléculas de ARN, incluíndo fragmentos de ARN transferente, fragmentos de ARN Y e microARN.[5] Este descubrimento crese que terá un grande impacto no estudo das sinapses químicas.
Efectos das neurotoxinas
[editar | editar a fonte]Algunhas neurotoxinas, como a batracotoxina, sábese que destrúen as vesículas sinápticas. A toxina tetánica dana as proteínas de membrana asociadas a vesículas (VAMP), un tipo de v-SNARE, mentres que a toxina botúlica dana as t-SNARES e v-SNARES e así inhibe a transmisión sináptica.[6] Unha toxina de arañas chamada alfa-latrotoxina únese ás neurexinas, danando as vesículas e causando unha liberación masiva de neurotransmisores.
Conxuntos de vesículas
[editar | editar a fonte]As vesículas da terminal nerviosa poden agruparse en tres conxuntos: as vesículas liberables doadamente, as vesículas de reciclaxe, e as vesículas de reserva.[7] Estes tres conxuntos distínguense pola súa función e posición no terminal nervioso. O conxunto de vesículas liberables doadamente atracan na membrana plasmática, polo que son as primeiras que se liberan durante a estimulación. Trátase de vesículas pequenas que se esgotan rapidamente. O conxunto de vesículas de reciclaxe están próximas á membrana e adoitan ser cicladas con moderada estimulación, de modo que a proporción de vesículas liberadas é a mesma ou inferior que a a velocidade de formación de vesículas. Estas son máis grandes que as que se liberan doadamente, pero tardan máis tempo en ser mobilizadas. O conxunto de vesículas de reserva comprende vesículas que non son liberadas en condicións normais. Este conxunto de reseva pode ser bastante grande (~50%) en neuronas que crecen sobre un substrato de vidro, pero é moi pequeno ou está ausente nas sinapses maduras en tecido cerebral intacto.[8][9]
Fisioloxía
[editar | editar a fonte]O ciclo das vesículas sinápticas
[editar | editar a fonte]Os eventos do ciclo das vesículas sináptias poden dividirse en varios pasos clave:[10]
- 1. Tráfico cara á sinapse
Os compoñentes da vesícula sináptica son dirixidos inicialmente á sinapse utilizando proteínas da familia das proteínas motoras cinesinas. No verme Caenorhabditis elegans o principal motor para as vesículas sinápticas é UNC-104.[11] Tamén hai probas de que outras proteínas como UNC-16/Sunday Driver regulan o uso de motores de transorte das vesículas sinápticas.[12]
- 2. Carga do transmisor
Unha vez na sinapse, as vesículas sinápticas cárganse cun neurotransmisor. A carga do neurotransmisor é un proceso activo para o que cómpre un transportador do neurotransmisor e unha ATPase bomba de protóns que proporciona un gradiente electroquímico. Estes transportadores son selectivos para diferentes clases de transmisores. Ata agora describíronse os xenes unc-17 e unc-47 e os seus mutantes, que codifican o transportador de acetilcolina vesicular e o transportador de GABA vesicular en C. elegans.[13]
- 3. Atraque
As vesículas sinápticas cargadas deben atracar preto dos sitios de liberación, pero o atraqaue é unha etapa do ciclo da que se sabe pouco. Identificáronse moitas proteínas ou vesículas sinápticas nos sitios de liberación; porén, ningunha das interaccións identificadas entre as proteínas da vesícula e as proteínas do sitio de liberación poden explicar a fase de atraque do ciclo. Os mutantes nas proteínas rab-3 e unc-18 alteran o atraque das vesículas ou a organización das vesículas nos sitios de liberación, pero non distorsionan completamente o atraque.[14] As proteínas SNARE non parecen estar implica<das na etapa de atraque do ciclo.
- 4. Cebado
Despois de que as vesículas sinápticas atracan inicialmente, deben ser cebados antes de que poidan empezar a fusionarse. O cebado prepara a vesícula sináptica polo que poden fusionarse rapidamente en resposta ao influxo de calcio. Este paso de cebado pénsase que implica a formación de complexos de SNARE parcialmente ensamblados. Neste evento participan as proteínas Munc13, RIM e RIM-BP.[15] Pénsase que Munc13 estimula o cambio que experimenta a t-SNARE sintaxina desde unha conformación pechada a unha conformación aberta, que estimula a ensamblaxe de complexos v-SNARE/t-SNARE.[16] RIM tamén parece regular o cebado, pero non é esencial para este paso.
- 5. Fusión
As vesículas cebadas fusiónanse rapidamente en resposta aos aumentos de calcio no citoplasma. Este evento de fusión pénsase que está mediado directamente polas SNARE e impulsado pola enerxía proporcionada pola ensamblaxe das SNARE. O sensor de calcio que desencadea este evento é a proteína da vesícula sináptica que se une ao calcio sinaptotagmina. A capacidade das SNARE de mediar a fusión de maneira dependente do calcio foi reconstruída recentemente in vitro. De maneira consistente co feito de que as SNARE son esenciais para o proceso de fusión, os mutantes de v-SNARE e t-SNARE de C. elegans son letais. De xeito similar, os mutantes de Drosophila e os ratos knockout indican que estes SNARE desempeñan un papel fundamental na exocitose sináptica.[10]
- 6. Endocitose
Explica a recaptación de vesículas sinápticas no modelo de fusión por contacto total. Porén, outros estudos acumularon probas que suxiren que este tipo de fusión e endocitose non se produce sempre.
Reciclaxe das vesículas
[editar | editar a fonte]Pénsase que hai dous mecanismos de acción principais responsables da reciclaxe das vesículas sinápticas: a fusión por colapso total e o método "bicar e correr" ("kiss-and-run" na literatura inglesa). Ambos os mecanismos empezan coa formación do poro sináptico que libera un transmisor no espazo extracelular. Despois da liberación do neurotransmisor, o poro pode dilatarse completamente de modo que a vesícula se colapse completamente na membrana sináptica, ou pode pecharse rapidamente e evaxinarse da membrana para xerar a fusión de tipo "bicar e correr".[17]
Fusión por colapso total
[editar | editar a fonte]Demostrouse que os períodos de intensa estimulación na sinapse neural fan diminuír a cantidade de vesículas e incrementan a capacitancia celular e área superficial.[18] Isto indica que despois de que as vesículas sinápticas liberan o seu cargamento, fusiónanse coa membrana plasmática e pasan a formar parte dela. Heuser e Reese, etiquetaron as vesículas sinápticas con HRP (peroxidase do ravo picante) e encontraron que porcións da membrana plasmática nas unións musculares da ra eran captadas pola célula e convertidas de novo en vesículas sinápticas.[19] Os estudos realizados suxiren que todo o ciclo de exocitose, recuperación e reformación das vesículas sinápticas faise en menos dun minuto.[20]
Na fusión por colapso total, a vesícula sináptica fusiónase e queda incorporada á membrana plasmática. A formación da nova membrana é un proceso mediado por proteínas e só pode ocorrer baixo cerras condicións. Despois dun potencial de acción, o Ca2+ inunda a membrana presináptica. O Ca2+ únese a proteínas específicas no citoplasma, un dos cales é a sinaptotagmina, que á súa vez desencadea a fusión completa da vesícula sináptica coa membrana celular. Esta fusión completa do poro é axudada polas proteínas SNARE. Isto desencadea o atraque mediado por unha gran familia de proteínas da vesícula sináptica de maneira dependente do ATP. Coa axuda da sinaptobrevina da vesícula sináptica, o complexo de t-SNARE da membrana, constituído por sintaxina e SNAP-25, pode atracar, cebar e fusionar a vesícula sináptica na membrana.[21]
O mecanismo que está detrás da fusión por colapso total é a diana para as toxinas do botulismo e o tétano. A toxina botúlica ten unha actividade de protease que degrada a proteína SNAP-25. A proteína SNAP-25 é necesaria para a fusión de vesículas que libera neurotransmisores, en especial a acetilcolina.[22] A toxina botúlica esencialmente cliva estas proteínas SNARE, e ao facelo, impide que as vesículas sinápticas se fusionen coa membrana sináptica celular e liberen os seus neurotransmisores. A toxina tetánica segue unha vía similar, pero atacando a proteína sinaptobrevina na vesícula sináptica. Á súa vez, estas neurotoxinas impiden que as vesículas sinápticas realicen unha fusión por colapso total. Se este mecanismo non funciona, poden ocorrer espasmos musculares, parálise e a morte.
"Bicar e correr"
[editar | editar a fonte]O segundo mecanismo polo cal se reciclan as vesículas sinápticas denomínase fusión de "bicar e correr" (kiss and run). Neste caso, a vesícula sináptica "bica" a membrana plasmática, abrindo un pequeno poro a través do cal se liberará o seu cargamento de neurotransmisores, despois péchase o poro e a vesícula é reciclada cara ao interior da célula.[17] O mecanismo de "bicar e correr"" foi un asunto moi debatido. Observáronse e rexistráronse os seus efectos; porén a razón que está detrás do seu uso en oposición coa fusión por colapso total está aínda sendo explorada. Especulouse que o modo de "bicar e correr" emprégase a miúdo para conservar fontes de vesículas escasas e utilízase para responder a impulsos de alta frecuencia.[23] Os experimentos mostraron que os eventos de "bicar e correr" ocorren realmente. Foron observados primeiro por Katz e del Castillo, e despois observouse que o mecanismo de "bicar e correr" era diferente da fusión por colapso total porque a capacitancia celular non se incrementaba nos eventos de "bicar e correr".[23] Isto reforza a idea dun mecanismo de tipo "bicar e correr": a vesícula sináptica libera o seu cargamento e despois sepárase da membrana.
Modulación
[editar | editar a fonte]As células parecen ter polo menos dous mecanismos para a reciclaxe da membrana. En certas condicións, as células poden cambiar dun mecanismo a outro. A lenta fusión por colapso total convencional predomina na membrana sináptica cando os niveis de Ca2+ son baixos, e o mecanismo rápido de "bicar e correr" é o que se realiza cando os niveis de Ca2+ son altos.
Ales et al. mostraron que as concentracións elevadas de ión calcio extracelular cambian o modo preferido de reciclaxe e liberación de vesículas sinápticas ao mecanismo de "bicar e correr" de maneira dependente da concentración de calcio. Propúxose que durante a secreción de neurotransmisores nas sinapses, o modo de exocitose é modulado polo calcio para alcanzar as condicións óptimas para a exocitose e endocitose acopladas segundo a actividade sináptica.[24]
A evidencia experimental suxire que o modo "bicar e correr" é o modo dominente de liberación sináptica ao inicio dos trens de estímulos. Neste contexto, o "bicar e correr" supón unha alta probabilidade de liberación de vesículas. A incidencia do "bicar e correr" é tamén incrementada polo rápido disparo de impulsos e estimulación da neurona, o que indica que a cinética deste tipo de liberación é máis rápida que outras formas de liberación de vesículas.[25]
Historia
[editar | editar a fonte]Coa aparición da microscopia electrónica a inicios da década de 1950, atopouse que as terminacions nerviosas contiñan un gran número de vesículas transparentes aos electróns.[26][27] O termo vesícula sináptica foi utilizado por primeira vez por De Robertis e Bennett en 1954.[28] Pouco despois atopouse que a liberación de transmisores na unión neuromuscular nas ras inducía potenciais de placa final miniatura postsinápticos que foron adscritos á liberación de paquetes discretos de neurotransmisores (cuantos) desde a terminal nerviosa presináptica.[29][30] Era, pois, razoable hipotetizar que a substancia transmisora (acetilcolina) estaba contida dentro das vesículas, as cales liberarían o seu contido por un mecanismo secretor no espazo sináptico (hipótese da vesícula).[31][32]
Faltaba por demostrar que o neurotransmisor acetilcolina estaba realmente contido nas vesículas sinápticas. Uns dez anos despois, a aplicación de técnicas de fraccionamento subcelular ao tecido cerebral permitiu o illamento de terminacións nerviosas (sinaptosomas),[33] e das propias vesículas sinápticas do cerebro de mamíferos. Este traballo realizouse pola competencia entre dous laboratorios, o de Victor P. Whittaker no Instituto de Fisioloxía Animal, Consello de Investigación Agrícola, Babraham, Cambridge, Reino Unido e o de Eduardo de Robertis no Instituto de Anatomía Xeral e Embrioloxía, Facultade de Medicina, Universidade de Buenos Aires, Arxentina. O traballo de Whittaker que demostraba a presenza de acetilcolina nas fraccións vesiculares de cerebro de coello de Indias foi publicado como resumo en 1960 e despois con máis detalle en 1963 e 1964,[34][35] e o artigo do grupo de de Robertis que demostraba un enriquecemento de acetilcolina unida nas fraccións das vesículas sinápticas de cerebro de rata apareceu en 1963.[36] Ambos os grupos liberaron vesículas sinápticas de sinaptosomas illados por shock osmótico. Estimouse orixinalmente que o contido de acetilcolina dunha vesícula estaba entre 1000 e 2000 moléculas.[37] Posteriores traballos identificaron a localización vesicular doutros neurotrnsmisores, como os aminoácidos, catecolaminas, serotonina e ATP. Despois, as vesículas sinápticas puideron tamén illarse doutros tecidos como o ganglio cervical superior,[38] ou o cerebro de polbo.[39] O illamento de fraccións altamente purificadas de vesículas sinápticas colinérxicas do órgano eléctrico da raia Torpedo[40][41] foi un importante paso adiante no estudo da bioquímica e función das vesículas.
Notas
[editar | editar a fonte]- ↑ Ikeda, K; Bekkers, JM (2009). "Counting the number of releasable synaptic vesicles in a presynaptic terminal". Proc Natl Acad Sci U S A 106 (8): 2945–50. Bibcode:2009PNAS..106.2945I. PMC 2650301. PMID 19202060. doi:10.1073/pnas.0811017106.
- ↑ Qu, Lei; Akbergenova, Yulia; Hu, Yunming; Schikorski, Thomas (March 2009). "Synapse-to-synapse variation in mean synaptic vesicle size and its relationship with synaptic morphology and function". The Journal of Comparative Neurology 514 (4): 343–352. PMID 19330815. doi:10.1002/cne.22007.
- ↑ Tonna, Noemi; Bianco, Fabio; Matteoli, Michela; Cagnoli, Cinzia; Antonucci, Flavia; Manfredi, Amedea; Mauro, Nicolò; Ranucci, Elisabetta; Ferruti, Paolo (2014). "A soluble biocompatible guanidine-containing polyamidoamine as promoter of primary brain cell adhesion andin vitrocell culturing". Science and Technology of Advanced Materials 15 (4): 045007. Bibcode:2014STAdM..15d5007T. PMC 5090696. PMID 27877708. doi:10.1088/1468-6996/15/4/045007.
- ↑ 4,0 4,1 Benfenati, F.; Greengard, P.; Brunner, J.; Bähler, M. (1989). "Electrostatic and hydrophobic interactions of synapsin I and synapsin I fragments with phospholipid bilayers". The Journal of Cell Biology 108 (5): 1851–1862. PMC 2115549. PMID 2497105. doi:10.1083/jcb.108.5.1851.
- ↑ Li, Huinan; Wu, Cheng; Aramayo, Rodolfo; Sachs, Matthew S.; Harlow, Mark L. (2015-10-08). "Synaptic vesicles contain small ribonucleic acids (sRNAs) including transfer RNA fragments (trfRNA) and microRNAs (miRNA)". Scientific Reports (en inglés) 5: 14918. Bibcode:2015NatSR...514918L. PMC 4597359. PMID 26446566. doi:10.1038/srep14918.
- ↑ Kandel ER, Schwartz JH, Jessell TM, eds. (2000). "Transmitter Release". Principles of Neural Science (4th ed.). New York: McGraw-Hill. ISBN 978-0-8385-7701-1.
- ↑ Rizzoli, Silvio O; Betz, William J (January 2005). "Synaptic vesicle pools". Nature Reviews Neuroscience 6 (1): 57–69. PMID 15611727. doi:10.1038/nrn1583.
- ↑ Rose, Tobias; Schoenenberger, Philipp; Jezek, Karel; Oertner, Thomas G. (2013). "Developmental Refinement of Vesicle Cycling at Schaffer Collateral Synapses". Neuron 77 (6): 1109–1121. PMID 23522046. doi:10.1016/j.neuron.2013.01.021.
- ↑ Xue, Lei; Sheng, Jiansong; Wu, Xin-Sheng; Wu, Wei; Luo, Fujun; Shin, Wonchul; Chiang, Hsueh-Cheng; Wu, Ling-Gang (2013-05-15). "Most Vesicles in a Central Nerve Terminal Participate in Recycling". Journal of Neuroscience 33 (20): 8820–8826. PMC 3710729. PMID 23678124. doi:10.1523/jneurosci.4029-12.2013.
- ↑ 10,0 10,1 Südhof, T. C. (2004). "The Synaptic Vesicle Cycle". Annual Review of Neuroscience 27: 509–547. PMID 15217342. doi:10.1146/annurev.neuro.26.041002.131412.
- ↑ Tien, N. W.; Wu, G. H.; Hsu, C. C.; Chang, C. Y.; Wagner, O. I. (2011). "Tau/PTL-1 associates with kinesin-3 KIF1A/UNC-104 and affects the motor's motility characteristics in C. Elegans neurons". Neurobiology of Disease 43 (2): 495–506. PMID 21569846. doi:10.1016/j.nbd.2011.04.023.
- ↑ Arimoto, M.; Koushika, S. P.; Choudhary, B. C.; Li, C.; Matsumoto, K.; Hisamoto, N. (2011). "The Caenorhabditis elegans JIP3 Protein UNC-16 Functions As an Adaptor to Link Kinesin-1 with Cytoplasmic Dynein". Journal of Neuroscience 31 (6): 2216–2224. PMID 21307258. doi:10.1523/JNEUROSCI.2653-10.2011.
- ↑ Sandoval, G. M.; Duerr, J. S.; Hodgkin, J.; Rand, J. B.; Ruvkun, G. (2006). "A genetic interaction between the vesicular acetylcholine transporter VAChT/UNC-17 and synaptobrevin/SNB-1 in C. elegans". Nature Neuroscience 9 (5): 599–601. PMID 16604067. doi:10.1038/nn1685.
- ↑ Abraham, C.; Bai, L.; Leube, R. E. (2011). "Synaptogyrin-dependent modulation of synaptic neurotransmission in Caenorhabditis elegans". Neuroscience 190: 75–88. PMID 21689733. doi:10.1016/j.neuroscience.2011.05.069.
- ↑ Kaeser, Pascal S.; Deng, Lunbin; Wang, Yun; Dulubova, Irina; Liu, Xinran; Rizo, Josep; Südhof, Thomas C. (2011). "RIM Proteins Tether Ca2+ Channels to Presynaptic Active Zones via a Direct PDZ-Domain Interaction". Cell 144 (2): 282–295. PMC 3063406. PMID 21241895. doi:10.1016/j.cell.2010.12.029.
- ↑ Lin, X. G.; Ming, M.; Chen, M. R.; Niu, W. P.; Zhang, Y. D.; Liu, B.; Jiu, Y. M.; Yu, J. W.; Xu, T.; Wu, Z. X. (2010). "UNC-31/CAPS docks and primes dense core vesicles in C. Elegans neurons". Biochemical and Biophysical Research Communications 397 (3): 526–531. PMID 20515653. doi:10.1016/j.bbrc.2010.05.148.
- ↑ 17,0 17,1 Breckenridge, L. J.; Almers, W. (1987). "Currents through the fusion pore that forms during exocytosis of a secretory vesicle". Nature 328 (6133): 814–817. Bibcode:1987Natur.328..814B. PMID 2442614. doi:10.1038/328814a0.
- ↑ Heuser, J. E.; Reese, T. S. (1973). "EVIDENCE FOR RECYCLING OF SYNAPTIC VESICLE MEMBRANE DURING TRANSMITTER RELEASE AT THE FROG NEUROMUSCULAR JUNCTION". The Journal of Cell Biology 57 (2): 315–344. PMC 2108984. PMID 4348786. doi:10.1083/jcb.57.2.315.
- ↑ Miller, T. M.; Heuser, J. E. (1984). "Endocytosis of synaptic vesicle membrane at the frog neuromuscular junction". The Journal of Cell Biology 98 (2): 685–698. PMC 2113115. PMID 6607255. doi:10.1083/jcb.98.2.685.
- ↑ Ryan, T. A.; Smith, S. J.; Reuter, H. (1996). "The timing of synaptic vesicle endocytosis". Proceedings of the National Academy of Sciences of the United States of America 93 (11): 5567–5571. Bibcode:1996PNAS...93.5567R. PMC 39287. PMID 8643616. doi:10.1073/pnas.93.11.5567.
- ↑ Xu, H.; Zick, M.; Wickner, W. T.; Jun, Y. (2011). "A lipid-anchored SNARE supports membrane fusion". Proceedings of the National Academy of Sciences 108 (42): 17325–17330. Bibcode:2011PNAS..10817325X. PMC 3198343. PMID 21987819. doi:10.1073/pnas.1113888108.
- ↑ Foran, P. G.; Mohammed, N.; Lisk, G. O.; Nagwaney, S.; Lawrence, G. W.; Johnson, E.; Smith, L.; Aoki, K. R.; Dolly, J. O. (2002). "Evaluation of the Therapeutic Usefulness of Botulinum Neurotoxin B, C1, E, and F Compared with the Long Lasting Type A. BASIS FOR DISTINCT DURATIONS OF INHIBITION OF EXOCYTOSIS IN CENTRAL NEURONS". Journal of Biological Chemistry 278 (2): 1363–1371. PMID 12381720. doi:10.1074/jbc.M209821200.
- ↑ 23,0 23,1 Harata, N. C.; Aravanis, A. M.; Tsien, R. W. (2006). "Kiss-and-run and full-collapse fusion as modes of exo-endocytosis in neurosecretion". Journal of Neurochemistry 97 (6): 1546–1570. PMID 16805768. doi:10.1111/j.1471-4159.2006.03987.x.
- ↑ Alvarez De Toledo, G.; Alés, E.; Tabares, L. A.; Poyato, J. M.; Valero, V.; Lindau, M. (1999). "High calcium concentrations shift the mode of exocytosis to the kiss-and-run mechanism". Nature Cell Biology 1 (1): 40–44. PMID 10559862. doi:10.1038/9012.
- ↑ Zhang, Q.; Li, Y.; Tsien, R. W. (2009). "The Dynamic Control of Kiss-And-Run and Vesicular Reuse Probed with Single Nanoparticles". Science 323 (5920): 1448–1453. Bibcode:2009Sci...323.1448Z. PMC 2696197. PMID 19213879. doi:10.1126/science.1167373.
- ↑ Palay, Sanford L.; Palade, George E. (1954). "Electron microscope study of the cytoplasm of neurons". The Anatomical Record (Oral presentation) 118: 336. doi:10.1002/ar.1091180211.
- ↑ Eduardo D. P., De Robertis; Stanley, Bennett, H. (January 25, 1955). "Some Features of the Submicroscopic Morphology of Synapses in Frog and Earthworm". The Journal of Biophysical and Biochemical Cytology 1 (1): 47–58. JSTOR 1602913. PMC 2223594. PMID 14381427.
- ↑ De Robertis EDP, Bennett HS (1954). "Submicroscopic vesicular component in the synapse". Fed Proc 13: 35.
- ↑ Fatt, P.; Katz, B. (7 October 1950). "Some Observations on Biological Noise". Nature 166 (4223): 597–598. Bibcode:1950Natur.166..597F. PMID 14780165. doi:10.1038/166597a0.
- ↑ Fatt, P.; Katz, B. (May 28, 1952). "Spontaneous subthreshold activity at motor nerve endings" (PDF). The Journal of Physiology 117 (1): 109–128. PMC 1392564. PMID 14946732. doi:10.1113/jphysiol.1952.sp004735 (inactivo 2018-08-18). Arquivado dende o orixinal (PDF) o 02 de febreiro de 2014. Consultado o 1 February 2014.
- ↑ Del Castillo JB, Katz B (1954). "Quantal components of the endplate potential". J. Physiol. 124 (3): 560–573. PMC 1366292. PMID 13175199. doi:10.1113/jphysiol.1954.sp005129.
- ↑ Del Castillo JB, Katz B (1954). "Biophysical aspects of neuromuscular transmission". Prog Biophys Biophys Chem 6: 121–170. PMID 13420190.
- ↑ Gray EG, Whittaker VP (1962). "The isolation of nerve endings from brain: an electron microscopic study of cell fragments derived from homogenization and centrifugation". J Anat 96: 79–88. PMC 1244174. PMID 13901297.
- ↑ Whittaker VP, Michaelson IA, Kirkland RJ (1963). "The separation of synaptic vesicles from disrupted nerve ending particles". Biochem Pharmacol 12 (2): 300–302. PMID 14000416.
- ↑ Whittaker VP, Michaelson IA, Kirkland RJ (1964). "The separation of synaptic vesicles from nerve ending particles ('synaptosomes')". Biochem J 90 (2): 293–303. PMC 1202615. PMID 5834239. doi:10.1016/0006-2952(63)90156-4.
- ↑ De Robertis E, Rodriguez de Lores Arnaiz G, Salganicoff GL, Pellegrino de Iraldi A, Zieher LM (1963). "Isolation of synaptic vesicles and structural organization of the acetylcholine system within brain nerve endings". J Neurochem 10 (4): 225–235. doi:10.1111/j.1471-4159.1963.tb05038.x.
- ↑ Whittaker VP, Sheridan MN (1965). "The morphology and acetylcholine content of isolated cerebral cortical synaptic vesicles". J Neurochem 12 (5): 363–372. PMID 14333293. doi:10.1111/j.1471-4159.1965.tb04237.x.
- ↑ Wilson WS, Schulz RA, Cooper JR (1973). "The isolation of cholinergic synaptic vesicles from bovine superior cervical ganglion and estimation of their acetylcholine content". J Neurochem 20 (3): 659–667. PMID 4574192. doi:10.1111/j.1471-4159.1973.tb00026.x.
- ↑ Jones DG (1970). "The isolation of synaptic vesicles from Octopus brain". Brain Res 17 (2): 181–193. PMID 5412681. doi:10.1016/0006-8993(70)90077-6.
- ↑ Israël M, Gautron J, Lesbats B (1970). "Subcellular fractionation of the electric organ of Torpedo marmorata". J Neurochem 17 (10): 1441–1450. PMID 5471906. doi:10.1111/j.1471-4159.1970.tb00511.x.
- ↑ Whittaker VP, Essman WB, Dowe GH (1972). "The isolation of pure cholinergic synaptic vesicles from the electric organs of elasmobranch fish of the family Torpidinidae". Biochem J 128: 833–846.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]| Commons ten máis contidos multimedia sobre: Vesícula sináptica |