Chlamydomonas reinhardtii
| Chlamydomonas reinhardtii | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Rendszertani besorolás | ||||||||||||||||
| ||||||||||||||||
| Tudományos név | ||||||||||||||||
| Chlamydomonas reinhardtii P. A. Dang., 1888 | ||||||||||||||||
| Hivatkozások | ||||||||||||||||
A Wikifajok tartalmaz Chlamydomonas reinhardtii témájú rendszertani információt. A Wikimédia Commons tartalmaz Chlamydomonas reinhardtii témájú kategóriát. |
A Chlamydomonas reinhardtii két ostorával úszó mintegy 10 μm átmérőjű egysejtű valódi zöldmoszat. Sejtfalát hidroxiprolin-gazdag glikoproteinekből építi, továbbá nagy pohár alakú kloroplasztisza, nagy pirenoidja és szemfoltja van.
A Chlamydomonas-fajok világszerte elterjedtek a talajban és a C. reinhardtii az egyik leggyakoribb és a legelterjedtebb.[1] Jól tanulmányozott modellszervezet részben könnyű tenyészthetősége és a genommódosítás könnyűsége miatt. Fény hatására fotoautotróf módon nőhet, de sötétben is élhet szerves vegyületek mellett. A kereskedelemben a biogyógyszerek és -üzemanyag előállításában használatos, de kutatják a hidrogén-előállításban is.
2014-ben a Német Botanikai Társaság az Év Algájának választotta.[2]
Történet
[szerkesztés]A C. reinhardtii vad típusú c137 laboratóriumi törzsét (mt+) Amherst közelében Gilbert M. Smith gyűjtötte 1945-ben.[3][4]
A fajnevet különbözőképp írták a név eltérő orosz átírásai miatt: a reinhardi, reinhardii és a reinhardtii is a C. reinhardtii Dangeard fajra utal.[5]
Leírás
[szerkesztés]Sejtjei többnyire gömbölyűek, de lehetnek ellipszoidok, ovoidok, obovoidok vagy aszimmetrikusak. 10–22 μm hosszúak és 8–22 μm szélesek. Sejtfaluk vékony és papilla nélküli, ostoraik hossza a sejttestének 1,5–2-szerese. Alul 1 pohár alakú kloroplasztiszuk van egy alapi helyzetű pirenoiddal.[1]
Szemfolt
[szerkesztés]Szemfoltja a páncélos ostorosokéhoz hasonló.[6] A szemfolt a sejt hosszanti tengelye közelében van, és karotinoidgazdag fényvisszaverő szemcserétegből áll a kloroplasztiszban.[7] Fő funkciója az ostorok fénystimulussal kapcsolatos mozgásából álló fototaxis.[8] Ez fontos a zöldmoszatnak, és lehetővé teszi a fotoszintézishez megfelelően világos környezet elhelyezését.[9] Ez a fényintenzitástól függően lehet pozitív vagy negatív.[6] A fototaktikus út 4 lépésből áll, melyek a két ostor (a szemfolthoz közelebbi cisz- és a távolabbi transz-ostor) verésének egyensúlyát befolyásolják.[8]
Modellszervezetként
[szerkesztés]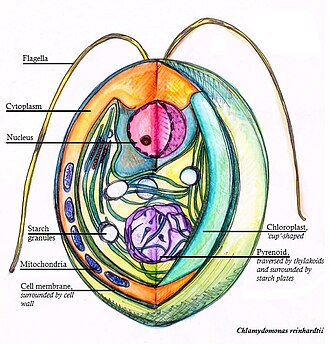
A C. reinhardtii a sejt- és molekuláris biológia alapvető kérdéseinek, például a citokinezis, a fototaxis, a sejtfelismerés, a szabályos ismétlődő ostormozdulatok, a proteomszabályzással történő ostorhossz-szabályzás és az ásványitápanyag-mennyiség megváltozására való válaszok módjának kiderítéséhez használt modellszervezet.
Számos ismert mutánsa van, ezek hasznosak számos biológiai folyamat, például az ostormozgás, a fotoszintézis és a fehérjeszintézis vizsgálatában. A Chlamydomonas-fajok általában haploidok, így a hatások további keresztezés nélkül láthatók.
2007-ben közölték teljes magi genomját.[10]
A fénykapus kationcsatornákként működő csatornarodopszin-1-et és -2-t először a C. reinhardtiiból izolálták.[11][12] Ezeket és hasonló fehérjéket egyre gyakrabban használják az optogenetika területén.[13]
Mitokondriális jelentőség
[szerkesztés]A C. reinhardtii genomja fontos a mitokondriumok tanulmányozásában, mivel a mitokondriumokhoz kódolt 13 fehérjéből 6 génjei a sejtmagban vannak, 7-éi a mitokondriumban.[14] A Chlorophyceae osztályon kívüli fajokban e gének csak a mitokondriumokban vannak jelen, és nem expresszálhatók allotópan. Ez fontos a genetikai mitokondriális betegségek terápiájának fejlesztésében.
Szaporodás
[szerkesztés]Vegetatív sejtjei haploidak 17 kis kromoszómával. Nitrogénhiány esetén haploid ivarsejtekké alakulnak.[15] Két azonos megjelenésű ivarsejttípus van, így izogám, ezek az mt(+) és az mt(–), ezek diploid zigótává egyesülhetnek. A zigóta nem rendelkezik ostorral, és a faj talajlakó nyugalmi formája. Fény hatására meiózison megy át, és 4 ostoros haploid sejtet bocsát ki, melyek folytatják a vegetatív életciklust.
Ideális körülmények közt a sejtek 2–3 mitózison eshetnek át, mielőtt az utódsejtek az előző sejtfalból kikerülnek, így egy növekedési lépés 4 vagy 8 leánysejtet adhat anyasejtenként.
Sejtciklusa váltakozó fény-sötétség időszakokkal szinkronizálható. Növekedési fázisa fényfüggő, de egy átmeneti ponton túl a folyamatok fényfüggetlenek.[16]
Genetika
[szerkesztés]Modellszervezetként való használata nőtt számos genomikai erőforrás kiadásával. A magi genom az Amerikai Egyesült Államok Energiaügyi Minisztériuma Genomintézete által összeállított Chlre3 vázlata 1557, összesen 120 Mbp hosszú scaffoldból áll. Ennek felét legalább 24, egyenként 1,6 Mbp hosszú tartalmazza. A genom az interneten elérhető.[17]
A 15,8 kbp körüli mitokondriális genom NC_001638,[18] a 203,8 kbp körüli kloroplasztiszgenom NC_005353 azonosítóval érhető el az NCBI adatbázisában.[19][20]
A genomszekvencia-adatok mellett sok cDNS-könyvtárként vagy expresszált szekvenciajelölőként elérhető expressziószekvencia-adat is létezik. 7 cDNS-könyvtár érhető el interneten.[21] Egy BAC-könyvtár a Clemson Egyetem Genomikai Intézetétől megvásárolható.[22] Van egy több mint 50 000[23] és egy több mint 160 000 EST-s internetes könyvtár is.[24]
Egy egész genomra kiterjedő, a legtöbb magi gént lefedő inzertációhelyekkel rendelkező mutánskészlet is elérhető a chlamylibrary.org oldalon.[25][26]
Genomja N6-metiladenozint (m6A) tartalmaz, ez prokariótákban gyakori, eukariótákban ritka.[27] Egyes kutatások szerint helyük a nukleoszómahelyekben fontos, mert a nukleoszómák közti kapcsolóhelyekben és az aktívan átírt gének transzkripciója kezdete helyein vannak.[28]
Több DNS-javítási folyamatra képes lehet.[29] Ilyenek például a homológ rekombináció, a száltörésjavítás és az eltávolításos javítás. A kloroplasztisz kettősszál-töréseket hatékonyan javító rendszerrel rendelkezik.[30] A homológ rekombinációt a kettősszál-törések stimulálják.[30]
Evolúciós kísérletek
[szerkesztés]Az evolúciós biológia és ökológia különböző szempontjai tanulmányozására használják rövid nemzedékei, autotróf és fakultatív heterotróf életmódja, ivaros és ivartalan szaporodásra való képessége és az elérhető genetikai információk miatt.
Néhány vizsgált kérdés például az ivaros szaporodás evolúciója,[31] a mutációk hatása a rátermettségre[32] és az adaptáció különböző CO2-szintekhez.[33]
Egy hipotézis szerint[34] az ivaros szaporodás az ivartalannal szemben aktívan fennmarad a jó környezetekben, mert a mutációs terhet a különböző ágakból való mutációkombináció révén csökkenti, növelve az átlagos rátermettséget. Azonban a C. reinhardtii hosszú távú kísérleti kutatása ennek ellentmondott: az ivarosan szaporodó egyedekben nem volt mutációs tisztulás, és nem nőtt a rátermettség.[35]
Többsejtű palmelloid kolóniákat alkothat, és egyes kutatások szerint az egy- és többsejtű állapot váltakozhat.[36]
Mozgás
[szerkesztés]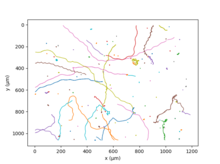
A C. reinhardtii két ostora révén[37] az emberi mellúszáshoz hasonlóan úszik. E mozgást másodpercenként 50-szer ismételve átlagsebessége 70 μm/s;[38] a különböző törzsek genetikai diverzitása miatt széles a sebességtartomány. Néhány másodperc után a két ostor aszinkron verése véletlenszerű irányváltozást okoz, ez a „run and tumble”.[37] Hosszabb időben és nagyobb térben e véletlen mozgás aktív diffúzióként írható le.[39]
DNS-transzformáció
[szerkesztés]A géntranszformáció a kloroplasztiszban főleg homológ, míg a magban főleg heterológ rekombinációval történik. A C. reinhardtii kloroplasztiszgenomja mikrorészecske-bombázással vagy üveggyöngymódszerrel transzformálható, ez utóbbi módszer sokkal kevésbé hatékony. A magi genomot üveggyöngymódszerrel és elektroporációval is transzformálták. A biolisztikus folyamat a ptDNS-be való DNS-juttatás leghatékonyabb módja, feltehetően mert a plasztisz a sejt felét elfoglalja, nagy célpontot adva a kis részecskének. Az elektroporáció a leghatékonyabb ismert mód a DNS magi genomba juttatására, maximális transzformációs frekvenciái az üveggyöngymódszeréinél 100-szor nagyobbak.[40]
Gyakorlati használat
[szerkesztés]Biogyógyszer-termelés
[szerkesztés]Genetikailag módosított C. reinhardtii használható emlősszérum-amiloid,[41] humán antitest, humán érendotélium-növekedési faktor, lehetséges terápiás humán papillomavírus 16-oltás,[42] lehetséges maláriaoltás (ehetőalga-oltás)[43] és rák ellen használható összetett gyógyszer készítésére.[44]
Alternatív fehérjeforrás
[szerkesztés]A C. reinhardtii új algaalapú tápanyagforrás lehet. A Chlorella és Spirulina fajainál több α-linolénsavat és kevesebb nehézfémet tartalmaz, minden esszenciális aminosav jelen van benne, fehérjetartalmuk hasonló.[45] A Triton Algae Innovations alternatív fehérjeforrást fejlesztett a C. reinhardtiiból.
Hidrogéntermelés
[szerkesztés]1939-ben a Chicagói Egyetemen dolgozó német Hans Gaffron felfedezte az egysejtű zöldmoszatok hidrogén-anyagcseréjét. A C. reinhardtii és néhány más zöldmoszat bizonyos körülmények közt képes leállítani az oxigén- és elindítani a hidrogéntermelést. E csak oxigénhiány mellett működő hidrogenázzal történő reakció rövid életű. A következő 30 évben Gaffron et al. a fotoszintetikus hidrogéntermelés alapjait dolgozták ki.[46]
A hidrogéntermelés növeléséhez az alábbi utakat követték kutatók:
- Az első a hidrogenáz leválasztása a fotoszintézisről. Így az oxigénszint-növekedés nem tudja a hidrogéntermelést gátolni. A hidrogenáz szerkezete megváltoztatásával érzéketlenné tehető az oxigénre, lehetővé téve a folyamatos hidrogéntermelést. Ez esetben az elektronáramlás nem a cukortermelésből származik, hanem a saját keményítő bontásából.[47]
- A második a fotoszintézis a hidrogenáz genetikai módosításával való leállítása. Ez megakadályozza a hidrogéntermelés oxigénkoncentráció-emelkedés miatti leállását.[48]
- A harmadik, melyet elsősorban az 1950-es években vizsgáltak, az algák fotoszintézise által termelt oxigén kémiai vagy mechanikai eltávolítása például oxigéneltávolító anyagokkal vagy további redukálószerekkel, vagy az inert gázokkal való tenyészettisztítás.[49] Ezek azonban nem skálázhatók, és nem alkalmazhatók az alkalmazott rendszerekben. Az újabb kutatások azonban e módszert skálázhatóvá tehették új oxigéneltávolítási módokkal.
- A negyedik a hidrogenáz oxigéntermeléstől való elkülönítése rézsókkal.[50]
- Az ötödik a fotoszintetikus elektronáramlás a Calvin-ciklusban való CO2-kötésről a hidrogenázra való átirányítása rövid fényimpulzusok anaerob algákra való irányításával[51] vagy a CO2-szint csökkentésével.[52]
Jegyzetek
[szerkesztés]- ↑ a b Ettl, H.. Chlorophyta. 1. Teil / Part 1: Phytomonadina, Süßwasserflora von Mitteleuropa. VEB Gustav Fischer Verlag, XIV + 808. o. (1983). ISBN 978-3-8274-2659-8
- ↑ Alge des Jahres 2014: Chlamydomonas reinhardtii – schneller Schwimmer steht Modell. Sektion Phykologie der DBG. [2016. március 4-i dátummal az eredetiből archiválva].
- ↑ CC-125 wild type mt+ 137c. Chlamydomonas Center core collection list. [2009. július 27-i dátummal az eredetiből archiválva]. (Hozzáférés: 2009. március 9.)
- ↑ The Chlamydomonas Sourcebook. ISBN 978-0-12-370873-1)
- ↑ Chlamydomonas Taxonomy
- ↑ a b Ueki, Noriko (2016). „Eyespot-dependent determination of the phototactic sign in Chlamydomonas reinhardtii”. Proceedings of the National Academy of Sciences 113 (19), 5299–5304. o. DOI:10.1073/pnas.1525538113. PMID 27122315. PMC 4868408.
- ↑ Foster KW, Smyth RD (1980). „Light Antennas in phototactic algae”. Microbiological reviews 44 (4), 572–630. o.
- ↑ a b Hegemann P, Berthold P.szerk.: Stern D, Witman G: Sensory photoreceptors and light control of flagellar activity, The Chlamydomonas Sourcebook, 2., Oxford: Academic, 395–430. o. (2009). ISBN 9780123708731
- ↑ Demmig-Adams, B. (1992). „Photoprotection and Other Responses of Plants to High Light Stress”. Annual Review of Plant Physiology and Plant Molecular Biology 43, 599–626. o. DOI:10.1146/annurev.pp.43.060192.003123.
- ↑ Merchant SS, Prochnik SE, Vallon O, Harris EH, Karpowicz SJ, Witman GB, Terry A, Salamov A, Fritz-Laylin LK, Marechal-Drouard L, Marshall WF, Qu L-H, Nelson DR, Sanderfoot AA, Spalding MH, Kapitonov VV, Ren Q, Ferris P, Lindquist E, Shapiro H, Lucas SM, Grimwood J, Schmutz J, Cardol P, Cerutti H, Chanfreau G, Chen C-L, Cognat V, Croft MT, Dent R (2007). „The Chlamydomonas Genome Reveals the Evolution of Key Animal and Plant Functions”. Science 318 (5848), 245–250. o. DOI:10.1126/science.1143609. PMID 17932292. PMC 2875087.
- ↑ Nagel G, Ollig D, Fuhrmann M (2002. június 28.). „Channelrhodopsin-1: a light-gated proton channel in green algae”. Science 296 (5577), 2395–2398. o. DOI:10.1126/science.1072068. PMID 12089443.
- ↑ Lagali PS, Balya D, Awatramani GB, Münch TA, Kim DS, Busskamp V, Cepko CL, Roska B (2008. június 1.). „Light-activated channels targeted to ON bipolar cells restore visual function in retinal degeneration”. Nature Neuroscience 11 (6), 667–675. o. DOI:10.1038/nn.2117. PMID 18432197.
- ↑ Boyden ES (2011. május 3.). „A history of optogenetics: the development of tools for controlling brain circuits with light”. F1000 Biology Reports 3 (11), 11. o. DOI:10.3410/B3-11. PMID 21876722. PMC 3155186.
- ↑ Figueroa-Martínez F, Funes S, Franzén LG, González-Halphen D (2008. május 1.). „Reconstructing the mitochondrial protein import machinery of Chlamydomonas reinhardtii”. Genetics 179 (1), 149–155. o. DOI:10.1534/genetics.108.087965. PMID 18493047. PMC 2390594.
- ↑ Sager R, Granick S (1954. július 1.). „Nutritional control of sexuality in Chlamydomonas reinhardi”. J. Gen. Physiol. 37 (6), 729–742. o. DOI:10.1085/jgp.37.6.729. PMID 13174779. PMC 2147466.
- ↑ Oldenhof H, Zachleder V, den Ende H (2006). „Blue- and red-light regulation of the cell cycle in Chlamydomonas reinhardtii (Chlorophyta)”. Eur. J. Phycol. 41 (3), 313–320. o. DOI:10.1080/09670260600699920.
- ↑ Home - Chlamydomonas reinhardtii v3.0
- ↑ (2010. február 1.) „Chlamydomonas reinhardtii mitochondrion, complete genome”.
- ↑ (2004. január 23.) „Chlamydomonas reinhardtii chloroplast, complete genome”.
- ↑ Chlamydomonas Chloroplast Genome Portal
- ↑ Chlamydomonas Center - Libraries. [2004. október 19-i dátummal az eredetiből archiválva]. (Hozzáférés: 2006. szeptember 28.)
- ↑ CUGI. [2014. december 26-i dátummal az eredetiből archiválva]. (Hozzáférés: 2006. április 3.)
- ↑ [KDRIChlamydomonas reinhardtii EST index]
- ↑ Search. [2005. február 4-i dátummal az eredetiből archiválva]. (Hozzáférés: 2006. szeptember 28.)
- ↑ Li, Xiaobo (2016. február 1.). „An Indexed, Mapped Mutant Library Enables Reverse Genetics Studies of Biological Processes in Chlamydomonas reinhardtii” (angol nyelven). The Plant Cell 28 (2), 367–387. o. DOI:10.1105/tpc.15.00465. ISSN 1040-4651. PMID 26764374. PMC 4790863.
- ↑ (2019. április 1.) „A genome-wide algal mutant library and functional screen identifies genes required for eukaryotic photosynthesis” (angol nyelven). Nature Genetics 51 (4), 627–635. o. DOI:10.1038/s41588-019-0370-6. ISSN 1546-1718. PMID 30886426. PMC 6636631.
- ↑ Hattman S, Kenny C, Berger L, Pratt K (1978. szeptember 1.). „Comparative study of DNA methylation in three unicellular eucaryotes”. Journal of Bacteriology 135 (3), 1156–1157. o. DOI:10.1128/JB.135.3.1156-1157.1978. PMID 99431. PMC 222496.
- ↑ Fu Y, Luo G-Z, Chen K, Deng X, Yu M, Han D, Hao Z, Liu J, Lu X, Doré LC, Weng X, Ji Q, Mets L, He C (2015. május 1.). „N6-Methyldeoxyadenosine Marks Active Transcription Start Sites in Chlamydomonas”. Cell 161 (4), 879–892. o. DOI:10.1016/j.cell.2015.04.010. PMID 25936837. PMC 4427561.
- ↑ Vlcek D, Sevcovicová A, Sviezená B, Gálová E, Miadoková E (2007. november 9.). „Chlamydomonas reinhardtii: a convenient model system for the study of DNA repair in photoautotrophic eukaryotes”. Curr Genet 53 (1), 1–22. o. DOI:10.1007/s00294-007-0163-9. PMID 17992532.
- ↑ a b Dürrenberger F, Thompson AJ, Herrin DL, Rochaix JD (1996. szeptember 1.). „Double strand break-induced recombination in Chlamydomonas reinhardtii chloroplasts”. Nucleic Acids Res 24 (17), 3323–3331. o. DOI:10.1093/nar/24.17.3323. PMID 8811085. PMC 146090.
- ↑ Colegrave N (2002). „Sex releases the speed limit on evolution”. Nature 420 (6916), 664–666. o. DOI:10.1038/nature01191. PMID 12478292.
- ↑ De Visser et al (1996). „The effect of sex and deleterious mutations on fitness in Chlamydomonas”. Proc R Soc Lond B 263, 193–200. o.
- ↑ Collins S, Bell G (2004). „Phenotypic consequences of 1,000 generations of selection at elevated CO2 in a green alga”. Nature 431 (7008), 566–569. o. DOI:10.1038/nature02945. PMID 15457260.
- ↑ Kondrashov AS (1984. október 1.). „Deleterious mutations as an evolutionary factor”. Genet. Res. 44 (2), 199–217. o. DOI:10.1017/s0016672300026392. PMID 6510714.
- ↑ Renaut S, Replansky T, Heppleston A, Bell G (2006. november 1.). „The ecology and genetics of fitness in Chlamydomonas”. Evolution 60 (11), 2272–9. o. DOI:10.1554/06-084.1. PMID 17236420.
- ↑ Herron MD, Borin JM, Boswell JC, Walker J, Chen I-CK, Knox CA, Boyd M, Rosenzweig F, Ratcliff WC. „De novo origins of multicellularity in response to predation”. Sci Rep 9, 2328. o. DOI:10.1038/s41598-019-39558-8. PMID 30787483. PMC 6382799. (Hozzáférés: 2024. július 30.)
- ↑ a b Polin, Marco (2009. július 24.). „Chlamydomonas Swims with Two "Gears" in a Eukaryotic Version of Run-and-Tumble Locomotion” (angol nyelven). Science 325 (5939), 487–490. o. DOI:10.1126/science.1172667. ISSN 0036-8075. PMID 19628868.
- ↑ Garcia, Michaël (2013-07-09), Hydrodynamique de micro-nageurs, Université de Grenoble, <https://tel.archives-ouvertes.fr/tel-00952771>
- ↑ Goldstein, Raymond E (2018. július 23.). „Are theoretical results 'Results'?”. eLife 7, e40018. o. DOI:10.7554/eLife.40018. ISSN 2050-084X. PMID 30033910. PMC 6056240.
- ↑ Shimogawara K, Fujiwara S, Grossman A, Usuda H (1998. április). „High-Efficiency Transformation of Chlamydomonas reinhardtii by Electroporation”. Genetics 148, 1821–1828. o. (Hozzáférés: 2024. július 30.)
- ↑ Manuell AL, Beligni MV, Elder JH, Siefker DT, Tran M, Weber A, McDonald TL, Mayfield SP (2007. március 15.). „Robust expression of a bioactive mammalian protein in Chlamydomonas chloroplast”. Plant Biotechnol J 5 (3), 402–412. o. DOI:10.1111/j.1467-7652.2007.00249.x. PMID 17359495. (Hozzáférés: 2024. július 30.)
- ↑ Demurtas OC, Massa S, Ferrante P, Venuti A, Franconi R et al. (2013). „A Chlamydomonas-Derived Human Papillomavirus 16 E7 Vaccine Induces Specific Tumor Protection”. PLoS One 8 (4), e61473. o. DOI:10.1371/journal.pone.0061473. PMID 23626690. PMC 3634004.
- ↑ Biologists produce potential malarial vaccine from algae. PhysOrg, 2012. május 16. (Hozzáférés: 2013. április 15.)
- ↑ Engineering algae to make complex anti-cancer 'designer' drug. PhysOrg, 2012. december 10. (Hozzáférés: 2013. április 15.)
- ↑ Darwish, Randa (2020. szeptember 26.). „Chlamydomonas reinhardtii Is a Potential Food Supplement with the Capacity to Outperform Chlorella and Spirulina”. Applied Sciences 10 (19), 6736. o. DOI:10.3390/app10196736. (Hozzáférés: 2021. augusztus 26.)
- ↑ Melis A, Happe T (2004). „Trails of green alga hydrogen research – from Hans Gaffron to new frontiers”. Photosynthesis Research 80 (1–3), 401–409. o. DOI:10.1023/B:PRES.0000030421.31730.cb. PMID 16328836.
- ↑ Cournac L, Musa F, Bernarda L, Guedeneya G, Vignaisb P, Peltie G (2002). „Limiting steps of hydrogen production in Chlamydomonas reinhardtii and Synechocystis PCC 6803 as analysed by light-induced gas exchange transients”. International Journal of Hydrogen Energy 27 (11/12), 1229–1237. o. DOI:10.1016/S0360-3199(02)00105-2.
- ↑ Melis A: Hydrogen and hydrocarbon biofuels production via microalgal photosynthesis. [2008. április 3-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. április 7.)
- ↑ Kosourov S, Tsyganov A, Seibert M, Ghirardi M (2002. június 1.). „Sustained Hydrogen Photoproduction by Chlamydomonas reinhardtii: Effects of Culture Parameters”. Biotechnol. Bioeng. 78 (7), 731–40. o. DOI:10.1002/bit.10254. PMID 12001165.
- ↑ Fernandez VM, Rua ML, Reyes P, Cammack R, Hatchikian EC (1989. november 1.). „Inhibition of Desulfovibrio gigas hydrogenase with copper salts and other metal ions”. Eur. J. Biochem. 185 (2), 449–454. o. DOI:10.1111/j.1432-1033.1989.tb15135.x. PMID 2555191.
- ↑ Kosourov S, Jokel M, Aro E-M, Allahverdiyeva Y (2018. március 1.). „A new approach for sustained and efficient H2 photoproduction by Chlamydomonas reinhardtii”. Energy & Environmental Science 11 (6), 1431–1436. o. DOI:10.1039/C8EE00054A.
- ↑ Nagy V, Podmaniczki A, Vidal-Meireles A, Tengölics R, Kovács L, Rákhely G, Scoma A, Tóth Sz (2018. március 1.). „Water-splitting-based, sustainable and efficient H2 production in green algae as achieved by substrate limitation of the Calvin–Benson–Bassham cycle”. Biotechnology for Biofuels 11, 69. o. DOI:10.1186/s13068-018-1069-0. PMID 29560024. PMC 5858145.
Források
[szerkesztés]- Aoyama H, Kuroiwa T, Nakamura S (2009). „The dynamic behaviour of mitochondria in living zygotes during maturation and meiosis in Chlamydomonas reinhardtii”. Eur J Phycol 44, 497–507. o. DOI:10.1080/09670260903272599.
- Jamers A, Lenjou M, Deraedt P, van Bockstaele D, Blust R, de Coen W (2009). „Flow cytometric analysis of the cadmium-exposed green algae Chlamydomonas reinhadtii (Chlorophyceae)”. Eur J Phycol 44, 541–550. o. DOI:10.1080/09670260903118214.
További információk
[szerkesztés]- The Chlamydomonas Resource Center – központi tárhely magas minőségű és megbízható Chlamydomonas reinhardtii-tenyészetek, valamint hasznos molekuláris reagensek és készletek katalogizálására, megőrzésére és szállítására
- Plant Comparative Genomics portal - információk a Chlamydomonas reinhardtiiról a JGI-től
- Guiry, M. D.: Chlamydomonas reinhardtii. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway
- Chlamydomonas reinhardtii cell, life cycle, strains, mating types - archivált adatbázis

