Pirén
| Pirén | |||
| |||

| |||

| |||
| Más nevek | Benzo[def]fenantrén | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 129-00-0 | ||
| PubChem | 31423 | ||
| ChemSpider | 29153 | ||
| KEGG | C14335 | ||
| ChEBI | 39106 | ||
| RTECS szám | UR2450000 | ||
| |||
| |||
| InChIKey | BBEAQIROQSPTKN-UHFFFAOYSA-N | ||
| Beilstein | 1307225 | ||
| Gmelin | 84203 | ||
| UNII | 9E0T7WFW93 | ||
| ChEMBL | 279564 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C16H10 | ||
| Moláris tömeg | 202,25 g/mol | ||
| Megjelenés | színtelen szilárd anyag (sárga szennyeződések gyakoriak sok mintában) | ||
| Sűrűség | 1,271 g/cm3[2] | ||
| Olvadáspont | 150,62 °C | ||
| Forráspont | 394 °C | ||
| Oldhatóság (vízben) | 0,049 mg/l (0 °C) 0,139 mg/l (25 °C) 2,31 mg/l (75 °C)[3] | ||
| Tiltott sáv | 2.02 eV[6] | ||
| Mágneses szuszceptibilitás | -147·10−6 cm3/mol[4] | ||
| Megoszlási hányados | 5.08[5] | ||
| Kristályszerkezet | |||
| Kristályszerkezet | Monoklin | ||
| Tércsoport | P21/a | ||
| Rácsállandó | a = 13,64 Å, b = 9,25 Å, c = 8,47 Å | ||
| Rácsállandó-szög | α = 90°, β = 100,28°, γ = 90° | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
125,5 kJ·mol−1 | ||
| Standard moláris entrópia S |
224,9 J·mol−1·K−1 | ||
| Hőkapacitás, C | 229,7 J/(K·mol) | ||
| Veszélyek | |||
| Főbb veszélyek | irritáló | ||
| NFPA 704 | |||
| Lobbanáspont | nem gyúlékony | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
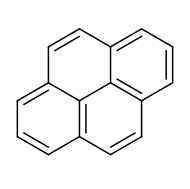
A pirén lapos policiklusos aromás szénhidrogén (PAH) 4 kondenzált benzolgyűrűvel. Képlete C16H10. E sárgászöld szilárd anyag a legkisebb perikondenzált (1-nél több oldalon kondenzált gyűrűs) PAH. A pirén szerves vegyületek részleges égésekor keletkezik.[10]
Előfordulás, tulajdonságok
[szerkesztés]A pirént először kőszénkátrányból izolálták, ahol 2 tömegszázalékig fordul elő. Perikondenzált PAH-ként sokkal jobban rezonanciastabilizált az 5 tagú gyűrűs izomerjénél, a fluoranténnél. Így sok égés mellékterméke. Az autók átlagosan mintegy 1 μg-ot termelnek kilométerenként.[11]
Reakciók
[szerkesztés]Kromáttal való oxidációjakor perinaftenon, majd naftalin-1,4,5,8-tetrakarbonsav keletkezik. Számos hidrogénezésre képes, és eltérő szelektivitással hajlamos halogénezésre, Diels–Alder-reakciókra és nitrálásra.[11] Az egyik 3-as szénatomon brómozható.[12]
Nátriummal redukálva gyökaniont ad. Ebből sok π-arénkomplex állítható elő.[13]
Fotofizika
[szerkesztés]Pirénből és származékaiból festékek és festékprekurzorok, például piranin és naftalin-1,4,5,8-tetrakarbonsav állíthatók elő. Erős UV-Vis-abszorpciója van három 330 nm-nél lévő sávnál diklórmetánban. Az emisszió az abszorpcióhoz közel van, de 375 nm-nél.[14] A jelek oldószerenként eltérnek. Származékaik is hasznos molekuláris indikátorok fluoreszcenciaspektroszkópiához, nagy kvantumhozamuk és hosszú életük (0,65, illetve 410 ns etanolban 293 K-en). A pirén volt az első molekula, melynél excimereket figyeltek meg.[15] Ez az excimer 450 nm-nél jelenik meg. Theodor Förster számolt be róla 1954-ben.[16]
Alkalmazások
[szerkesztés]A pirén fluoreszcencia-emissziós spektruma érzékeny az oldószer polaritására, így a pirén használható oldószerkörnyezetek meghatározására, mivel a gerjesztett állapota az alapállapottal szemben nem síkalkatú. Egyes emissziós sávok érintetlenek, mások intenzitása eltér az oldószerrel való kölcsönhatás ereje miatt.

A pirének erős elektrondonorok, és számos anyaggal együtt elektrondonor-akceptor rendszert alkotnak, melyek energiaátalakításra és fényfelhasználásra használhatók.[14]
Biztonsági, környezeti tényezők
[szerkesztés]Bár nem benzopiréneknél kevésbé mérgező, állatkísérletek szerint a pirén mérgező a vesékre és a májra. A pirén a halak és az algák életműködéseit befolyásolja.[18][19][20][21]
Biológiai bomlását nagymértékben vizsgálták. Ez két CH=CH kötés hidroxilezésével kezdődik.[22] Sertéskísérletek alapján az 1-hidroxipirén a szájon át adott pirén metabolitja.[23]
Jegyzetek
[szerkesztés]- ↑ International Union of Pure and Applied Chemistry. Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Society of Chemistry, 206. o.. DOI: 10.1039/9781849733069 (2014). ISBN 978-0-85404-182-4
- ↑ a b c Haynes, p. 3.472
- ↑ Haynes, p. 5.162
- ↑ Haynes, p. 3.579
- ↑ Haynes, p. 5.176
- ↑ Haynes, p. 12.96
- ↑ Camerman, A. (1965). „The crystal and molecular structure of pyrene”. Acta Crystallographica 18 (4), 636–643. o. DOI:10.1107/S0365110X65001494.
- ↑ Haynes, pp. 5.34, 6.161
- ↑ GHS: PubChem
- ↑ Figueira-Duarte, Teresa M. (2011). „Pyrene-Based Materials for Organic Electronics”. Chemical Reviews 111 (11), 7260–7314. o. DOI:10.1021/cr100428a. PMID 21740071.
- ↑ a b Senkan, Selim; Castaldi, Marco. Combustion, Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH (2003)
- ↑ Gumprecht, W. H. (1968). „3-Bromopyrene”. Org. Synth. 48, 30. o. DOI:10.15227/orgsyn.048.0030.
- ↑ Kucera, Benjamin E. (2014). „Bis(pyrene)metal complexes of vanadium, niobium and titanium: Isolable homoleptic pyrene complexes of transition metals”. Acta Crystallographica Section C: Structural Chemistry 70 (8), 749–753. o. DOI:10.1107/S2053229614015290. PMID 25093352.
- ↑ a b Tagmatarchis, Nikos (2017. június 5.). „Functionalization of MoS2 with 1,2-dithiolanes: toward donor-acceptor nanohybrids for energy conversion” (angol nyelven). npj 2D Materials and Applications 1 (1), 13. o. DOI:10.1038/s41699-017-0012-8. ISSN 2397-7132.
- ↑ Van Dyke, David A. (1998. május 1.). „Nanosecond Time-Resolved Fluorescence Spectroscopy in the Physical Chemistry Laboratory: Formation of the Pyrene Excimer in Solution”. Journal of Chemical Education 75 (5), 615. o. DOI:10.1021/ed075p615.
- ↑ Förster, Th. (1954. június 1.). „Ein Konzentrationsumschlag der Fluoreszenz.”. Zeitschrift für Physikalische Chemie 1 (5–6), 275–277. o. DOI:10.1524/zpch.1954.1.5_6.275.
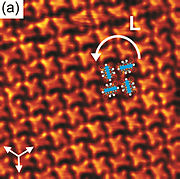
- ↑ Pham, Tuan Anh (2014). „Self-assembly of pyrene derivatives on Au(111): Substituent effects on intermolecular interactions”. Chem. Commun. 50 (91), 14089–92. o. DOI:10.1039/C4CC02753A. PMID 24905327.
- ↑ Oliveira, M. (2013). „Single and combined effects of microplastics and pyrene on juveniles (0+ group) of the common goby Pomatoschistus microps (Teleostei, Gobiidae)”. Ecological Indicators 34, 641–647. o. DOI:10.1016/j.ecolind.2013.06.019.
- ↑ Oliveira, M. (2012). „Acute toxic effects of pyrene on Pomatoschistus microps (Teleostei, Gobiidae): Mortality, biomarkers and swimming performance”. Ecological Indicators 19, 206–214. o. DOI:10.1016/j.ecolind.2011.08.006.
- ↑ Oliveira, M. (2012). „Effects of exposure to microplastics and PAHs on microalgae Rhodomonas baltica and Tetraselmis chuii”. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology 163, S19–S20. o. DOI:10.1016/j.cbpa.2012.05.062.
- ↑ Oliveira, M. (2012). „Effects of short-term exposure to microplastics and pyrene on Pomatoschistus microps (Teleostei, Gobiidae)”. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology 163, S20. o. DOI:10.1016/j.cbpa.2012.05.063.
- ↑ Seo, Jong-Su (2009). „Bacterial Degradation of Aromatic Compounds”. International Journal of Environmental Research and Public Health 6 (1), 278–309. o. DOI:10.3390/ijerph6010278. PMID 19440284. PMC 2672333.
- ↑ Keimig, S. D. (1983). „Identification of 1-hydroxypyrene as a major metabolite of pyrene in pig urine”. Xenobiotica 13 (7), 415–420. o. DOI:10.3109/00498258309052279. PMID 6659544.
Források
[szerkesztés]- szerk.: Haynes, William M.: CRC Handbook of Chemistry and Physics, 97th, CRC Press (2016. december 3.). ISBN 9781498754293
További információk
[szerkesztés]- Birks, J. B.. Photophysics of Aromatic Molecules. London: Wiley (1969)
- Valeur, B.. Molecular Fluorescence: Principles and Applications. New York: Wiley-VCH (2002)
- Birks, J. B. (1975). „Excimers” (angol nyelven). Reports on Progress in Physics 38 (8), 903–974. o. DOI:10.1088/0034-4885/38/8/001. ISSN 0034-4885.
- Fetzer, J. C.. The Chemistry and Analysis of the Large Polycyclic Aromatic Hydrocarbons. New York: Wiley (2000)