Sulpiride
| Sulpiride | |
|---|---|
 | |
| Caratteristiche generali | |
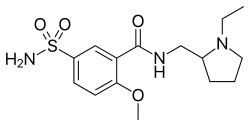
| Formula bruta o molecolare | C15H23N3O4S |
| Massa molecolare (u) | 341.427 g/mol |
| Numero CAS | |
| Numero EINECS | 239-753-7 |
| Codice ATC | N05 |
| PubChem | CID5355 |
| DrugBank | DBDB00391 |
| SMILES | CCN1CCCC1CNC(=O)C2=C(C=CC(=C2)S(=O)(=O)N)OC |
| Dati farmacologici | |
| Modalità di somministrazione | orale, intramuscolare |
| Dati farmacocinetici | |
| Biodisponibilità | 25%-40% |
| Legame proteico | 14% |
| Emivita | 6-8 ore |
| Escrezione | renale e fecale |
| Indicazioni di sicurezza | |
Sulpiride è un farmaco appartenente alla famiglia delle "benzammidi sostituite" utilizzato per il trattamento di diversi disturbi psichiatrici e digestivi.
A basse dosi trova impiego nel trattamento della depressione maggiore, moderata e cronica (distimia) in particolare nelle forme miste ad ansia e somatizzazioni, mentre a dosi elevate è utilizzata nel trattamento sia acuto che cronico della schizofrenia.[1] A dosi ancora minori, l'isomero levo (levosulpiride), che risulta essere circa due volte più attivo dell'isomero destro, è utilizzato per il trattamento dei disturbi digestivi.
In Italia il farmaco è venduto dalla società farmaceutica Teofarma con il nome commerciale di Dobren e nella formulazione in gocce per il trattamento dei disturbi digestivi (levosulpiride) con il nome di levobren e levopraid.
Farmacologia
[modifica | modifica wikitesto]Farmacodinamica
[modifica | modifica wikitesto]La molecola si lega selettivamente, con un effetto antagonista, ai recettori dopaminergici D2 a livello periferico e centrale (e in misura minore ai D3). Il legame con i recettori D1, istaminergici, serotoninergici, adrenergici, muscarinici colinergici o GABAergici non risulta significativo.[2][3]
Questo meccanismo d'azione prevale a dosaggi superiori ai 600 mg giornalieri ed è responsabile degli effetti antipsicotici, in maniera simile ad altri agenti neurolettici anche se contrariamente ad altre molecole di questa categoria, non induce effetti di tipo sedativo e non mostra generalmente effetto catalettogeno né antagonismo del comportamento stereotipato indotto da apomorfina.
A dosi minori (inferiori ai 200 mg giornalieri), il farmaco esercita un effetto attivante piuttosto che sedativo, aumentando l'attività locomotoria spontanea e potenziando la motilità indotta da apomorfina nei roditori. Ciò è dovuto al fatto che a bassi dosaggi la sulpiride mostra una affinità preferenziale per gli autorecettori presinaptici D2 della dopamina dove agisce da antagonista e determinando così un incremento del rilascio di questo neurotrasmettitore (un meccanismo d'azione opposto a quello neurolettico). Ciò si ritiene sia alla base degli effetti antidepressivi del farmaco, in particolare nei confronti della depressione neurotica e della distimia, essendo in grado di aumentare l'umore del paziente e di determinare un'azione disinibente, moderando inoltre i sintomi di ruminazione e d'ansia.[4][5]
Per questo, Sulpride è indicata in alcuni studi come un modulatore dell'attività della dopamina piuttosto che come un semplice antagonista.
Al contrario di quanto accade con altri neurolettici, sulpiride lega i recettori D2 in modo sodio-dipendente. Il composto si è inoltre dimostrato altamente selettivo nei confronti dei recettori dopaminergici D2 a livello mesolimbico, riducendo in tal senso gli effetti collaterali motori. Il farmaco sembra anche in grado di bloccare preferenzialmente i recettori pre-sinaptici auto-inibitori di tipo D4, i quali si trovano situati sui terminali delle fibre glutammatergiche delle vie corticostriatali: l'interazione determina un incremento di rilascio di glutammato (la carenza di glutammato, secondo alcuni autori, è una causa dei sintomi psicotici).[6][7] Avendo una scarsa permeabilità emoatoencefalica è particolarmente attivo sui recettori dopaminergici periferici come quelli dell'ipofisi, e ciò causa la secrezione di prolattina e quindi iperprolattinemia (uno dei principali effetti collaterali), in particolare ai dosaggi elevati.
Come altre molecole di questa classe (ad esempio amisulpiride) si è dimostrata in grado di attivare in vivo il recettore del gamma idrossi butirrato (GHB), ciò può contribuire ai suoi effetti ansiolitici ed antipsicotici.[8] Analogamente ad esse, mostra un'attività come inibitore delle istone deacetilasi (HDAC), attivando la demetilazione del DNA delle cellule cerebrali e quindi l'induzione dell'espressione genica, specie nei neuroni GABAergici (l'alterazione dell'espressione genica potrebbe essere implicata nella genesi dei disturbi psichiatrici).[9][10]
Benché sulpiride ed amisulpride siano clinicamente e farmacologicamente simili (ad esempio per l'essere escreti praticamente immodificati, per la virtuale mancanza di affinità per i recettori 5ht2a ed il meccanismo d'azione dose-dipendente) differiscono significativamente nella loro affinità verso i recettori della dopamina: infatti mentre già a basse dosi amisulpride occupa il 90% dei recettori della dopamina, sulpiride non supera il 60% nemmeno ai dosaggi più elevati. Amisulpride, sultopride e sulpiride (composti ad essa correlati) mostrano rispettivamente una affinità in vitro decrescente per i recettori D2 (IC50 = 27, 120 and 181 nM) e D3 della dopamina (IC50 = 3.6, 4.8 and 17.5 nM).
Altri effetti del farmaco consistono nell'inibizione dell'emesi indotta da apomorfina, iperprolattinemia, lieve diminuzione delle resistenze vascolari periferiche.[11] Studi sperimentali hanno permesso di evidenziare anche un aumento della motilità e del flusso sanguigno a livello gastrico. Verosimilmente quest'ultimo effetto potrebbe essere responsabile dell'azione curativa osservata sulle ulcere gastriche in modelli animali (roditori e primati). Inoltre allevia la sensazione di vertigini.
Farmacocinetica
[modifica | modifica wikitesto]Sulpiride a seguito di somministrazione per via orale è relativamente ben assorbita dal tratto gastroenterico. La biodisponibilità dopo somministrazione orale è compresa tra il 25% e il 40%.[12] Il composto non subisce metabolismo presistemico.[13] il picco plasmatico (Cmax) viene ottenuto entro 2-4 ore dalla assunzione. L'emivita di eliminazione varia tra 6 e 8 ore. Il volume di distribuzione è pari a 0,65-1,4 l/kg. Il farmaco si lega alle proteine plasmatiche nella misura del 14% (ma secondo alcuni autori nel paziente schizofrenico risulterebbe decisamente più elevato, raggiungendo il 40%).[14]
Sulpiride oltrepassa la barriera ematoencefalica ma non in misura rilevante e le concentrazioni nel fluido cerebrospinale sono circa il 13% di quelle raggiunte a livello plasmatico. Il farmaco è escreto dall'organismo quasi interamente in forma immodificata attraverso l'emuntorio renale (la quota eliminata tramite le feci è decisamente minore). L'80% di una dose assunta è eliminata entro 24 ore e circa il 95% in 48 ore. Viene prodotto un solo metabolita, la 5-ossipirrolidinilsulpiride, farmacologicamente inattiva. Questo metabolità viene successivamente escreto con le urine.[15][16][17] Il farmaco passa in piccole quantità nel latte materno.
Tossicologia
[modifica | modifica wikitesto]I valori della DL50 nel topo a seguito di somministrazione per via orale sono stati di 6500–7700 mg/kg peso corporeo. Nella somministrazione endovenosa il valore è stato paria a 61–68 mg/kg. Nel ratto la determinazione della DL50 dopo somministrazione endovenosa, intramuscolare e orale è stata rispettivamente di 110 mg/kg, 200 mg/kg e > 6000 mg/kg.
Usi clinici
[modifica | modifica wikitesto]Sulpiride è indicata nel trattamento della schizofrenia acuta e cronica,[18][19][20] in psicosi acute e croniche,[21][22] nella distimia (psiconevrosi ansioso-depressiva con cenestopatia e somatizzazione), nella depressione reattiva, nella depressione atipica, moderata e depressione mista ad ansia (in particolare nelle forme con somatizzazioni).
La forma levo è utilizzata nel trattamento di disturbi gastrici come la sindrome dispeptica (meteorismo, senso di tensione epigastrica, cefalea postprandiale, stipsi) e da ritardato svuotamento gastrico legato a fattori organici e psicosomatici, come antiemetico (effetto anti-nausea) e nel trattamento delle cefalee sia di origine vasomotorie che muscolo-tensive.[23] Può essere anche utilizzato nel trattamento delle vertigini.
Uno studio ha mostrato un effetto positivo nel trattamento degli acufeni.[24]
Dosi terapeutiche
[modifica | modifica wikitesto]Nel trattamento della schizofrenia è indicata la somministrazione di un dosaggio orale iniziale pari a 200–400 mg due volte al giorno. Questa dose può essere aumentata fino a un massimo di 1200 mg due volte al giorno. Nel trattamento di soggetti con prevalenza di sintomi negativi, come apatia o povertà di linguaggio, è consigliabile somministrare una dose iniziale di 400 mg due volte al giorno, che può poi essere ridotta a 200 mg due volte al giorno quando si osserva la risposta terapeutica. Il composto può essere somministrato anche per via intramuscolare alla dose di 200–800 mg al giorno. Nei bambini il dosaggio orale consigliato è di 3–5 mg/kg/die.
Nel trattamento delle forme ansioso\depressive il dosaggio consigliato è di 100-300 al giorno mg mentre in quello delle sindromi digestive di 25 mg fino a 3 volte al giorno. L’insorgenza di effetti antidepressivi è generalmente più rapida di quella di altri farmaci antidepressivi e avviene dopo circa 1-2 settimane di trattamento.
Effetti collaterali e indesiderati
[modifica | modifica wikitesto]Gli effetti collaterali sono in genere lievi e dose dipendenti, per cui è ben tollerato specie a basse dosi. Effetti collaterali comuni possono essere insonnia o sonnolenza, nausea, mal di testa, aumento ponderale, ansia specie ai dosaggi elevati. Non provoca generalmente effetti collaterali da sospensione quando utilizzato come antidepressivo.
L'aumento di peso, che si può verificare specie a dosaggi elevati, è comunque minore rispetto a quello provocato da altri farmaci utilizzati per lo stesso scopo. Meno comunemente può provocare un aumento del QT (alterazione riscontrabile all'elettrocardiogramma). In caso di sovradosaggio l'amisulpride è stato collegata ad episodi di torsione di punta.
In alcuni pazienti è stata segnalata la comparsa di aumento ponderale, galattorrea,[25][26] amenorrea[27][28] e ginecomastia, specie dopo un trattamento prolungato ed a dosaggi elevati.[29][30] Questi ultimi sono indicativi di uno stato di iperprolattinemia che scompare con il cessare del trattamento. L'iperprolattinemia, tipica di questa classe farmacologica, può essere controllata con quinagolide (per via della scarsa interazione farmacodinamica) o nei casi meno gravi con estratti di Vitex agnus-castus.[31]
In rari casi e ai dosaggi elevati, si possono osservare effetti di tipo extrapiramidale come acatisia,[32][33][34] distonia acuta e parkinsonismo, così come altri disturbi neurologici quali eccitabilità, irritabilità, ansietà e modificazioni dell'umore. Oltre alle discinesie precoci (più frequenti) possono comparire anche discinesie tardive.[35] Altri effetti indesiderati segnalati con minore frequenza comprendono disturbi del ritmo cardiaco, modificazioni del tracciato elettrocardiografico (in particolare anomalie della ripolarizzazione) e disturbi delle funzioni sessuali (aumento o diminuzione della libido). Anche a seguito di somministrazione di sulpiride, così come nel caso di altri molecole ad attività antipsicotica, è stata riportata la comparsa di sindrome neurolettica maligna.
Controindicazioni
[modifica | modifica wikitesto]Sulpiride è controindicata nei soggetti con ipersensibilità nota al principio attivo oppure ad uno qualsiasi degli eccipienti utilizzati nella formulazione farmacologica. Non deve essere utilizzata in pazienti affetti da feocromocitoma, per il rischio che si verifichino crisi ipertensive. È inoltre da evitare in donne in stato di gravidanza accertata o presunta a meno di un'attenta valutazione del rapporto rischio/beneficio. La somministrazione del farmaco deve essere effettuata con precauzione nei soggetti maniacali o ipomaniacali nei quali può indurre esacerbazione dei sintomi. Particolare cautela è richiesta anche nel trattamento di pazienti affetti da malattia di Parkinson, epilessia, ipertensione arteriosa, oppure insufficienza cardiaca. Nei soggetti anziani o affetti da insufficienza renale viene raccomandata una riduzione della posologia e di evitare la contemporanea assunzione di etanolo.
Sovradosaggio
[modifica | modifica wikitesto]In caso di sovradosaggio volontario od accidentale, possono comparire sintomi extrapiramidali (rigidità, tremori agli arti, acinesia o bradicinesia) oltre a stato di agitazione, confusione mentale, turbe del sonno e ipotensione arteriosa.
In letteratura medica è riportato un unico caso con evoluzione verso uno stato di coma. L'intossicazione è di solito di breve durata ed è sufficiente l'interruzione del trattamento oppure la diminuzione del dosaggio per vedere i sintomi scomparire nel giro di poche ore. In alcuni casi si rende necessario trattare la sintomatologia con adeguate misure di supporto, eventualmente ricorrendo a trattamenti antiparkinsoniani.
Interazioni
[modifica | modifica wikitesto]- Sucralfato e antiacidi contenenti idrossidi di alluminio e magnesio: la contemporanea somministrazione con sulpiride diminuisce la biodisponibilità orale di quest'ultima. Pertanto l'antipsicotico dovrebbe essere assunto prima di queste sostanze ad attività antiacida e gastroprotettrice.
- Antipertensivi: sulpiride in associazione con questi farmaci ne potenzia l'azione ipotensiva.
- Ipnotici, sedativi, tranquillanti, anestetici generali e analgesici: la contemporanea somministrazione con sulpiride comporta una aumentata attività di depressione del sistema nervoso centrale (SNC).
Note
[modifica | modifica wikitesto]- ^ P. Jenner, CD. Marsden, Substituted benzamide drugs as selective neuroleptic agents., in Neuropharmacology, vol. 20, 12B, Dic 1981, pp. 1285-93, PMID 6119638.
- ^ PN. Elliott, P. Jenner; G. Huizing; CD. Marsden; R. Miller, Substituted benzamides as cerebral dopamine antagonists in rodents., in Neuropharmacology, vol. 16, n. 5, Mag 1977, pp. 333-42, PMID 559256.
- ^ RS. Chang, VT. Tran; SH. Snyder, Histamine H1-receptors in brain labeled with 3H-mepyramine., in Eur J Pharmacol, vol. 48, n. 4, Apr 1978, pp. 463-4, PMID 648590.
- ^ P. Jenner e C. D. Marsden, The mode of action of sulpiride as an atypical antidepressant agent, in Advances in Biochemical Psychopharmacology, vol. 32, 1º gennaio 1982, pp. 85–103. URL consultato il 19 aprile 2017.
- ^ Pani L, Gessa GL, The substituted benzamides and their clinical potential on dysthymia and on the negative symptoms of schizophrenia (PDF), in Nature.
- ^ Daniel C. Javitt, Glutamatergic theories of schizophrenia, in The Israel Journal of Psychiatry and Related Sciences, vol. 47, n. 1, 1º gennaio 2010, pp. 4–16. URL consultato il 19 aprile 2017.
- ^ (EN) The pharmacology of sulpiride—A dopamine receptor antagonist, DOI:10.1016/0306-3623(82)90088-X.
- ^ Charline Ratomponirina, Serge Gobaille e Yann Hodé, Sulpiride, but not haloperidol, up-regulates γ-hydroxybutyrate receptors in vivo and in cultured cells, in European Journal of Pharmacology, vol. 346, 2–3, 10 aprile 1998, pp. 331–337, DOI:10.1016/S0014-2999(98)00068-5.
- ^ E. Dong, M. Nelson, D. R. Grayson, E. Costa, and A. Guidotti, Clozapine and sulpiride but not haloperidol or olanzapine activate brain DNA demethylation (PDF), in PNAS.
- ^ (EN) Alessandro Guidotti, Erbo Dong e Dennis R. Grayson, GABAERGIC DYSFUNCTION IN SCHIZOPHRENIA: NEW TREATMENT STRATEGIES ON THE HORIZON, in Schizophrenia Research, vol. 117, n. 2-3, 1º aprile 2010, DOI:10.1016/j.schres.2010.02.164. URL consultato il 19 aprile 2017.
- ^ G. Alfredsson, L. Bjerkenstedt; G. Edman; C. Härnryd; G. Oxenstierna; G. Sedvall; FA. Wiesel, Relationships between drug concentrations in serum and CSF, clinical effects and monoaminergic variables in schizophrenic patients treated with sulpiride or chlorpromazine., in Acta Psychiatr Scand Suppl, vol. 311, 1984, pp. 49-74, PMID 6199949.
- ^ F. Bressolle, J. Brès; A. Fauré-Jeantis, Absolute bioavailability, rate of absorption, and dose proportionality of sulpiride in humans., in J Pharm Sci, vol. 81, n. 1, Gen 1992, pp. 26-32, PMID 1619566.
- ^ AS. Alam, AR. Imondi; J. Udinsky; LM. Hagerman, Bioavailability of 14C-sulpiride in dogs., in Arch Int Pharmacodyn Ther, vol. 242, n. 1, Nov 1979, pp. 4-13, PMID 543747.
- ^ FA. Wiesel, G. Alfredsson; M. Ehrnebo; G. Sedvall, The pharmacokinetics of intravenous and oral sulpiride in healthy human subjects., in Eur J Clin Pharmacol, vol. 17, n. 5, Mag 1980, pp. 385-91, PMID 7418717.
- ^ AR. Imondi, AS. Alam; JJ. Brennan; LM. Hagerman, Metabolism of sulpiride in man and rhesus monkeys., in Arch Int Pharmacodyn Ther, vol. 232, n. 1, Mar 1978, pp. 79-91, PMID 96745.
- ^ JJ. Brennan, AR. Imondi; DG. Westmoreland; MJ. Williamson, Isolation, identification, and synthesis of the major sulpiride metabolite in primates., in J Pharm Sci, vol. 71, n. 11, Nov 1982, pp. 1199-203, PMID 7175707.
- ^ F. Bressolle, J. Bres; MD. Blanchin; R. Gomeni, Sulpiride pharmacokinetics in humans after intramuscular administration at three dose levels., in J Pharm Sci, vol. 73, n. 8, Ago 1984, pp. 1128-36, PMID 6491918.
- ^ EC. Lai, CH. Chang; YH. Kao Yang; SJ. Lin; CY. Lin, Effectiveness of sulpiride in adult patients with schizophrenia., in Schizophr Bull, vol. 39, n. 3, Mag 2013, pp. 673-83, DOI:10.1093/schbul/sbs002, PMID 22315480.
- ^ J. Wang, IM. Omori; M. Fenton; B. Soares, Sulpiride augmentation for schizophrenia., in Cochrane Database Syst Rev, n. 1, 2010, pp. CD008125, DOI:10.1002/14651858.CD008125.pub2, PMID 20091661.
- ^ IM. Omori, J. Wang, Sulpiride versus placebo for schizophrenia., in Cochrane Database Syst Rev, n. 2, 2009, pp. CD007811, DOI:10.1002/14651858.CD007811, PMID 19370694.
- ^ MJ. Hoes, Recent developments in the management of psychosis., in Pharm World Sci, vol. 20, n. 3, Giu 1998, pp. 101-6, PMID 9618732.
- ^ DS. Danilov, [Possibilities in using sulpiride in the treatment of psychotic disorders]., in Zh Nevrol Psikhiatr Im S S Korsakova, vol. 112, n. 6, 2012, pp. 91-7, PMID 22983256.
- ^ (EN) Levopraid - Foglietto Illustrativo, su my-personaltrainer.it. URL consultato il 19 aprile 2017.
- ^ KoreaMed Synapse, DOI:10.7599/hmr.2016.36.2.113&code=0130hmr&vmode=full.
- ^ D. Coliche, [Galactorrhea due to sulpiride with or without menstrual troubles]., in J Sci Med Lille, vol. 89, n. 2, Feb 1971, pp. 69-71, PMID 5102848.
- ^ G. Cahen, Y. Salomon; D. Millet; C. Sraer; A. Gorins; A. Netter, [Galactorrhea due to sulpiride]., in Presse Med, vol. 78, n. 35, Lug 1970, p. 1545, PMID 5464337.
- ^ H. Chimenes, [Amennorrhea-galactorrhea syndrome due to sulpiride]., in Presse Med, vol. 78, n. 42, Ott 1970, p. 1844, PMID 5528278.
- ^ L. Ravizza, [Sulpiride amenorrhea-galactorrhea syndrome. Clinical contribution]., in Minerva Psichiatr, vol. 21, n. 3, pp. 205-13, PMID 7193270.
- ^ Y. Kaneda, A. Fujii, Gynecomastia with sulpiride., in J Clin Pharm Ther, vol. 27, n. 1, Feb 2002, pp. 75-7, PMID 11846864.
- ^ HL. Fideleff, S. Belma; A. Guitelman; AM. Baigorri; D. Aquilano; HE. Scaglia, Sulpiride stimulation of prolactin secretion in adolescents with gynecomastia: relation to the circulating levels of estradiol., in Acta Med Port, vol. 2, n. 4, pp. 269-73, PMID 7211478.
- ^ Elvis Henrique Santos Andrade, Pedro Mario Pan e Paula F. Ramalho da Silva, New Insights in the Management of Antipsychotics in the Treatment of Schizophrenia in a Patient with Prolactinoma: A Case Report and Review of the Literature, in Case Reports in Medicine, vol. 2010, 2010, DOI:10.1155/2010/573252. URL consultato il 25 luglio 2019.
- ^ R. Kumar, PS. Sachdev, Akathisia and second-generation antipsychotic drugs., in Curr Opin Psychiatry, vol. 22, n. 3, Mag 2009, pp. 293-99, PMID 19378382.
- ^ FJ. Jiménez-Jiménez, PJ. García-Ruiz; JA. Molina, Drug-induced movement disorders., in Drug Saf, vol. 16, n. 3, Mar 1997, pp. 180-204, PMID 9098656.
- ^ K. Yamauchi, T. Ohmori, [Two cases of tardive Tourette syndrome]., in Seishin Shinkeigaku Zasshi, vol. 108, n. 5, 2006, pp. 459-65, PMID 16869393.
- ^ PM. Llorca, I. Chereau; FJ. Bayle; C. Lancon, Tardive dyskinesias and antipsychotics: a review., in Eur Psychiatry, vol. 17, n. 3, Mag 2002, pp. 129-38, PMID 12052573.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su sulpiride
Wikimedia Commons contiene immagini o altri file su sulpiride