シナプス小胞
シナプス小胞(シナプスしょうほう、英: synaptic vesicle, neurotransmitter vesicle)は、神経細胞のシナプスで放出されるさまざまな神経伝達物質を貯蔵している小胞である。小胞の内容物の放出は電位依存性カルシウムチャネルによって調節されている。小胞は神経細胞間での活動電位の伝播に必要不可欠であり、細胞で常に再形成されている。軸索中では、こうした小胞は軸索終末(axon terminal、terminal bouton)に保持されている。10分間、0.2 Hzの刺激を行うことで、1つの軸索終末当たり最大130個の小胞が放出される[1]。ヒトの脳の視覚野では、シナプス小胞の直径は39.5±5.1 nmである[2]。
構造
[編集]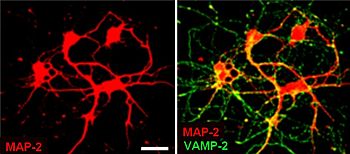
シナプス小胞の直径は約40 nmであり、膜上に存在できるタンパク質の数は限られているため、その構成は比較的単純である。精製された小胞のタンパク質:リン脂質の比率は1:3であり、脂質の構成は、40% ホスファチジルコリン、32% ホスファチジルエタノールアミン、12% ホスファチジルセリン、5% ホスファチジルイノシトール、10% コレステロールである[4]。
シナプス小胞には2種類の必須の構成要素が存在する。1つは神経伝達物質の取り込みに関与する輸送タンパク質(transport protein)、もう1つはシナプス小胞のエキソサイトーシス、エンドサイトーシス、再生に関与するトラフィッキングタンパク質(trafficking protein)である。
- 輸送タンパク質は、神経伝達物質の取り込みを可能にする電気化学的勾配を生み出すプロトンポンプと、実際の神経伝達物質の取り込みを調節する神経伝達物質輸送体から構成されている。輸送に必要なプロトン勾配はV-ATPaseによって形成され、勾配形成に必要なエネルギーはATPの加水分解によって供給される。神経伝達物質輸送体はこの勾配を利用して、細胞質からシナプス小胞へ神経伝達物質を移動させる。例えば、小胞型グルタミン酸トランスポーターはこの過程によってグルタミン酸を小胞内へ隔離する。
- トラフィッキングタンパク質の構成はより複雑であり、内在性膜タンパク質、表在性膜タンパク質、そしてSNAREなどのタンパク質から構成される。シナプス小胞タンパク質として特徴づけられるような共通した特徴はこれらのタンパク質に同定されておらず、これらがどのようにシナプス小胞へ特異的に送られているのかについはほとんど解明されていない。既知のシナプス小胞タンパク質は、全てではないものの、多くが非小胞タンパク質と相互作用しており、こうした相互作用はそれらの特異的機能と関係している[4]。
さまざまな神経伝達物質が小胞へ移動する際の量比を下の表に示す。
| 神経伝達物質 | 内向きの移動 | 外向きの移動 |
|---|---|---|
| ノルアドレナリン、ドーパミン、ヒスタミン、セロトニン、アセチルコリン | 1 (神経伝達物質)+ | 2 H+ |
| GABA、グリシン | 1 神経伝達物質 | 1 H+ |
| グルタミン酸 | 1 (神経伝達物質)− + 1 Cl− | 1 H+ |
近年、シナプス小胞にはtRNA断片、Y RNA断片、miRNAを含む低分子RNAも含まれていることが発見された[5]。
神経毒の効果
[編集]バトラコトキシンなどの一部の神経毒は、シナプス小胞を破壊することが知られている。テタヌストキシンはv-SNAREの1種である小胞結合膜タンパク質(VAMP)を損傷し、ボツリヌストキシンはt-SNAREとv-SNAREを損傷することでシナプス伝達を阻害する[6]。α-ラトロトキシンと呼ばれるクモ毒はニューレキシンに結合し、小胞を損傷することで大量の神経伝達物質の放出を引き起こす。
小胞プール
[編集]神経終末の小胞は、放出可能プール(readily releasable pool)、再循環プール(recycling pool)、貯蔵プール(reserve pool)の3つのプールに分類される[7]。これらのプールは機能や神経終末での位置によって区別される。放出可能プールは細胞膜にドッキングしており、刺激に伴って最初に放出されるプールである。放出可能プールは小さいため、すぐに枯渇する。再循環プールは細胞膜に近接しており、中程度の刺激を受けて小胞の放出と形成の循環を開始する傾向がある。小胞の放出率は形成率と同程度かより低い。このプールは放出可能プールよりも大きいものの、刺激を受けてから動き出すまでにはより長い時間がかかる。貯蔵プールは通常の条件下では放出されない小胞を含んでいる。このプールはガラス上で生育した神経細胞では極めて大きな割合を占める(約50%)が、実際の脳組織内の成熟したシナプスでは非常に少ないかもしくは存在しない[8][9]。
生理学
[編集]シナプス小胞サイクル
[編集]シナプス小胞サイクルはいくつかの重要な段階に分けられる[10]。
- 1. シナプスへの輸送
まず、シナプス小胞の構成要素はキネシンファミリーのメンバーによってシナプスへ輸送される。C. elegansでは、シナプス小胞輸送の主要なモータータンパク質はUNC-104である[11]。UNC-16/Sunday Driverなど他のタンパク質がシナプス小胞輸送に利用されるモーターを調節する証拠も存在する[12]。
- 2. 神経伝達物質のローディング
シナプスに到達すると、シナプス小胞には神経伝達物質が詰め込まれる。神経伝達物質の詰め込みは、輸送体とプロトンポンプを必要とする能動過程である。プロトンポンプはATPアーゼであり、ATP加水分解のエネルギーを利用して電気化学的勾配を形成する。輸送体はそれぞれの特定の種類の神経伝達物質を選択的に輸送する。C. elegansでは、UNC-17とUNC-47がそれぞれ小胞アセチルコリントランスポーター、小胞GABAトランスポーターとして同定されている[13]。
- 3. ドッキング
ローディングが行われたシナプス小胞は近傍の放出部位にドッキングする必要があるが、この段階についてはほとんど解明されていない。シナプス小胞と放出部位には多くのタンパク質が同定されているが、ドッキング過程の説明となるようなタンパク質間相互作用はまだ明らかにされていない。C. elegansでは、rab-3とmunc-18の変異体は小胞のドッキングまたは放出部位での小胞の構成が変化するが、ドッキングが完全に破壊されるわけではない[14]。現在では、SNAREタンパク質もドッキングに関与していると考えられている[15]。
- 4. プライミング
シナプス小胞がドッキングした後、膜の融合が始まる前にはプライミングが必要である。プライミングは、カルシウムの流入に応答して迅速に融合することができるよう、シナプス小胞が準備をする過程である。プライミングにはSNARE複合体の部分的な組み立てが関与していると考えられている。この過程には、Munc13、RIMとRIM結合タンパク質が参加する[16]。Munc13は、t-SNAREであるシンタキシンの閉じたコンフォメーションから開いたコンフォメーションへ変化を促進し、v-SNARE/t-SNARE複合体の組み立てを促進すると考えられている[17]。RIMもプライミングを調節するようであるが、この段階に必須ではない。
- 5. 融合
プライミングされた小胞は、細胞質のカルシウム濃度の上昇に応答して非常に迅速に融合する。融合はSNAREによって直接媒介され、SNAREの組み立てによってもたらされるエネルギーによって駆動されると考えられている。カルシウムを検知してこの段階を開始するのは、カルシウム結合小胞タンパク質のシナプトタグミンである。SNAREによるカルシウム依存的な膜融合は、近年in vitroで再構成が行われている。C. elegansではv-SNAREとt-SNAREの変異体は致死となり、このことはSNAREが融合過程に必要不可欠であることと符合する。同様に、ショウジョウバエの変異体やノックアウトマウスにおいても、SNAREがシナプスのエキソサイトーシスに重要な役割を果たしていることが示されている[10]。
- 6. エンドサイトーシス
この過程は、full-collapse fusion機構(後述)において小胞が再形成される過程である。
小胞の再生
[編集]シナプス小胞の再生は、"full-collapse fusion"と"kiss-and-run"と呼ばれる2つの主要な作用機構によって担われていると考えられている。どちらの機構も細胞外空間へ神経伝達物質を放出するポアの形成によって開始される。神経伝達物質の放出の後、"full-collapse fusion"機構ではポアは大きく拡張され小胞は完全に崩壊してシナプス膜と一体化するのに対し、"kiss-and-run"機構では迅速にポアが閉じて小胞は膜からくびり切れる[18]。
Full-collapse fusion
[編集]神経シナプスを一定期間強く刺激すると、小胞の数が枯渇するとともに細胞のキャパシタンスと表面積が増加することが示されている[19]。このことは、シナプス小胞は神経伝達物質の放出の後、細胞膜と融合してその一部となることを示唆している。HeuserとReeseは、シナプス小胞をHRP(ホースラディッシュペルオキシダーゼ)でタグ付けすることで、カエルの神経筋接合部の細胞膜の一部が細胞に取り込まれ、シナプス小胞へと再変換されることを発見した[20]。研究からはシナプス小胞のエキソサイトーシス、回収、再形成のサイクルは1分以内に行われることを示唆している[21]。
Full-collapse fusion機構では、シナプス小胞は細胞膜に融合し、組み込まれる。新たな膜の形成はタンパク質に媒介される過程であり、特定の条件下でしか起こらない。活動電位の後、Ca2+がシナプス前膜に流入し、細胞質の特定のタンパク質に結合する。その中の1つがシナプトタグミンであり、シナプス小胞と細胞膜との完全な融合を開始する。ポアの完全な融合はSNAREタンパク質によって補助される。このタンパク質ファミリーは、ATP依存的にシナプス小胞にドッキングを媒介する。シナプス小胞上のシナプトブレビン、細胞膜上のシンタキシンとSNAP-25からなるt-SNARE複合体の助けのもと、シナプス小胞の細胞膜へのドッキング、プライミング、そして融合が行われる[22]。
Full-collapse fusion機構は、ボツリヌストキシンとテタヌストキシンの標的となっていることが示されている。ボツリヌストキシンはプロテアーゼ活性を持っており、SNAP-25を分解する。SNAP-25は、特にアセチルコリンを放出する小胞の融合に必要である[23]。ボツリヌストキシンはこうしたSNAREタンパク質を切断することで、シナプス小胞のシナプス膜への融合、そして神経伝達物質の放出を防ぐ。テタヌストキシンも同様に作用するが、攻撃の標的はシナプス小胞のシナプトブレビンである。これらの神経毒はfull-collapse fusion機構の完了を防ぎ、その結果、筋肉の痙攣、麻痺、そして死をもたらす可能性がある。
Kiss-and-run
[編集]シナプス小胞が再生される2つ目の機構は"kiss-and-run"として知られている。この場合、シナプス小胞は細胞膜に接触(kiss)し、神経伝達物質を放出する小さな孔を開け、その後、孔が閉じて細胞内へ再生される[18]。このkiss-and-run機構については盛んな議論がある。その作用は観察され記録されているものの、full-collapse fusionではなくこの機構が利用される理由については現在も研究が続いている。Kiss-and-run機構は、稀少な小胞のリソースを節約するため、また高頻度のインプットに応答するために利用されていると推測されている[24]。Kiss-and-runが実際に起こることは実験的に示されている。この機構はKatzとdel Castilloによって初めて観察され、細胞のキャパシタンスが増加しないことからfull-collapse fusionとは異なる過程であることが後に観察された[24]。
調節
[編集]このように、細胞は膜の再生のために少なくとも2つの機構を利用するようである。特定の条件下では、細胞は一方の機構から他方の機構へ切り替えることができる。Ca2+レベルが低いときにはゆっくりとしたfull-collapse fusion機構が支配的であり、Ca2+レベルが高いときには速いkiss-and-run機構が利用される。Alesらは、細胞外のカルシウムイオン濃度を上昇させることで、シナプス小胞の再生に好まれる様式がカルシウム濃度依存的にkiss-and-run機構へシフトすること示した。シナプスでの神経伝達物質の分泌の際、エキソサイトーシスとエンドサイトーシスの共役が最適な状態となるよう、シナプス活性に応じてエキソサイトーシスの様式が調節されていると提唱されている[25]。
連続刺激の開始時点ではkiss-and-run機構が支配的な様式であることが実験的証拠から示唆されており、このことはこうした状況下でのkiss-and-run機構の高い小胞放出可能性を反映している。Kiss-and-run機構の発生率は神経の迅速な発火と刺激によっても増加し、このタイプの放出の速度は他の小胞放出様式よりも早いことが示唆される[26]。
歴史
[編集]1950年代初頭の電子顕微鏡の出現により、神経終末に電子透過性の高い小胞が多数含まれていることが発見された[27][28]。Synaptic vesicle(シナプス小胞)という用語は、1954年にDe RobertisとBennettによって初めて導入された[29]。そのすぐ前には、カエルの神経筋接合部での神経伝達物質の放出がシナプス後微小終板電位を誘発しており、またシナプス前神経終末からの神経伝達物質の放出量が離散的である、すなわち放出はパッケージ化されたもの(量子(quanta)と呼ばれる)によって担われていることが発見されていた[30][31]。そのため、神経伝達物質(アセチルコリン)がこうした小胞に内包されており、分泌機構によってシナプス間隙へ内容物の放出が行われているという仮説(小胞仮説)は合理的なものであった[32][33]。
この仮説に欠けていたのは、神経伝達物質であるアセチルコリンが実際にシナプス小胞に内包されていることの実証であった。約10年後、細胞分画技術の脳組織への応用により神経終末が初めて単離され(シナプトソーム)[34]、その後哺乳類の脳からシナプス小胞が単離された。この業績は、イギリスのVictor P. Whittakerの研究室とアルゼンチンのEduardo de Robertisの研究室によるものであった[35]。Whittakerの業績はモルモットの脳の小胞分画中にアセチルコリンが存在することを実証したもので、1960年にその概要が、1963年と1964年により詳細が発表された[36][37]。de Robertisのグループの論文はラットの脳のシナプス小胞分画にアセチルコリンが濃縮されていることを実証し、1963年に発表された[38]。どちらのグループも単離したシナプトソームから浸透圧ショックによって小胞を放出させた。1つの小胞に内包されるアセチルコリンは当初、1000–2000分子と推計されていた[39]。その後、シナプス小胞には他の神経伝達物質であるアミノ酸、カテコールアミン、セロトニン、ATPなどが局在していることが同定された。後に、シナプス小胞は上頸神経節[40]やタコの脳[41]など他の組織からも単離された。シビレエイの発電器官からの高精製度のコリン作動性シナプス小胞分画の単離[42][43]は、小胞の生化学と機能研究のための重要なステップとなった。
出典
[編集]- ^ Ikeda, K; Bekkers, JM (2009). “Counting the number of releasable synaptic vesicles in a presynaptic terminal”. Proc Natl Acad Sci U S A 106 (8): 2945–50. Bibcode: 2009PNAS..106.2945I. doi:10.1073/pnas.0811017106. PMC 2650301. PMID 19202060.
- ^ Qu, Lei; Akbergenova, Yulia; Hu, Yunming; Schikorski, Thomas (2009-06-01). “Synapse-to-synapse variation in mean synaptic vesicle size and its relationship with synaptic morphology and function”. The Journal of Comparative Neurology 514 (4): 343–352. doi:10.1002/cne.22007. ISSN 1096-9861. PMID 19330815.
- ^ Tonna, Noemi; Bianco, Fabio; Matteoli, Michela; Cagnoli, Cinzia; Antonucci, Flavia; Manfredi, Amedea; Mauro, Nicolò; Ranucci, Elisabetta et al. (2014). “A soluble biocompatible guanidine-containing polyamidoamine as promoter of primary brain cell adhesion and in vitro cell culturing”. Science and Technology of Advanced Materials 15 (4): 045007. Bibcode: 2014STAdM..15d5007T. doi:10.1088/1468-6996/15/4/045007. PMC 5090696. PMID 27877708.
- ^ a b Benfenati, F.; Greengard, P.; Brunner, J.; Bähler, M. (1989). “Electrostatic and hydrophobic interactions of synapsin I and synapsin I fragments with phospholipid bilayers”. The Journal of Cell Biology 108 (5): 1851–1862. doi:10.1083/jcb.108.5.1851. PMC 2115549. PMID 2497105.
- ^ Li, Huinan; Wu, Cheng; Aramayo, Rodolfo; Sachs, Matthew S.; Harlow, Mark L. (2015-10-08). “Synaptic vesicles contain small ribonucleic acids (sRNAs) including transfer RNA fragments (trfRNA) and microRNAs (miRNA)” (英語). Scientific Reports 5: 14918. Bibcode: 2015NatSR...514918L. doi:10.1038/srep14918. PMC 4597359. PMID 26446566.
- ^ “Transmitter Release”. Principles of Neural Science (4th ed.). New York: McGraw-Hill. (2000). ISBN 978-0-8385-7701-1
- ^ Rizzoli, Silvio O; Betz, William J (January 2005). “Synaptic vesicle pools”. Nature Reviews Neuroscience 6 (1): 57–69. doi:10.1038/nrn1583. PMID 15611727.
- ^ Rose, Tobias; Schoenenberger, Philipp; Jezek, Karel; Oertner, Thomas G. (2013). “Developmental Refinement of Vesicle Cycling at Schaffer Collateral Synapses”. Neuron 77 (6): 1109–1121. doi:10.1016/j.neuron.2013.01.021. PMID 23522046.
- ^ Xue, Lei; Sheng, Jiansong; Wu, Xin-Sheng; Wu, Wei; Luo, Fujun; Shin, Wonchul; Chiang, Hsueh-Cheng; Wu, Ling-Gang (2013-05-15). “Most Vesicles in a Central Nerve Terminal Participate in Recycling”. Journal of Neuroscience 33 (20): 8820–8826. doi:10.1523/jneurosci.4029-12.2013. PMC 3710729. PMID 23678124.
- ^ a b Südhof, T. C. (2004). “The Synaptic Vesicle Cycle”. Annual Review of Neuroscience 27: 509–547. doi:10.1146/annurev.neuro.26.041002.131412. PMID 15217342.
- ^ Tien, N. W.; Wu, G. H.; Hsu, C. C.; Chang, C. Y.; Wagner, O. I. (2011). “Tau/PTL-1 associates with kinesin-3 KIF1A/UNC-104 and affects the motor's motility characteristics in C. Elegans neurons”. Neurobiology of Disease 43 (2): 495–506. doi:10.1016/j.nbd.2011.04.023. PMID 21569846.
- ^ Arimoto, M.; Koushika, S. P.; Choudhary, B. C.; Li, C.; Matsumoto, K.; Hisamoto, N. (2011). “The Caenorhabditis elegans JIP3 Protein UNC-16 Functions As an Adaptor to Link Kinesin-1 with Cytoplasmic Dynein”. Journal of Neuroscience 31 (6): 2216–2224. doi:10.1523/JNEUROSCI.2653-10.2011. PMC 6633058. PMID 21307258.
- ^ Sandoval, G. M.; Duerr, J. S.; Hodgkin, J.; Rand, J. B.; Ruvkun, G. (2006). “A genetic interaction between the vesicular acetylcholine transporter VAChT/UNC-17 and synaptobrevin/SNB-1 in C. Elegans”. Nature Neuroscience 9 (5): 599–601. doi:10.1038/nn1685. PMID 16604067.
- ^ Abraham, C.; Bai, L.; Leube, R. E. (2011). “Synaptogyrin-dependent modulation of synaptic neurotransmission in Caenorhabditis elegans”. Neuroscience 190: 75–88. doi:10.1016/j.neuroscience.2011.05.069. PMID 21689733.
- ^ Hammarlund, Marc; Palfreyman, Mark T; Watanabe, Shigeki; Olsen, Shawn; Jorgensen, Erik M (August 2007). “Open Syntaxin Docks Synaptic Vesicles”. PLoS Biology 5 (8). doi:10.1371/journal.pbio.0050198. ISSN 1544-9173. PMC 1914072. PMID 17645391.
- ^ Kaeser, Pascal S.; Deng, Lunbin; Wang, Yun; Dulubova, Irina; Liu, Xinran; Rizo, Josep; Südhof, Thomas C. (2011). “RIM Proteins Tether Ca2+ Channels to Presynaptic Active Zones via a Direct PDZ-Domain Interaction”. Cell 144 (2): 282–295. doi:10.1016/j.cell.2010.12.029. PMC 3063406. PMID 21241895.
- ^ Lin, X. G.; Ming, M.; Chen, M. R.; Niu, W. P.; Zhang, Y. D.; Liu, B.; Jiu, Y. M.; Yu, J. W. et al. (2010). “UNC-31/CAPS docks and primes dense core vesicles in C. Elegans neurons”. Biochemical and Biophysical Research Communications 397 (3): 526–531. doi:10.1016/j.bbrc.2010.05.148. PMID 20515653.
- ^ a b Breckenridge, L. J.; Almers, W. (1987). “Currents through the fusion pore that forms during exocytosis of a secretory vesicle”. Nature 328 (6133): 814–817. Bibcode: 1987Natur.328..814B. doi:10.1038/328814a0. PMID 2442614.
- ^ Heuser, J. E.; Reese, T. S. (1973). “Evidence for Recycling of Synaptic Vesicle Membrane During Transmitter Release at the Frog Neuromuscular Junction”. The Journal of Cell Biology 57 (2): 315–344. doi:10.1083/jcb.57.2.315. PMC 2108984. PMID 4348786.
- ^ Miller, T. M.; Heuser, J. E. (1984). “Endocytosis of synaptic vesicle membrane at the frog neuromuscular junction”. The Journal of Cell Biology 98 (2): 685–698. doi:10.1083/jcb.98.2.685. PMC 2113115. PMID 6607255.
- ^ Ryan, T. A.; Smith, S. J.; Reuter, H. (1996). “The timing of synaptic vesicle endocytosis”. Proceedings of the National Academy of Sciences of the United States of America 93 (11): 5567–5571. Bibcode: 1996PNAS...93.5567R. doi:10.1073/pnas.93.11.5567. PMC 39287. PMID 8643616.
- ^ Xu, H.; Zick, M.; Wickner, W. T.; Jun, Y. (2011). “A lipid-anchored SNARE supports membrane fusion”. Proceedings of the National Academy of Sciences 108 (42): 17325–17330. Bibcode: 2011PNAS..10817325X. doi:10.1073/pnas.1113888108. PMC 3198343. PMID 21987819.
- ^ Foran, P. G.; Mohammed, N.; Lisk, G. O.; Nagwaney, S.; Lawrence, G. W.; Johnson, E.; Smith, L.; Aoki, K. R. et al. (2002). “Evaluation of the Therapeutic Usefulness of Botulinum Neurotoxin B, C1, E, and F Compared with the Long Lasting Type A. BASIS FOR DISTINCT DURATIONS OF INHIBITION OF EXOCYTOSIS IN CENTRAL NEURONS”. Journal of Biological Chemistry 278 (2): 1363–1371. doi:10.1074/jbc.M209821200. PMID 12381720.
- ^ a b Harata, N. C.; Aravanis, A. M.; Tsien, R. W. (2006). “Kiss-and-run and full-collapse fusion as modes of exo-endocytosis in neurosecretion”. Journal of Neurochemistry 97 (6): 1546–1570. doi:10.1111/j.1471-4159.2006.03987.x. PMID 16805768.
- ^ Alvarez De Toledo, G.; Alés, E.; Tabares, L. A.; Poyato, J. M.; Valero, V.; Lindau, M. (1999). “High calcium concentrations shift the mode of exocytosis to the kiss-and-run mechanism”. Nature Cell Biology 1 (1): 40–44. doi:10.1038/9012. PMID 10559862.
- ^ Zhang, Q.; Li, Y.; Tsien, R. W. (2009). “The Dynamic Control of Kiss-And-Run and Vesicular Reuse Probed with Single Nanoparticles”. Science 323 (5920): 1448–1453. Bibcode: 2009Sci...323.1448Z. doi:10.1126/science.1167373. PMC 2696197. PMID 19213879.
- ^ Palay, Sanford L.; Palade, George E. (1954). “Electron microscope study of the cytoplasm of neurons”. The Anatomical Record 118: 336. doi:10.1002/ar.1091180211.
- ^ Eduardo D. P., De Robertis; Stanley, Bennett, H. (January 25, 1955). “Some Features of the Submicroscopic Morphology of Synapses in Frog and Earthworm”. The Journal of Biophysical and Biochemical Cytology 1 (1): 47–58. doi:10.1083/jcb.1.1.47. JSTOR 1602913. PMC 2223594. PMID 14381427.
- ^ “Submicroscopic vesicular component in the synapse”. Fed Proc 13: 35. (1954).
- ^ Fatt, P.; Katz, B. (7 October 1950). “Some Observations on Biological Noise”. Nature 166 (4223): 597–598. Bibcode: 1950Natur.166..597F. doi:10.1038/166597a0. PMID 14780165.
- ^ Fatt, P.; Katz, B. (May 28, 1952). “Spontaneous subthreshold activity at motor nerve endings”. The Journal of Physiology 117 (1): 109–128. doi:10.1113/jphysiol.1952.sp004735. PMC 1392564. PMID 14946732 1 February 2014閲覧。.
- ^ “Quantal components of the endplate potential”. J. Physiol. 124 (3): 560–573. (1954). doi:10.1113/jphysiol.1954.sp005129. PMC 1366292. PMID 13175199.
- ^ “Biophysical aspects of neuromuscular transmission”. Prog Biophys Biophys Chem 6: 121–170. (1954). PMID 13420190.
- ^ “The isolation of nerve endings from brain: an electron microscopic study of cell fragments derived from homogenization and centrifugation”. J Anat 96: 79–88. (1962). PMC 1244174. PMID 13901297.
- ^ Zimmermann, Herbert (2018). “The discovery of the synaptosome and its implications.”. Neuromethods 141: 9–26. doi:10.1007/978-1-4939-8739-9_2.
- ^ “The separation of synaptic vesicles from disrupted nerve ending particles”. Biochem Pharmacol 12 (2): 300–302. (1963). doi:10.1016/0006-2952(63)90156-4. PMID 14000416.
- ^ “The separation of synaptic vesicles from nerve ending particles ('synaptosomes')”. Biochem J 90 (2): 293–303. (1964). doi:10.1042/bj0900293. PMC 1202615. PMID 5834239.
- ^ “Isolation of synaptic vesicles and structural organization of the acetylcholine system within brain nerve endings”. J Neurochem 10 (4): 225–235. (1963). doi:10.1111/j.1471-4159.1963.tb05038.x. PMID 14026026.
- ^ “The morphology and acetylcholine content of isolated cerebral cortical synaptic vesicles”. J Neurochem 12 (5): 363–372. (1965). doi:10.1111/j.1471-4159.1965.tb04237.x. PMID 14333293.
- ^ “The isolation of cholinergic synaptic vesicles from bovine superior cervical ganglion and estimation of their acetylcholine content”. J Neurochem 20 (3): 659–667. (1973). doi:10.1111/j.1471-4159.1973.tb00026.x. PMID 4574192.
- ^ Jones DG (1970). “The isolation of synaptic vesicles from Octopus brain”. Brain Res 17 (2): 181–193. doi:10.1016/0006-8993(70)90077-6. PMID 5412681.
- ^ “Subcellular fractionation of the electric organ of Torpedo marmorata”. J Neurochem 17 (10): 1441–1450. (1970). doi:10.1111/j.1471-4159.1970.tb00511.x. PMID 5471906.
- ^ “The isolation of pure cholinergic synaptic vesicles from the electric organs of elasmobranch fish of the family Torpidinidae”. Biochem J 128 (4): 833–846. (1972). doi:10.1042/bj1280833. PMC 1173903. PMID 4638794.