인산과 인산염

인산(燐酸, 영어: phosphoric acid)은 일반적인 의미에서 각 인 원자가 +5 산화수 상태에 있는 인의 산소산이며, 4개의 산소 원자와 결합되어 있고, 산소 원자 중 하나는 이중 결합으로 연결되어 있으며, 사면체 구조의 모서리에 산소 원자가 배열되어 있다. 이러한 PO4 사면체 중 둘 이상의 산소가 결합을 공유하는 단일 결합 산소에 의해 연결되어 선형, 분지형 사슬, 고리형 또는 보다 더 복잡한 구조를 형성할 수 있다. 공유되지 않는 단일 결합 산소 원자는 산성 수소 원자로 완성된다. 인산의 일반식은 H
n+2−2xP
nO
3n+1−x,이며, 여기서 n은 인 원자의 수이고, x는 0에서 (n+2)/2 사이의 분자 구조의 기본 주기수이다.

인산염(燐酸鹽, 영어: phosphate)은 인산으로부터 유도된 음이온, 염, 작용기 또는 에스터이다. k 개의 하이드록실기(–OH)로부터 양성자(H+
)를 제거하면 일반적으로 인산염(k = n−2x+2인 경우) 또는 인산수소(k 가 1과 n−2x+1 사이인 경우)라고 하는 음이온이 생성되며, 일반식은 [Hn−2x+2−kPnO3n+1−x]k−이다. 완전히 해리된 음이온(k = n−2x+2)은 화학식 [PnO3n−x+1](n−2x+2)−를 갖는다. 이 용어는 또한 한 개 이상의 수소가 다른 작용기에 의한 결합으로 치환될 때 생성되는 작용기에 대해 유기화학에서 사용된다.
이들 산은 염 및 에스터와 함께 생화학, 광물학, 농업, 약학, 화학공업 및 화학 연구에서 매우 중요한 인의 가장 잘 알려진 화합물들을 포함한다.
산
[편집]오르토 인산
[편집]인산 중에서 가장 단순하고 가장 흔하게 접할 수 있는 것은 오르토인산(H3PO4)이다. 실제로 인산이라는 용어는 보통 이 화합물을 구체적으로 의미한다. 또한 이것은 현재 IUPAC 명명법에 의한 명칭이기도 하다.
올리고인산 및 폴리인산
[편집]
두 개 이상의 오르토인산 분자는 탈수되어 더 큰 분자로 축합될 수 있다. 몇 개의 단위체가 축합되면 올리고인산이 생성되고, 더 큰 분자는 폴리인산이라고 한다. 그러나 올리고인산과 폴리인산 이 두 용어의 구분은 잘 정의되어 있지 않다.
예를 들어 피로인산, 삼인산 및 사인산은 다음의 반응에 의해 얻을 수 있다.
- 2 H
3PO
4 → H
4P
2O
7 + H
2O - H
4P
2O
7 + H
3PO
4 → H
5P
3O
10 + H
2O - H
5P
3O
10 + H
3PO
4 → H
6P
4O
13 + H
2O
폴리인산 분자의 "골격"은 P와 O 원자가 번갈아가며 연결된 사슬이다. 축합되는 추가 오르토인산 단위에 의해 1개의 추가 H(수소) 원자, 1개의 추가 P(인) 원자 및 3개의 추가 O(산소) 원자가 더해지게 된다. 폴리인산의 일반식은 H
n+2P
nO
3n+1 또는 HO(–P(O)(OH)–O–)nH이다.
폴리인산은 고리화 및 아실화를 위한 유기 합성에 사용된다.[1][2]
고리형 인산
[편집]반면에 동일한 분자의 두 하이드록실기(–OH) 단위 사이의 축합은 두 개의 수소 원자와 한 개의 산소 원자를 제거하여 삼메타인산의 형성에서와 같이 고리를 생성한다.
- H
5P
3O
10 → H
3P
3O
9 + H
2O
인산의 일반식은 Hn−2x+2PnO3n−x+1이며 여기서 n은 인 원자의 수이고, x는 분자 구조의 기본 고리 수이다. 즉 모든 고리를 제거하기 위해 끊어야 하는 결합의 최소수이다.
-
Orthophosphoric acid
H3PO4 -
Tetrapolyphosphoric acid
H
6P
4O
13 -
Trimetaphosphoric acid
H3P3O9 -
Phosphoric anhydride
P4O10
모든 산소 원자가 공유되고 수소 원자가 없는 내부 축합의 제한적인 경우 (x = (n+2)/2)는 오산화 인(P
4O
10)과 같은 무수물(PnO5n/2)이다.
인산염
[편집]수소 원자를 양성자(H+)로 제거하면 인산이 인산염 음이온으로 바뀐다. 부분적으로 제거하면 다양한 인산수소 음이온이 생성된다.
오르토인산염
[편집]오르토인산(H
3PO
4)의 음이온은 오르토인산염( PO3−
4), 인산수소(HPO2−
4), 인산이수소(H
2PO−
4)이다.
선형 올리고인산염 및 폴리인산염
[편집]피로인산(H
4P
2O
7)의 해리는 4가지 음이온(H
4-kP
2O−
7k−)을 생성하게 되며, 여기서 k의 범위는 1~4이다. 마지막의 것은 피로인산염(P
2O4−
7)이다. 피로인산염은 대부분 수용성이다.
마찬가지로 삼인산(H
5P
3O
10)은 삼인산염(P
3O5−
10)을 포함하여 k가 1~5 사이의 범위인 5가지 이상의 음이온 [H
5-kP
3O
10]k−을 생성한다. 사인산(H
6P
4O
13)은 사인산염(P
4O6−
13)을 포함하여 마찬가지의 방식으로 6가지 이상의 음이온을 생성한다. 각각의 추가되는 인산 단위체에 의해 1개의 인 원자, 3개의 산소 원자, 1개의 수소 원자 또는 음전하가 더해지게 된다.
분지된 폴리인산은 유사하게 분지된 폴리인산 음이온을 생성한다. 이것의 가장 간단한 예는 트라이포스포노 인산([OP(OPO
3)
3]9−) 및 이의 부분적으로 해리된 이온들이다.
선형 또는 분지형의 이러한 고리형이 아닌 폴리인산염 음이온의 일반식은 [H
n+2−kP
nO
3n+1]k−이며, 여기서 k는 1에서 n+2까지 다양할 수 있다. 일반적으로 수용액에서 해리되는 정도 또는 백분율은 용액의 pH에 따라 다르다.
고리형 폴리인산염
[편집]
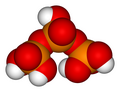
인산 단위는 고리(고리형 구조)로 함께 결합되어 메타인산(metaphosphoric acid)을 형성할 수 있다. 이 중 가장 단순한 화합물은 화학식이 H3P3O9인 트라이메타인산(trimetaphosphoric acid) 또는 사이클로삼인산(cyclo-triphosphoric acid)이다. 그 구조는 오른쪽의 그림과 같다. 말단이 응축되어 있기 때문에 그 화학식은 삼인산보다 H2O(물)가 하나 적다. 일반적으로 트라이메타인산염(trimetaphosphate)이라고 불리는 것은 실제로 고리 크기가 혼합되어 있다. 이러한 고리형 화합물의 일반식은 (HPO3)x이며, 여기서 x는 분자 내의 인산 단위체의 수이다. 질산과 원자가가 등전자인 가상의 단량체 모노메타인산(HPO3)은 존재하지 않는 것으로 알려져 있다.
이러한 메타인산이 H+로 수소를 읽으면 메타인산염(metaphosphate)이라고 하는 고리형 음이온이 형성된다. 이러한 음이온을 가지고 있는 화합물의 예로는 격리제 및 식품 첨가물로 사용되는 핵사메타인산 나트륨(Na6P6O18)이 있다.
화학적 특성
[편집]용해도
[편집]이러한 인산 계열은 분자의 극성을 고려할 때 일반적으로 수용성이다. 인산 암모늄 및 알칼리 인산염도 물에 작 녹는다. 알칼리 토금속 염은 용해성이 보다 낮으며, 다양한 다른 금속의 인산염은 훨씬 더 용해성이 낮다.
가수분해 및 축합
[편집]수용액에 충분한 물이 주어지면 물은 점차적으로 폴리인산염을 보다 더 작은 인산염으로 가수분해하고 결국에는 오르토인산염으로 가수분해한다. 더 높은 온도 또는 산성 조건은 가수분해 반응의 속도를 상당히 높일 수 있다.[3]
반대로 폴리인산 또는 폴리인산염은 보통 인산 용액을 탈수하여 형성된다. 즉, 물을 가열하고 증발시켜 물을 자꾸 제거하는 것이다.
용도
[편집]오르토인산염, 피로인산염, 삼인산염 화합물은 세제(예: 세정제) 제형에 일반적으로 사용되어 왔다. 예를 들어 삼인산 나트륨 같은 것들이 있다. 때때로 피로인산염, 삼인산염, 사인산염 등은 특히 생화학에서 인산 에스터의 일부인 경우 이인산, 삼인산, 사인산 등으로 불린다. 또한 이들은 음용수 공급업체에 의한 물때 및 부식 제어에도 사용된다.[4] 폴리인산염은 부식 방지제로서 파이프 내부 표면에 보호막을 형성하여 작용한다.[5]
인산 에스터
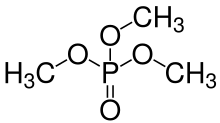
[편집]인산의 하이드록실기(–OH)는 알코올의 하이드록실기와 축합하여 인산 에스터를 형성할 수도 있다. 오르토인산은 3개의 하이드록실기를 갖고 있기 때문에 1, 2 또는 3개의 알코올 분자와 에스터화하여 모노 에스터, 다이에스터 또는 트라이에스터를 형성할 수 있다. 오른쪽에 오르토인산 에스터(또는 일인산 에스터)의 일반 구조 이미지가 표시되어 있으며, 여기서 R기 중 하나는 수소 또는 유기 라디칼일 수 있다. 이인산 에스터 및 삼인산 에스터 등도 또한 가능하다. 이러한 에스터 분자의 인산염에 있는 하이드록실기는 H+ 이온을 잃고 음이온을 형성할 수 있으며, 이는 다시 용액의 pH에 따라 달라진다. 생화학에는 많은 종류의 일인산, 이인산, 삼인산 화합물(본질적으로 에스터)이 있으며, 이들 중 다수는 아데노신 이인산(ADP) 및 아데노신 삼인산(ATP)와 같이 대사에 중요한 역할을 한다.

같이 보기
[편집]각주
[편집]- ↑ Harwood, Laurence M.; Hodgkinson, Leslie C.; Sutherland, James K.; Towers, Patrick (1984). “Synthesis of anthracyclinones. Part 1. Regioselective alkylation of 5-hydroxyquinizarin”. 《Canadian Journal of Chemistry》 62 (10): 1922–1925. doi:10.1139/v84-329.
- ↑ Nakazawa, Koichi; Matsuura, Shin; Kusuda, Kosuke (1954). “Studies on the Application of Polyphosphoric Acid as a Condensing Agent. II”. 《Yakugaku Zasshi》 74 (5): 495–497. doi:10.1248/yakushi1947.74.5_495.
- ↑ 〈Phosphoric acid and phosphates〉. 《Encyclopedia of Chemical Technology》. New York: The Interscience Encyclopedia, Inc. 1953. 421쪽.
- ↑ “Polyphosphates for scale and corrosion control”. Tramfloc, INC. January 2009. 2010년 12월 23일에 확인함.
- ↑ “Ortho-Polyphosphate Corrosion Inhibitors” (PDF). 《Government Engineering:The Journal for Public Infrastructure》 (September–October, 2006): 48–49. 2011년 7월 11일에 원본 문서 (PDF)에서 보존된 문서. 2010년 12월 23일에 확인함.
- ↑ Parmar, Dixit; Sugiono, Erli; Raja, Sadiya; Rueping, Magnus (2014). “Complete Field Guide to Asymmetric BINOL-Phosphate Derived Brønsted Acid and Metal Catalysis: History and Classification by Mode of Activation; Brønsted Acidity, Hydrogen Bonding, Ion Pairing, and Metal Phosphates”. 《Chemical Reviews》 114 (18): 9047–9153. doi:10.1021/cr5001496. PMID 25203602.
더 읽을거리
[편집]- Schröder HC, Kurz L, Muller WE, Lorenz B (Mar 2000). “Polyphosphate in bone” (PDF). 《Biochemistry (Moscow)》 65 (3): 296–303. 2011년 8월 25일에 원본 문서 (PDF)에서 보존된 문서.
외부 링크
[편집]- Determination of Polyphosphates Using Ion Chromatography with Suppressed Conductivity Detection, Application Note 71 by Dionex
- US 3044851, Young, Donald C., "Production of ammonium phosphates and product thereof", published 1962-07-17, assigned to Collier Carbon & Chemical Co.