사이안화 칼슘
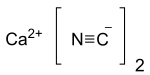
| |
| 이름 | |
|---|---|
| IUPAC 이름
calcium dicyanide
| |
| 체계명
calcium dicyanide | |
| 식별자 | |
3D 모델 (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.008.856 |
| EC 번호 |
|
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| Ca(CN)2 | |
| 몰 질량 | 92.1128 g/mol |
| 겉보기 | white powder |
| 냄새 | hydrogen cyanide |
| 밀도 | 1.853 (20 °C) |
| 녹는점 | 640 °C (1,184 °F; 913 K) (decomposes) |
| soluble | |
| 용해도 | soluble in alcohol, weak acids |
| 구조 | |
| rhombohedric | |
| 위험 | |
| NFPA 704 (파이어 다이아몬드) | |
| Non-flammable | |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
사이안화 칼슘(영어: calcium cyanide)은 화학식이 Ca(CN) 2인 무기 화합물이며, 영어로는 흑색 사이안화물(영어: black cyanide)라고도 알려져 있다.[2] 평상시에는 백색 가루나 결정, 혹은 농회색의 가루 형태로 존재하는[3] 사이안화수소의 칼슘염으로, 사이안화물의 특징인 씁쓸한 아몬드향(영어: bitter almond/amara)이 난다. 습도가 높은 공기 중에서도 가능할 정도로 쉽게 사이안화수소로 가수분해된다.[3] 많은 사이안화물과 마찬가지로 매우 유독하고, 특히 개방창(開放創), 섭취, 흡입 등의 경피섭취를 통해 쉽게 중독된다.[4]
제법
[편집]사이안화칼슘은 가루 산화칼슘을 끓고 있는 무수 사이안화 수소산(청산)을 중합체화를 통한 사이안화 수소산 손실을 최소화하기 위한 암모니아나 물 같은 가속제와 함께 반응시켜서 얻을 수 있다. 또한, 액체 상태의 사이안화 수소산을 탄화칼슘과 반응시켜서 얻는 방법과 기체 상태의 사이안화 수소산을 400°C 부근의 고온에서 생석회(CaO)와 반응시키는 방법도 있다. 후자의 경우 600°C 부근에서 반응을 진행시킬 경우 Calcium Cyanimide가 대신 생성된다.[5]
위험성
[편집]사이안화칼슘은 가연성이 없지만 가수분해할 때 발생하는 사이안화 수소산 기체는 가연성이 매우 크다. 또한, 불로써 분해될 때 유독성 기체들이 발생한다. 사이안화칼슘 자체도 매우 유독하며, 개방창(開放創), 섭취, 흡입 등의 경피섭취를 통해 쉽게 중독된다.[4] 사이안화칼슘을 섭취하거나 흡입하면 두통, 메스꺼움, 구토, 약화 등의 증상이 발생하며 그 양이 늘어갈수록 치명적인데[3] 이는 사이안화칼슘이 시토크롬c 산화효소를 억제해 호흡을 멈추기 때문이다.[6] 이러한 위험성 때문에 토양이나 공기 중의 사이안화칼슘 함량은 국제적으로 규제하고 있다.[7]
반응성
[편집]사이안화칼슘은 빠른 속도로 가수분해해 사이안화 수소산 기체를 발생시키며, 산(酸)이 있을 경우 기체 발생이 더욱 빨라진다.[3] 산화제와도 빠르게 반응하며, 사이안화암모늄과 반응시켜 탄산암모늄을 만드는 데 이용되기도 한다.
- Ca(CN) 2 + (NH 4) 2 SO 4 → 2NH 4 CN + CaSO 4.[8]
반면 이소사이안산 에스테르, 질화물, 과산화물과는 반응하지 않는다.[3]
용도
[편집]사이안화칼슘은 사이안화물을 얻기 위한 화합물로서 금이나 은 등의 귀금속을 땅에서 얻기 위한 다양한 침출 등의 광업 기법에 사용되는데,[9] 이를 위해 금속과 결합해 배위 착염을 만듦으로써 금속을 광석과 분리한다.[10] 이 작업을 위한 사이안화칼슘은 고체 플레이크 형태나 액체 상태로 이용된다.[9] 접촉, 섭취, 흡입하면 매우 유독하다는 점 때문에 사이안화칼슘은 살서제로서도 유용하여 인도갈기산미치광이(Hystrix indica, 산미치광이 참조)의 통제에도 이용되었다.[11] 비슷하게 살충제로 이용되기도 하는데,[12] 유독성이 너무 강하기에 덜 해로운 화합물로 자주 대체된다.[11] 또한 사이안화수소, 사이안화암모늄, 그리고 페로시안 화합물을 만드는 데에도 이용된다.
각주
[편집]- ↑ http://cameochemicals.noaa.gov/chemical/2775
- ↑ . "Calcium Cyanide." Merriam-Webster Dictionary. 2001. http://www.merriam-webster.com/dictionary/calcium%20cyanide (accessed April 22, 2012).
- ↑ 가 나 다 라 마 . "Calcium Cyanide." Chemical Book. 2010.http://www.chemicalbook.com/ChemicalProductProperty_EN_CB8105338.htm (accessed April 22, 2012).
- ↑ 가 나 . "Calcium Cyanide." Inchem. 2005.http://www.inchem.org/documents/icsc/icsc/eics0407.htm (accessed April 22, 2012).
- ↑ . "Production of Hydrocyanic Acid" United States Patent Office. 1933.(accessed April 22, 2012).
- ↑ . "ANTAGONISM OF EXPERIMENTAL CYANIDE TOXICITY IN RELATION TO THE IN VIVO ACTIVITY OF CYTOCHROME OXIDASE . 1968.
- ↑ . "Calcium Cyanide" World-Wide Limits for Toxic and Hazardous Chemicals in Air, Water, and Soil . 1994. http://books.google.com/books?hl=en&lr=&id=nA1xx1ZHrZkC&oi=fnd&pg=PR9&dq (accessed April 22, 2012).
- ↑ . "Ammonium Cyanide" Handbook of inorganic chemicals. 2003. ftp://pvictor.homeftp.net/public/Sci_Library/ChemLibrary/Handbooks/Patnaik[깨진 링크(과거 내용 찾기)] P. Handbook of inorganic chemicals (MGH, 2003)(T)(1125s).pdf (accessed April 22, 2012).
- ↑ 가 나 . "Use of Cyanide for the Gold Industry" International Cyanide Management Code for the Use of Cyanide in the Gold . 2011. http://www.cyanidecode.org/cyanide_use.php 보관됨 2012-02-29 - 웨이백 머신 (accessed April 22, 2012).
- ↑ . "coordination compound" Encyclopædia Britannica. Encyclopædia Britannica Online Academic Edition. 2012. http://www.britannica.com/EBchecked/topic/136410/coordination-compound.
- ↑ 가 나 . "Evaluation of Aluminium Phosphide Fumigation for the Control of Indian Crested Porcupine (Hystrix indica) in Scrublands*. 2008.
- ↑ . "CALCIUM CYANIDE FOR CHINCH-BUG CONTROL" UNIVERSITY OF ILLINOIS Agricultural Experiment Station. 1924.
