Piramidaal carbokation

Een piramidaal carbokation is een positief ion waarin de lading verdeeld is over meerdere koolstofatomen die samen een vier- of vijfzijdige piramide vormen. Het in eerste instantie meest opvallende kenmerk van deze ionen wordt gevormd door het feit dat het koolstofatoom in de top van de piramide gebonden is aan vijf of zes andere atomen. Dat aan de fundamentele vierwaardigheid van koolstof niet getornd wordt blijkt uit de theoretische beschouwing.
Geschiedenis
[bewerken | brontekst bewerken]De studie van deze kationen is geïnitieerd door resultaten welke in de computationele chemie bereikt werden. Bij het berekenen van de optimale geometrie voor het monokation dat ontstaat na afsplitsing van het chloride-ion uit 3-chloor-tricyclo(2,1,0,02,5)pentaan (structuur 1a met aan koolstofatoom 3 een chlooratoom) werd verwacht dat de drie bruggen symmetrisch onder hoeken van 120° ruimtelijk verdeeld zouden zijn. De berekeningen toonden echter aan dat de meest stabiele structuur een regelmatige vierzijdige piramide is, met aan de top een koolstofatoom dat ook nog een waterstofatoom draagt. Verder toonden de berekeningen aan dat de oorspronkelijke verwachte structuur (1b) zelfs een maximum vertegenwoordigde in de energie van het systeem, en dus geen waarschijnlijke structuur weergaf.
De dikke punt in de verticaal aangegeven binding in 1c geeft het apicale (top) koolstofatoom weer. Deze weergave is eenvoudiger dan een weergave met behulp van partiële bindingen vanuit het apicale koolstofatoom. Zoals ook uit de theoretische beschrijving blijkt, is dit ook een meer waarheidsgetrouwe weergave: het apicale koolstofatoom is met het geheel van de basale atomen verbonden, niet met elk van de samenstellende atomen. Vooral bij de homo-derivaten en het dikation heeft deze notatie voordelen.[1]
- Figuur 1: Verschillende mogelijkheden voor het (CH)5-kation.

- 1a vormt de uitgangsstof voor de berekeningen, het tricyclo(1,1,1,02,4)pent-3-yl-kation, bijvoorbeeld ontstaan uit de 3-chloor-verbinding.
- 1b is een weergave van de verwachte structuur van het intermediaire ion. De lading is gedelocaliseerd over drie koolstofatomen.
- 1c de schematische weergave van het piramidale ion.
Afhankelijk van de gebruikte rekenmethode vormt ion 1c een echt minimum in het energieoppervlak, of is het een lokaal minimum.[2][3][4][5]
Theoretische achtergrond
[bewerken | brontekst bewerken]Hoewel een complete theoretische onderbouwing uit zal gaan van de samenstellende atomen leent een lineaire combinatie van de orbitalen van het polygon dat de basis van de piramide vormt met die van het apicale koolstofatoom zich goed om een idee te krijgen van de fundamentele stabiliteit van het systeem.
Het apicale koolstofatoom
[bewerken | brontekst bewerken]Het apicale koolstofatoom draagt slechts 1 substituent. Dit koolstofatoom zal dus sp-hybridisatie vertonen. De substituent steekt ten opzichte van de piramide verder omhoog. Naar de basis van de piramide zijn drie orbitalen beschikbaar:
- De tweede sp-orbitaal. Deze orbitaal is relatief laag in energie door de bijdrage van de s-orbitaal. Ten opzichte van de knoopvlakken in de resterende p-orbitalen kan de symmetrie beschreven worden als SxSy[6], symmetrisch ten opzichte van beide vlakken. De orbitaal heeft in de richting van de basis van de piramide geen knoopvlakken. De energie van deze orbitaal in dezelfde eenheden als waarin de benadering van Hückel werkt, is lastig aan te geven, maar in ieder geval lager dan het α-niveau, omdat de s-orbitaal die ook bedraagt aan de gehybridiseerde sp-orbitaal een lagere energie heeft dan de p-orbitaal.
- Twee p-orbitalen. Deze twee orbitalen staan loodrecht op elkaar, zijn iets hoger in energie dan de sp-orbitaal en vertonen in de richting van de piramidebasis een knoopvlak. De twee knoopvlakken zijn ten opzichte van elkaar orthogonaal, de symmetrie van deze orbitalen kan als SxAy en AxSy[6] geschreven worden. De energie van deze orbitalen is in de Huckel-benadering gelijk aan α.
De piramidebasis
[bewerken | brontekst bewerken]| Figuur 2: Orbitalen van het apicale koolstofatoom (boven) en de moleculaire orbitalen van de basis (onder)[6] |
 |
| Figuur 3: Interactie tussen de apicale en basale orbitalen. De "A" bovenaan verwijst naar het apicale koolstofatoom, de "P" naar de piramidale structuur en de "B" naar de basale orbitalen. |
 |
De benadering voor de basis van de piramide gaat uit van een ring koolstofatomen die allemaal sp2gehybridiseerd zijn. Hoewel de exacte resultaten afhankelijk zijn van de ringgrootte, zijn er ook algemene conclusies te trekken:
- De laagste moleculaire orbitaal heeft gezien vanaf de top van de piramide geen knoopvlakken, de symmetrie kan dus beschreven worden als SxSy.[6] In de benadering van Hückel heeft deze orbitaal een energie van (α − 2β)
- Het volgende energieniveau wordt gevormd door twee orbitalen met gelijke energie. Gezien vanaf de top van de piramide vertonen beide orbitalen een knoopvlak. De twee knoopvlakken staan loodrecht op elkaar. De symmetrie van deze orbitalen kan als SxAy en AxSy[6] geschreven worden. De energie van deze orbitalen is afhankelijk van de ringgrootte:
- 3-ring: (α + β)
- 4-ring: α
- 5-ring: (α − 0,618β)
- 6-ring: (α − β)
Interactie tussen top en basis
[bewerken | brontekst bewerken]Om een bindende interactie te realiseren tussen atomen of molecuuldelen moet een aantal voorwaarden voldaan worden:
- de orbitalen die met elkaar gecombineerd worden moeten dezelfde symmetrie hebben.
- hoe kleiner het energieverschil tussen de orbitalen, hoe groter de energiewinst is.
Voor de basis van de piramide en de top ervan wordt aan deze voorwaarden voldaan. In figuur 2 is dat voor de symmetrie weergegeven.
- de sp-orbitaal op het apicale koolstofatoom combineert met de laagste molecuulorbitaal van de basale ring tot een lage bindende en een hoge antibindende orbitaal.
- de twee p-orbitalen op het apicale koolstofatoom combineren met de orbitalen met de bijna laagste energie van de basale ring. Dit levert twee bindende orbitalen en twee antibindende orbitalen op. In figuur 3 is een en ander weergegeven.
Het opvullen van de moleculaire orbitalen levert vervolgens voor piramides van verschillende groottes de waarden in onderstaande tabel op. Alleen bindende orbitalen zijn in het overzicht opgenomen.
| orbitaal | driezijdig | vierzijdig | vijfzijdig | zeszijdig | ||||
|---|---|---|---|---|---|---|---|---|
| orbitalen | lading | orbitalen | lading | orbitalen | lading | orbitalen | lading | |
| 1s-orbitalen op koolstof | 4 | −8 | 5 | −10 | 6 | −12 | 7 | −14 |
| σ-binding tussen waterstof en apicale koolstofatoom | 1 | −2 | 1 | −2 | 1 | −2 | 1 | −2 |
| σ-binding tussen waterstof en basis koolstofatoom | 3 | −6 | 4 | −8 | 5 | −10 | 6 | −12 |
| σ-binding tussen de basis-koolstofatoom | 3 | −6 | 4 | −8 | 5 | −10 | 6 | −12 |
| bindende moleculaire orbitaal tussen apicaal sp en laagste basis | 1 | −2 | 1 | −2 | 1 | −2 | 1 | −2 |
| bindende moleculaire orbitaal tussen apicaal p en 2e niveau basis | 2 | −4 | 2 | −4 | 2 | −4 | 2 | −4 |
| totaal aantal elektronen | −28 | −34 | −40 | −46 | ||||
| totale kernlading: (aantal zijden + 1)*(C + H) =(aantal zijden + 1)*(6+1) | +28 | +35 | +42 | +49 | ||||
| Netto lading piramidaal deeltje | 0 | 1+ | 2+ | 3+ | ||||
Voor de driezijdige piramide resulteert een neutraal molecuul, tetrahedraan. Het is overduidelijk geen piramidevormig ion. Dit is dus een alternatieve benadering in de kwantummechanische beschrijving van tetrahedraan.
De overige piramidale structuren zullen ladingen vertonen.
Voorbeelden
[bewerken | brontekst bewerken]Monokation
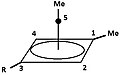
[bewerken | brontekst bewerken]- Figuur 4: Een aantal derivaten van triclo[3,1,0,02,4]pentaan (TCP) leiden tot hetzelfde piramidale carbokation. Het koolstofatoom dat de leaving group draagt wordt basaal, het koolstofatoom "tegenover" de leaving group wordt apicaal.
De met "R" aangegeven groep is ofwel 1H ofwel 2H (D):
-
4a:
3-hydroxy-1,4-dimethyl-TCP -
4b:
3-hydroxy-1,5-dimethyl-TCP -
4c:
3-methoxy-3,5-dimethyl-TCP -
4d:
Het resulterende carbokation
In 1972 worden door Masamune een aantal precursoren voor de piramidale ionen (zie figuur 4a, 4b en 4c) bij −70 °C. opgelost in super zuur milieu, een mengsel van SO2ClF en FSO3H. Op basis van zowel het 13C als het 1H-NMR-spectrum wordt aangetoond dat steeds hetzelfde intermediair ontstaat. Ook het 'blussen' van het milieu met methanol of benzoëzuur levert, uiteraard afhankelijk van het gebruikte 'blusmiddel', maar onafhankelijk van de uitgangsstof dezelfde producten, zie hieronder.[7]
| groep/atoom(!) | 13C | 1H | |
|---|---|---|---|
| 1 | 93,56 | - | 
|
| 2 / 4 | 73,00 | 4,62 | |
| 3 (als R= 1H) | 60,97 | 4,68 | |
| 5 | −23,04 | - | |
| Methyl aan 1 | 7,45 | 2,15 | |
| Methyl aan 5 | −1,03 | 1,84 | |
| (!)De koolstofatomen zijn benoemd, in het 1H-NMR zijn de aan dat koolstofatoom gebonden andere atomen bedoeld. | |||
- De toewijzing van het waterstofspectrum is deels op basis van intensiteit (de waterstofatomen aan de basale ring) deels op basis van het gegeven dat groepen naast een cyclisch onverzadigd systeem bij hogere ppm-waarden signaal geven en groepen die zich juist boven de ring bevinden bij een lagere, zelfs negatieve, waarde worden gevonden.
- Voor de toewijzing van het koolstofspectrum wordt dezelfde redenering gevolgd. Hoewel in koolstofspectra de intensiteit van het signaal en het aantal koolstofatomen dat daar verantwoordelijk voor is minder strak is dan in waterstofspectra, is bij gelijksoortige koolstofatomen (in de basale ring, allemaal met één waterstofatoom) de onderling grootteverhouding een goede graadmeter voor de aantallen.
- Masamune zelf doet geen uitspraak over de aard van het intermediaire ion, maar constateert wel dat de gevonden waarden niet overeenstemmen met die voor gelokaliseerde ionen (bijvoorbeeld het 1-butylion) of gedelokaliseerde ionen (allylion) verwacht worden, namelijk waarden in de grootteorde van 200 ppm.[9]
Reactie met methanol en benzoëzuur
[bewerken | brontekst bewerken]- Figuur 5: De reactieproducten van het piramidale monokation met methanol en benzoëzuur.
De met "R" aangegeven groep is ofwel 1H ofwel 2H (D):
-
5a = 4d
Piramidaal kation -
5c
reactieproduct met methanol
in methanol
Zoals boven reeds is aangeven, reageert het piramidale ion 5a - onafhankelijk van hoe het gemaakt is - met methanol en benzoëzuur en geeft dan producten die onafhankelijk van de uitgangsstof zijn, maar wel bepaald worden door het gebruikte reagens en milieu zoals overduideklijk uit het substitutiepatroon blijkt. Masamune[7][8] kan in 1972 geen verklaring geven. Met behulp van het HSAB-principe is in te zien dat de reacties met behulp van deze theorie te verklaren zijn.
Masamune berekent[5] dat in het niet-gesubstitueerde ion een groot deel van de lading op waterstofatomen terechtkomt. Door de waterstofatomen te vervangen door koolstofatomen - volgens de tabel van Pauling elektronegatiever dan waterstof (2,5 tegenover 2,1), zal de lading meer geconcentreerd worden op de koolstofatomen van het skelet, met name die atomen die geen waterstof dragen. Dit heeft de volgende effecten:
- het basale moleculair orbitaal-systeem zal niet meer beschikken over twee ontaarde niveaus. Bij nadering vanaf de onderzijde van de piramide (aan de bovenzijde is het basale moleculair orbitaal
-systeem niet benaderbaar) zal interactie met het ook op één punt asymmetrische verstoorde π-systeem van benzoëzuur tot oriëntatie in een bepaalde conformatie leiden. Een interactie waarbij de positieve lading op koolstof 1 van het piramidale kation weinig of geen interactie geeft met de partiële lading op het koolstof naast de carbonzuurgroep in benzoëzuur zal daarbij het meest gunstig zijn. Dit wordt gerealiseerd door de carbonzuurgroep te oriënteren bij de koolstofatomen 2 of 4 van het piramidale ion. Het uiteindelijke reactieproduct wordt via een close-ion-pair gevormd. De vorming van de binding tussen de benzoëgroep en koolstof 2 zal tot gevolg hebben dat, naast de bruggen 1-5 en 3-5, koolstof 4 met het apicale koolstofatoom (5) een binding vormt. Reactie op koolstof 4 zal een vergelijkbaar effect hebben, waarbij echter dezelfde - zij het spiegelsymmetrische - verbinding ontstaat.
- in het basale systeem zal een duidelijk zwaartepunt van de lading ontstaan (op het koolstofatoom met de methylgroep). Methanol, met zijn harde base op zuurstof, zal het ion vooral op het zwaartepunt van de positieve lading benaderen en daar reageren. Koolstof 1 gaat de methoxygroep dragen, waarbij naast de bruggen 2-5 en 4-5, tussen koolstof 3 en 5 een nieuwe binding ontstaat.
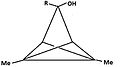
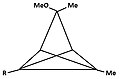
Bishomomonocarbokation
[bewerken | brontekst bewerken]In de chemie betekent het voorvoegsel "homo" dat een homoloog, een gelijksoortige verbinding met één, of in dit geval twee, extra CH2-groepen beschreven wordt. De bishomo-ionen hebben met elkaar gemeen dat de basale ring nu geen cyclobutadieen is maar een 1,4-cyclohexadieenring.
-
Bishomocarbokation met brug tussen de homo-atomen
-
De vlakken waarin de atomen van de dubbele bindingen liggen zijn hier aangegeven, de π-orbitalen staan loodrecht op deze vlakken
-
Bishomocarbokation zonder brug tussen de homo-atomen
De stabiliteit van deze ionen is voor een deel te danken aan het feit dat alle atomen rond een dubbele binding in principe in een plat vlak liggen. Voor de cyclohexa-1,4-dieenring betekent dit dat de atomen van de ring "op de bladzijden van een niet helemaal opengeslagen boek liggen". De twee vlakken waarin de atomen rond de dubbele bindingen liggen maken een hoek met elkaar. De p-orbitalen staan loodrecht op deze vlakken, waardoor de toppen van deze orbitalen naar elkaar toe buigen. De interactie met de orbitalen op het apicale koolstofatoom blijft goed mogelijk. Als de configuratie stijver gemaakt wordt door een extra brug tussen de posities 3 en 6 van de cyclohexadieenring, wordt het geheel zelfs stabieler.
Dikation
[bewerken | brontekst bewerken]Volgens de berekening in de tabel zal een vijfzijdig piramidaal ion een lading van +2 hebben. Berekeningen[10] en praktisch werk[11][12][13] bevestigen dit.
Spectroscopisch onderzoek van de dubbele oxidatie van benzeen bij zeer lage temperatuur (onder 4 K) toont aan dat eerst een hexagonaal dikation gevormd wordt, dat legt echter snel om naar de piramidale vorm:[13]
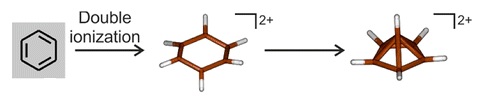
Het dikation is verder vooral beschreven als het hexamethylderivaat en enkele nauw daaraan verwante ionen.
Vroege synthese
[bewerken | brontekst bewerken]De in de jaren 70 van de 20e eeuw beschreven syntheseroute start met hexamethyldewarbenzeen (stof I in tabel 4) dat met Cl2 wordt omgezet in 5,6-dichloor-1,2,3,4,5,6-hexamethylbicyclo[2,1,1]hex-2-een (stof II in tabel 4). Oplossen van deze stof in fluorsulfonzuur leidt tot het dikation (stof III in tabel 4).

|

|

|
| I: Me6-dewarbenzeen | II: Reactieproducte van Me6-dewarbenzeen met chloor | III: het piramidale dikation |
Dat hier in de fluorsulfonzuuroplossing een piramidaal ion aanwezig moet zijn blijkt uit het 1H- en 13C-NMR-spectrum (Tabel 5).
| Intensiteit | 1H | 13CSingulet | 13CQuartet |
|---|---|---|---|
| 1 | 1,96(s) | 22,5 | −2,0 |
| 5 | 2,65(s) | 126,3 | 10,6 |
De toewijzing van de signalen gebeurt op basis van de intensiteit. De conclusie dat het om een piramidaal ion moet gaan wordt getrokken uit het feit dat de plaats van de signalen niet overeenkomt met de positie die voor andere ionen verwacht mag worden.[10]
Nieuwe synthese
[bewerken | brontekst bewerken]

Pogingen om op basis van de synthese van het basision ook uit hexamethylbenzeen het hexamethylderivaat van dikathion te bereiden waren niet succesvol.[14] Een wijzigingen van de door Hogeveen gebruikte benadering werd in 2016 beschreven, in combinatie met een kristallografische karakterisering van . Het piramidale deel van het ion is ongeveer 185 pm hoog en alle methylgroepen aan de basale vijfring zijn iets opgetild ten opzichte van het vlak van de ring, waardoor de koolstofatomen een omgekeerde tetraëdrische geometrie vertonen: alle substituenten liggen aan één zijde van het koolstofatoom. De syntheseroute verliep via de reactie van het mono-epoxide van hexamethyldewarbenzeen met magisch zuur, dat netto een oxide-ion, , onttrekt aan het molecuul en het dikation vormt:[14]

Hoewel indirecte spectroscopische en theoretische aanwijzingen voor het bestaan van het ion door Hogeveen etal[10][11][12] al langer bekend waren, was de eerste directe waarneming en isolatie ervan wetenschappelijk wereldnieuws[14] De piramidale structuur werd opnieuw bevestigd.[15][16] Omdat de structuur ongebruikelijk was, trok het artikel internationaal veel aandacht.[14][15][16][17]
Het ongebruikelijke zit in het feit dat het lijkt alsof koolstof hier zeswaardig is. De valentie van koolstof blijft echter gewoon 4, omdat de bindingen tussen het "gekke" koolstof-atoom en vijf van de zes eraan gebonden koolstof-atomen geen 2-elektron-bindingen zijn. Pedagogisch is het echter een mooi voorbeeld dat er hier wel sprake is van een hyper gecoördineerd, maar niet van een hypervalent atoom.[17] Steven Bachrach heeft dit verschil duidelijk aangetoond en ook de aromaticiteit van het ion verklaard.[18] De beschrijving van binding in deeltjes als het -ion werd al in 1975 geopperd en kort daarna ook spectroscopisch zeer aannemelijk gemaakt.[19][20][21][22]
Structuur van het ion
[bewerken | brontekst bewerken]In het dikation is de bindingsorde voor de band tussen het top-koolstofatoom en die in de basis van de piramide ongeveer 0,54 per basis-atoom. Dit leidt tot een totale binding tussen top en basis van 5 * 0,54 = 2,70 wat kleiner is dan 3. Het topatoom heeft ook nog een gewone binding, waarmee de totale bindingsorde voor het topatoom op 3,70 komt. De conclusie is daarmee dat de binding eerder hypo- dan hyper-valent is, hoewel de hypercoördinatie wel overeind blijft.[18] De verschillen ten gevolge van het aromatische karakter van de basale ring en de relatief zwakke basis-top-bindingen vertaalt zich ook in verschillen in atomaire afstanden tussen de verschillende koolstofatomen. De basale C-C-binding heeft een afstand tussen 143,9 en 144,5 pm, de basale methylgroepen staan tussen 147,9 en 148,95 pm van de basale koolstofatomen vandaan. De C-C-afstand tussen basis en top ligt tussen 169,4–171,5 pm.[14] In zijn beschrijving gebruikt Bachrach een ring - er zijn 4 elektronen in het π-systeem- , die gecombineerd wordt met een blok dat twee elektronen bijdraagt. Hiermee worden zes elektronen geleverd, waarmee voldaan wordt aan de regel van Huckel met n = 1.[18].
Het ion legt ook een relatie met de organometaalchemie: het kan gezien worden als [22] waarmee de beschrijving wijzigt naar een koolstof C4+ dat gekoppeld is aan een aromatisch η5–pentamethylcyclopentadienyl-systeem, waarmee aan de octetregel voldaan wordt (een zes-elektronendonor in de basis van de piramide en een twee elektronendonor in de methylgroep aan de top van de piramide). Er treedt dan een analogie op met de monomere structuur in de gasfase van de organozink-verbinding , waarin dezelfde liganden gebonden zijn aan zink[II], en daar voldoen aan de 18-elektronenregel voor metaalcomplexen.[23][24]

|

| |
| Structuur van , getekend door Bachrach[18] | Sctructuur van het analoge |
Reacties van het dikation
[bewerken | brontekst bewerken]
De reacties van het piramidale dikation kunnen in drie groepen verdeeld worden:[11][12]
- Thermische reactie. Het piramidale dikation is stabiel tot 40 °C, daarboven treedt reactie op. Er wordt een hydride-ion opgenomen, waarna het ion irreversibel omlegt naar een geprotoneerd Meisenheimercomplex dat in het fluorsulfonzuur, waarin het ion gemaakt is, stabiel is.
- Met geladen nucleofielen (hydride, methoxide, hydroxide) ontstaat steeds reversibel een tricycloverbinding met het nucleofiel steeds op dezelfde plek: bijvoorbeeld (met methoxide) 2,4-dimethoxy-tricyclo[3,1,0,03,6]tricyclohexaan.
- Met ongeladen nucleofielen (het tertiaire triethylamine) wordt in feite een reversibele zuur-basereactie uitgevoerd, waarbij feitelijk een dimethyleenderivaat van benzvaleen ontstaat.
Anders gesubstitueerde dikationen
[bewerken | brontekst bewerken]Het reactieproduct van het dikation met tri-ethylamine biedt mogelijkheden om ook andere substitutiepatronen te introduceren in het ion.[25] Een of beide dubbele bindingen in het molecuul kunnen geoxideerd worden tot een keton. Dit keton kan vervolgens reageren met een alkylmetaalverbinding waarbij gealkyleerde hydroxybindingen ontstaan. De verbindingen hebben één of twee afwijkende alkylgroepen afhankelijk van het aantal ketongroepen. Wordt deze alcohol weer opgelost in fluorsulfonzuur dan ontstaan piramidale dikationen, met de R-groepen uitsluitend aan de basale koolstofatomen gekoppeld. De niet aan R-groepen gekoppelde koolstofatomen dragen nog steeds methylgroepen.

|

|

|

|

|
| I: Het reactieproduct met Et3N | II: Het monoketon | III: tot monoalkohol gealkyleerd keton | IV: Het piramidale ion bij eerste keer oplossen in FSO3H | V: Het piramidale ion bij tweede keer oplossen in FSO3H |

|

|

|

| |
| II: Het diketon | III: tot diol gealkyleerd keton | IV: Het piramidale ion bij eerste keer oplossen in FSO3H | V: Het piramidale ion bij tweede keer oplossen in FSO3H |
Tot dit punt maakt het substitutiepatroon van het piramidale dikation blijkbaar weinig uit. Een duidelijk verschil wordt wel gevonden in de stabiliteit van de ionen van het type V (Tabel 6): bij −40 °C is het ion met een ethylgroep als afwijkende substituent stabiel, is de R-groep een i-propylgroep dan is er bij deze temperatuur na 48 uur niets meer over.
Driewaardige ionen
[bewerken | brontekst bewerken]Ten tijde van het literatuuronderzoek voor dit lemma (eind 1978) waren er geen artikelen bekend met betrekking tot drie- of meerwaardige ionen.
Trivia
[bewerken | brontekst bewerken]Opgemerkt kan worden dat:
"het heel belangrijk is dat men zich realiseert dat, hoewel wij leren dat koolstof slechts vier vrienden kan hebben, koolstof geassocieerd kan zijn met meer dan vier atomen, en daar aan toe te voegen dat in dit geval koolstof niet zes bindingen vormt op de manier waarop we gewoonlijk denken over de koolstof-koolstof-binding als een twee-elektronenband."
("[i]t's super important that people realize that, although we're taught carbon can only have four friends, carbon can be associated with more than four atoms" and added that the "carbon isn't making six bonds in the sense that we usually think of a carbon-carbon bond as a two-electron bond.")[17]
"Het gaat allemaal om de uitdaging en de mogelijkheid chemici te verbazen over wat er allemaal mogelijk kan zijn"
("It is all about the challenge and the possibility to astonish chemists about what can be possible.")[15]
- De sectie Dikation of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Hexamethylbenzene op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ W.D. Stohrer, R. Hoffmann. (1972). GEEN TITEL OPGEGEVEN J.Amer.Chem.Soc. 94 pag.: 1661
- ↑ M.J.S. Dewar, R.C. Haddon. (1973). GEEN TITEL OPGEGEVEN J.Amer.Chem.Soc.. 95 pag.: 5836
- ↑ W.J. Hehre, P.V.R. Schleyer. (1973). GEEN TITEL OPGEGEVEN J.Amer.Chem.Soc.. 95 pag.: 5837
- ↑ M.J.S. Dewar. (1975). GEEN TITEL OPGEGEVEN Pure and Applied Chemistry. 44 pag.: 767
- ↑ a b S. Masamune. (1975). GEEN TITEL OPGEGEVEN Pure and Applied Chemistry. 44 pag.: 861
- ↑ a b c d e De S geeft aan dat de orbitaal symmetrisch is ten opzichte van de in het subscript aangegeven vlak. Is de orbitaal antisymmetrisch, dat wil zeggen dat het in het subscript aangegeven vlak een knoopvlak is en het teken van de orbitaal aan weerszijden van dit vlak tegengesteld is, dan wordt een A gebruikt.
- ↑ a b S. Masamune, M. Sakai, H. Ona. (1972). GEEN TITEL OPGEGEVEN J.Amer.Chem.Soc.. 94 pag.: 8955
- ↑ a b S. Masamune, M. Sakai, H. Ona, A.J. Jones. (1972). GEEN TITEL OPGEGEVEN J.Amer.Chem.Soc.. 94 pag.: 8956
- ↑ G.A. Olah, D.J. Donovan, G. Prakash. (1978). GEEN TITEL OPGEGEVEN Tetrahedron Letters. pag.: 4779
- ↑ a b c H. Hogeveen, P. Kwant, J.Postma, P. v. Duynen. (1974). GEEN TITEL OPGEGEVEN Tetrahedron Letters. 1974 pag.: 4351
- ↑ a b c H. Hogeveen, P. Kwant. (1974). GEEN TITEL OPGEGEVEN J.Amer.Chem.Soc.. 96 pag.: 2208
- ↑ a b c H. Hogeveen, P. Kwant. (1973). GEEN TITEL OPGEGEVEN Tetrahedron Letters. 1973 pag.: 1665
- ↑ a b Jašík, Juraj, Gerlich, Dieter, Roithová, Jana (2014). Probing Isomers of the Benzene Dication in a Low-Temperature Trap. J. Am. Chem. Soc. 136 (8): 2960–2962. PMID 24528384. DOI: 10.1021/ja412109h.
- ↑ a b c d e Malischewski, Moritz, Seppelt, Konrad (2017). Crystal Structure Determination of the Pentagonal-Pyramidal Hexamethylbenzene Dication C6(CH3)62+. Angew. Chem. Int. Ed. 56 (1): 368–370. PMID 27885766. DOI: 10.1002/anie.201608795.
- ↑ a b c Boyle, Rebecca (14 January 2017). Carbon seen bonding with six other atoms for the first time. New Scientist (3108). Gearchiveerd van origineel op 16 January 2017. Geraadpleegd op 14 January 2017.
- ↑ a b Ritter, Stephen K. (19 december 2016). Six bonds to carbon: Confirmed. Chem. Eng. News 94 (49). DOI: 10.1021/cen-09449-scicon007. Gearchiveerd van origineel op 9 January 2017.
- ↑ a b c Hamers, Laurel (24 december 2016). Carbon can exceed four-bond limit. Science News 190 (13). Gearchiveerd van origineel op 3 February 2017.
- ↑ a b c d Bachrach, Steven M., A six-coordinate carbon atom. comporgchem.com (17 January 2017). Gearchiveerd op 19 January 2017. Geraadpleegd op 18 January 2017.
- ↑ Hogeveen, Hepke, Kwant, Peter W. (1973). Direct observation of a remarkably stable dication of unusual structure: (CCH3)62⊕. Tetrahedron Lett. 14 (19): 1665–1670. DOI: 10.1016/S0040-4039(01)96023-X.
- ↑ Hogeveen, Hepke, Kwant, Peter W., Postma, J., van Duynen, P. Th. (1974). Electronic spectra of pyramidal dications, (CCH3)62+ and (CCH)62+. Tetrahedron Lett. 15 (49–50): 4351–4354. DOI: 10.1016/S0040-4039(01)92161-6.
- ↑ Hogeveen, Hepke, Kwant, Peter W. (1974). Chemistry and spectroscopy in strongly acidic solutions. XL. (CCH3)62+, an unusual dication. J. Am. Chem. Soc. 96 (7): 2208–2214. DOI: 10.1021/ja00814a034.
- ↑ a b Hogeveen, Hepke, Kwant, Peter W. (1975). Pyramidal mono- and dications. Bridge between organic and organometallic chemistry. Acc. Chem. Res. 8 (12): 413–420. DOI: 10.1021/ar50096a004.
- ↑ Haaland, Arne, Samdal, Svein, Seip, Ragnhild (1978). The molecular structure of monomeric methyl(cyclopentadienyl)zinc, (CH3)Zn(η-C5H5), determined by gas phase electron diffraction. J. Organomet. Chem. 153 (2): 187–192. DOI: 10.1016/S0022-328X(00)85041-X.
- ↑ Elschenbroich, Christoph (2006). Organometallics, 3rd. John Wiley & Sons, "Organometallic Compounds of Groups 2 and 12", 59–85. ISBN 9783527805143.
- ↑ G. Giordano, R. Heldeweg, H. Hogeveen. (1977). GEEN TITEL OPGEGEVEN J.Amer.Chem.Soc. 99 pag.: 5151





![{\displaystyle {\ce {[C6(CH3)5(C2H5)]^{2+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b0fe932f108f6a6b81f7f4f1c3011143c5e37fe8)
![{\displaystyle {\ce {[C6(CH3)6]^{2+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fe392184aa71507f3dd88c95f381cb8e11935cf1)

![{\displaystyle {\ce {[C6(CH3)6][SbF6]2.HSO3F}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1aa72ab48e54168263cb78a7fe2415d5dab430ed)




![{\displaystyle {\ce {[(\eta^{5}-C5(CH3)5)C(CH3)]^{2+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c0a0188a1ee29dc23edfd394b4eabd8b7ef9c0e6)

