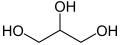
Hydroksyaceton
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||
| Wzór sumaryczny |
C3H6O2 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
74,08 g/mol | ||||||||||||||||||||||||
| Wygląd |
bezbarwna, gęsta ciecz[1] | ||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||
Hydroksyaceton, acetol – organiczny związek chemiczny z grupy α-hydroksyketonów (α-ketoli). Jest pochodną acetonu zawierającą grupę hydroksylową przy atomie węgla 1.
Występowanie
[edytuj | edytuj kod]Występuje naturalnie jako metabolit m.in. człowieka, myszy czy bakterii E. Coli[2]. Jest produktem pośrednim w metabolizmie glicyny, seryny i treoniny[3].
Otrzymywanie
[edytuj | edytuj kod]Można otrzymać go np. przez:
- dehydratację gliceryny w obecności katalizatora kwasowego[6]:
- reakcję bromoacetonu z mrówczanem sodu lub potasu bądź z octanem sodu lub potasu, a następnie hydrolizę tak otrzymanego estru z użyciem metanolu[7]
Zastosowanie
[edytuj | edytuj kod]Stosowany jest jako reduktor, m.in. w przemyśle tekstylnym w procesach barwienia (zastępuje sukcesywnie inne związki ze względu na łatwość degradacji), w przemyśle spożywczym jako środek zapachowy do żywności, składnik samoopalaczy, a także w syntezie organicznej, np. do otrzymywania acetonu, glikolu propylenowego, aldehydu propionowego lub pochodnych furanu[6], a także diacetylu (w wyniku kondensacji z formaldehydem)[8].
Zobacz też
[edytuj | edytuj kod]Przypisy
[edytuj | edytuj kod]- ↑ a b c d e f g h i j k l Hydroxyacetone, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 032470 [dostęp 2019-12-05] (niem. • ang.).
- ↑ hydroxyacetone, [w:] Chemical Entities of Biological Interest [online], European Bioinformatics Institute, CHEBI:27957 [dostęp 2019-12-05] (ang.).
- ↑ Hydroxyacetone, [w:] Human Metabolome Database [online], Genome Canada, HMDB0006961 [dostęp 2019-12-05] (ang.).
- ↑ Ron M. Painter, David M. Pearson, Robert M. Waymouth, Selective Catalytic Oxidation of Glycerol to Dihydroxyacetone, „Angewandte Chemie International Edition”, 49 (49), 2010, s. 9456–9459, DOI: 10.1002/anie.201004063 (ang.).
- ↑ Hardo Siegel, Manfred Eggersdorfer, Ketones, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 15, DOI: 10.1002/14356007.a15_077 (ang.).
- ↑ a b Tiago Pinheiro Braga, Nadine Essayem, Antoninho Valentini, Synthesis of Cu–MxOy/Al2O3 (M = Fe, Zn, W or Sb) catalysts for the conversion of glycerol to acetol: effect of texture and acidity of the supports, „RSC Advances”, 5 (113), 2015, s. 93394–93402, DOI: 10.1039/C5RA16166E (ang.).
- ↑ P.A. Levene, A. Walti, Acetol, „Organic Syntheses”, 10 (1), 1930, DOI: 10.15227/orgsyn.010.0001.
- ↑ Herbert Leube i inni, Textile Dyeing, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 60, 65, 125, 128, DOI: 10.1002/14356007.a26_351 (ang.).