RAF1
| RAF1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | v-raf-1 murine leukemia viral oncogene-like protein 1cRafC-Raf proto-oncogeneserine/threonine kinasev-raf-1 murine leukemia viral oncogene homolog 1raf proto-oncogene serine/threonine protein kinaseproto-oncogene c-RAFRAF1Raf-1Oncogene RAF1RAF proto-oncogene serine/threonine-protein kinase | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние ID | GeneCards: [1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
RAF1 («RAF прото-онкогенная серин/треониновая протеинкиназа»; англ. RAF proto-oncogene serine/threonine-protein kinase; КФ:2.7.11.25), или c-RAF («прото-онкоген c-RAF»; англ. proto-oncogene c-RAF) — цитозольная серин/треониновая протеинкиназа семейства MAP3K[англ.][1]. Продукт гена RAF1[2][3]. Является частью сигнального пути ERK1/2 в качестве митоген-активируемой протеинкиназы MAP3K, которая действует ниже по каскаду семейства мембрано-связанных ГТФаз Ras[4]. Raf1 — член семейства серин/треониновых протеинкиназ Raf.
Открытие
[править | править код]Первый ген Raf, а именно v-Raf был открыт в 1983 году. Он был выделен из ретровируса мыши 3611. Вскоре было показано, что этот белок способен трансформировать фибробласты в раковую клеточную линию, поэтому ему було дано название вирус-индуцированная быстро распространяющаяся фибросаркома, или v-Raf (Virus-induced Rapidly Accelerated Fibrosarcoma; V-RAF)[2]. Через год в 1984 году другой трансформирующий ген был обнаружен в птичьем ретровирусе MH2 и назван v-Mil. Он оказался крайне похож на v-Raf[5]. Оказалось, что оба открытых гена кодируют продукт с серин-треониновой киназной активностью[6]. Гомологи v-Raf и v-Mil были вскоре найдены в геномах мыши и курицы, которые были названы c-Raf от клеточный (cellular) ген Raf. Стало ясно, что c-Raf играет роль в регуляции роста и деления клетки[7][8]. Теперь известно, что c-Raf является основой сигнального пути ERK1/2, первого описанного сигнального пути митоген-активируемых киназ MAPK[9]. Он действует как митоген-активируемая киназа, инициирующая весь последующий киназный каскад. Нормальные клеточные гены c-Raf могут мутировать и превращаться в онкогены за счёт повышения активностей MEK1/2 and ERK1/2[10].
Структура
[править | править код]Ген RAF1 человека расположен на 3-й хромосоме. Альтернативный сплайсинг приводит к образованию двух изоформ белка с лишь небольшой разницей между вариантами. Основной вариант протеинкиназы короче и состоит из 648 аминокислот[11].

Подобно многим другим MAP3K протеинкиназам c-Raf является мультидоменным белком с несколькими дополнительными доменами, которые отвечают за регуляцию его каталитической активности. На N-конце белка рядом друг с другом находятся Ras-связывающий домен (RBD) и гомолог C-киназного домена 1 (C1). Структура обоих доменов была изучена и показала механизм регуляции c-Raf.
Ras-связывающий домен содержит убиквитин-подобный участок подобно многим другим домена, связывающим G-белки. Он специфически связывает только ГТФ-ассоциированные Ras белки[12][13][14].
Домен C1 белка c-Raf расположен сразу за RBD и представляет собой цинковый палец, обогащённый цистеинами и стабилизированный 2 ионами цинка. Он похож на диацилглицерин-связывающие домены C1 белков семейства протеинкиназ C (PKC)[15][16]. Однако, в отличие от PKC, домен C1 в c-Raf не связывает диацилглицерин[17]. Они связывают другие липиды, такие как церамид[17] или фосфатидная кислота[18] и, более того, облегчают распознавание активированного ГТФ-связанного Ras (ГТФ-Ras)[16][19].
Близкая расположенность двух регулайторных доменов и экспериментальные данные предполагают, что они действуют координированно как единый элемент, который отрицательно регулирует активность киназного домена c-Raf за счёт физического взаимодействия[20]. Исторически аутоингибирующий блок обозначают как регион CR1, соединяющий участок — CR2, а киназный домен — CR3.
Между аутоингибирующим доменом и каталитичеким киназным доменом расположен продолжительный сегмент, обогащённый серином, аминокислотная последовательность которого сильно варьирует между генами Raf. Этот регион внутренне неструктурированный и очень подвижный. По всей видимости, он служит «шарниром» между двумя жёсткими струкрутными доменами, который позволяет осуществлять существенные конформационные перестройки внутри молекулы киназы[21]. Тем не менее, этот шарнирный регион содержит один небольшой консервативный мотив, который отвечает за распознавание регуляторного белка 14-3-3, когда критический для этого процесса остаток серина (у человека серин-259) в молекуле c-Raf фосфорилирован. Кроме этого, второй похожий мотив в c-Raf находится на C-конце за киназным доменом.
C-концевую половину c-Raf занимает каталитический домен. Структура этих доменов хорошо изучена как в c-Raf[22], так и в B-Raf[23]. Киназный домен c-Raf похож на таковой других киназ Raf и белков KSR и напоминает каталитический домен некоторых других MAP3K киназ, включая семейство киназ MLK. Вместе эти ферменты составляют группу киназ TKL (тирозинкиназо-подобные белки). Хотя эти белки обладают некоторыми характеристиками тирозинкиназ, активность белков TKL ограничена фосфорилированием серина и треонина только определённых белков-мишеней. Наиболее важные субстраты киназ Raf — киназы MKK1 и MKK2, активность которых строго регулируется этим фосфорилированием, осуществляемым белками Raf.
Эволюция киназ Raf
[править | править код]Белок c-Raf человека входит в семейство родственных протеинкиназ. Два других члена группы, обнаруженных у большинства позвоночных — B-Raf и A-Raf. Все три белка сходны своей доемнной архитектурой, структурой и регуляцией. В отличие от хорошо изученных c-Raf и B-Raf точные функции другого члена группы A-Raf не извеестны, хотя предполагается, что они должны быть сходными. Все три гена группы, по-видимому, являются продуктами дубликации гена-предшественника Raf или целого генома на заре эволюции позвоночных. Большинство других организмов имеют единственный ген Raf. Например, у фруктовой мушки дрозофилы это ген Phl, или Draf[24], а у C. elegans — ген Lin-45[25].

Многоклеточные организмы имеют тип киназы близкородственный с Raf — киназный супрессор Ras (KSR). У позвоночных животных два паралога гена KSR: KSR1 и KSR2. Их C-концевой киназный домен похож на таковой у Raf, однако регуляторный N-терминальный домен у них отличается. Хотя у KSR тоже есть шарнирный регион, у него отсутствует Ras-связывающий домен. Вместо последнего расположен уникальный регуляторный домен CA1. Структура была раскрыта в 2012 году и содержит домен SAM-мотив с добавочной двуспиральной областью (coiled coil), т. н. CC-SAM, который помогает белкам KSR при мембранном связывании[26]. KSR, так же, как и Raf, содержат двойной мотив связывания с белками 14-3-3, требующий фосфорилирования, но, кроме этого, они содержат на шарнирном участке другие MAPK-связывающие мотивы. Типичная последовательность последних, -FxFP-, играет важную роль в регуляции Raf-киназ в сигнальных путях ERK1/2. KSR участвуют в тех же сигнальных путях, что и киназы Raf, но играют пти этом второстепенную роль. Их внутренняя киназная активность настолько низкая, что долгое время они считались неактивными[27][28]. Их роль в фосфорилировании несущественна и, по-видимому, в основном KSR являются партнёрами в гетеродимеризации с киназами Raf, значительно активируя их за счёт аллостерического эффекта. Подобные эффекты были описаны и для других MAP3K киназ. Например, ASK2 обладает низкой ферментативной активностью сам по себе и его действие связано с образованием гетеродимера ASK1/ASK2[29].
Raf-подобные киназы полностью отсутствуют у грибов. Однако у других заднежгутиковых (в частности, у Capsaspora owczarzaki) были обнаружены гены Raf-киназ, что подтверждает наличие их у одноклеточных эукариот. Это говорит о том, что белки Raf имеют древнюю эволюционную историю и грибы, возможно, потеряли ген Raf позже. У грибов сигнальные пути аналогичные ERK1/2 обеспечиваются другими MEKK-подобными киназами (Ste11 у дрожжей).
Наоборот, вирусные Raf киназы (v-Raf) являются вторичным заимствованием генов позвоночных у их организмов-хозяинов. Эти гены являются значительно укороченными версиями, у которых отсутствуют аутоингибирующий N-концевой домен и 14-3-3-связывающие мотивы, что приводит к некотролируемой активности вирусной Raf киназы, что и необходимо вирусу для эффективной репродукции.
Регуляция активности
[править | править код]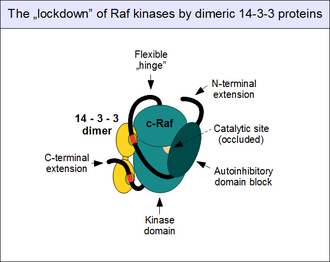
Активность c-Raf строго регулируется. Как главный пусковой механизм сигнального пути ERK1/2 — активация c-Raf — предохраняется множеством ингибирующих механизмов и в норме белок не может быть активирован в результате лишь одного-единственного шага. Наиболее важный регуляторный механизм — прямое физическое взаимодействие N-терминального аутоингибирующего блока c-Raf с его киназным доменом. В результате этого каталитический сайт белка оказывается физически закрыт и ферментативная активность киназы — полностью заблокирована[20]. Такая «закрытая» форма может быть изменена только, если аутоингибирующий блок белка взаимодействует с белком-партнёром, конкурирующим с собственным киназным доменом, главным образом с ГТФ-связанным Ras. Такие активированные G-белки могут разорвать внутримолекулярное взаимодействие, что в результате изменяет конформацию c-Raf и переводит его в «открытую» форму[32] необходимую для киназной активации и связывания субстрата.
Белок 14-3-3 также вносит вклад в аутоингибирование c-Raf. Известно, что белки 14-3-3 образуют димеры и, таким образом, имеют два связывающих участка[33]. За счёт этого димер 14-3-3 действует как «молекулярный замок», удерживая потенциально связывающие белки-партнёры на безопасном расстоянии и ориентации от c-Raf. Таким образом, димер 14-3-3 (в частности 14-3-3ζ), будучи вовлечён во взаимодействие с c-Raf, запирает киназу в «закрытом» состоянии и не позволяет разделение аутоингибирующего и каталитического доменов белка[34]. Такое «запирание» c-Raf, как и других представителей Raf и KSR, контролируется фосфорилированием 14-3-3-связывающего мотива на «шарнирном» участке белка. Оно невозможно без предварительного фосфорилирования определённых серинов (у c-Raf человека — это серины 259 и 621) другими протеинкиназами. Наиболее важной из этих киназ является MAP3K7/TAK1, а ферменты, отвечающие за дефосфорилирование этих аминокислот — фасфатаза PP1 и фосфатазный комплекс PP2A[35][36].
Само по себе связывание 14-3-3 с Raf не обязательно является ингибирующим фактором. Когда Raf находится в открытой форме и образует димер 14-3-3 может связаться с Raf в транс-конфигурации и, таким образом замкнуть киназу в её димерной форме вместо предотвращения этого взаимодействия, отделяя их друг от друга[37]. Существуют также некоторые другие формы взаимодействия 14-3-3 с Raf, однако их роль неизвестна[38].
Димеризация c-Raf является другим важным механизмом регуляции активности киназы и требует фосфорилирования активационной петли белка. В норме только открытые киназные домены участвуют в димеризации. В отличие от B-Raf, который образует гомодимер, c-Raf предпочтительно формирует гетеродимер с B-Raf или KSR1. Тем не менее гомо- и гетеродимеры функционируют сходным образом[28].
Для достижения полной активности и стабилизации активной конформации необходимым этапом является фосфорилирование активационной петли c-Raf. Единственными известными киназами, которые способны это сделать — сами киназы семейства Raf. Хотя некоторые другие киназы, такие как PAK1, способны фосфорилировать аминокислотные остатки, расположенные вблизи киназного домена c-Raf, роль этих поддерживающих неизвестна. Активационная петля c-Raf может быть трансфосфорилирована либо другой молекулой c-Raf, либо KSR1. По причине структурных особенностей димеров такое фосфорилирование может осуществляться исключительно в транс-конфигурации (то есть киназы одного димера могут фосфорилировать только остатки другого димера при образовании промежуточного четырёхмолекулярного комплекса)[39]. После взаимодействия с остатками аргинина и лизина киназного домена фосфорилированная активирующая петля меняет конформацию на строгоупорядоченную форму и замыкает киназный домен в полностью активированной форме вплоть до дефосфорилирования петли. При этом киназный домен становится нечувствительным к аутоингибирующему домену[40]. У KSR отсутствуют участки фосфорилирования в активирующей петле, поэтому у этих белков отсутствует последний этап активации, однако это уже несущественно, поскольку активированная киназа Raf уже способна распознавать свой субстрат[41]. Как и большинство протеинкиназ c-Raf имеет несколько возможных субстратов. c-Raf напрямую фосфорилирует BAD[42], несколько типов аденилатциклаз[43], фосфатазу лёгких цепей миозина (MYPT)[44], тропонин (TnTc)[45] и некоторые другие, включая белок ретинобластомы (pRb) и фосфатаза Cdc25[46].
Наиболее важные мишени киназы Raf — MKK1(MEK1) и MKK2(MEK2). Несмотря на то, что структура фермент-субстратного комплекса c-Raf:MKK1 неизвестна, он может быть моделирован комплексом KSR2:MKK1[28]. Хотя сам комплекс KSR2:MKK1 неактивен, считается, что он очень близок к тому как Raf связывает субстрат. Основная взаимодействующая интерфаза формируется C-концевыми регионами обоих киназных доменов. Большая неупорядоченная пролин-обогащённая петля, уникальная для MKK1 и MKK2, также играер важую роль в правильном ориентировании Raf (или KSR)[47]. В результате реакции после связывания с Raf MKK1 или MKK2 фосфорилируются в двух положениях в своей активирующей петле и переходят сами в активную форму. Мишенями этих киназ MKK1 или MKK2 в последующем киназном каскаде являются ERK1 и ERK2, соответственно. Киназы ERK способны воздействовать на многочисленные субстраты в клетке. Кроме этого, после транслокации в ядро они способны стимулировать ядерные факторы транскрипции. Активированные ERK — плейотропные эффекторы клеточной физиологии и играют важную роль в контроле экспресси генов, вовлечённых в клеточное деление, миграцию, ингибирование апоптоза и дифференцировку.
Патология
[править | править код]Мутации с повышенной активностью
[править | править код]Наследственные мутации с повышенной активностью c-Raf встречаются довольно редко, но приводят к серьёзным синдромам. Чаще всего такие нарушения вызываются точечными мутациями в одном из двух участков связывания 14-3-3[48][49]. Мутации c-Raf — одна из причин синдрома Нунан, характерные черты которого: врождённые пороки сердца, низкорослость, дисморфизм и др. нарушения. Похожие нарушения могут также вызывать т. н. синдром LEOPARD с комплексом дефектов.
Роль в онкологических заболеваниях
[править | править код]Хотя c-Raf может мутировать в экспериментальных условиях и изредка встечается в опухолях человека[50][51], основную роль в онкогенезе человека играет киназа B-Raf[52].
Около 20 % опухолей человека содержат мутированный ген B-Raf[53]. Наиболее часто встречается мутация, включающая замену валина-600 на глутаминовую кислоту, продукт которой (BRAF-V600E) может быть визуализован с помощью гистохимического анализа для молекулярной клинической диагностики[54][55]. Это изменение структурно сходно с фосфорилированной формой активирующей петли белка и, снимая один из ингибирующих механизмов, приводит к быстрой полной активации киназы[56]. Поскольку B-Raf способна активироваться при образовании гомодимера или гетеродимера с c-Raf, подобная мутация приводит к катастрофическим последствиям, делая сигнальный путь ERK1/2 постоянно активным и приводя к неконтролируемому процессу клеточного деления[57].
Терапевтическай мишень
[править | править код]Важная роль мутаций генов Ras и B-Raf в онкогенезе объясняет их роль как потенциальных мишеней для противораковой терапии, в частности, такой мишенью является мутация B-Raf V600E. Специфический ингибитор Сорафениб стал первым таким клинически полезным агентом, который стал фармакологической альтернативой для лечения ранее, как правило, неизлечимых онкологических опухолей, таких как почечная клеточная карцинома и меланома[58]. Другие такие агенты включают Вемурафениб, Регорафениб, Dabrafenib и др.
Однако эти ингибиторы B-Raf могут иметь неблагоприятный эффект на K-Ras-зависимые опухоли, поскольку являются слишком селективными, действуя только на B-Raf. Они эффективно инибируют активность B-Raf в случае, когда мутация B-Raf является главной причиной возникновения опухоли. Но они также усиливают гомодимеризацию B-Raf и его гетеродимеризацию с c-Raf, что в результате повышает активирование c-Raf в случае, если в генах Raf нет мутаций, но есть мутация в гене их активатора K-Ras[22]. Такая парадоксальная активация вызывает необходимость предварительной генетической диагностики до начала терапии с инибиторами B-Raf[59].
Взаимодействия
[править | править код]C-Raf взаимодействует с многочисленными клеточными белками, включая следующие:
- AKT1[60],
- ASK1[61],
- BAG1[62],
- BRAF[63],
- Bcl-2[64],
- CDC25A[65][66],
- CFLAR[67],
- FYN[68],
- GRB10[69][70],
- HRAS[71][72][73][74][75][76][77][78][79][80][81][82][83][84][85][86][87],
- HSP90AA1[88][89],
- KRAS[76][77],
- MAP2K1[90],
- MAP3K1[91],
- MAPK7[92],
- MAPK8IP3[93][94],
- PAK1[95],
- PEBP1[90],
- PHB[96],
- PRKCZ[97],
- RAP1A[12][81][98][99],
- RHEB[100][101][102],
- RRAS2[76][103],
- RB1[96][104],
- RBL2[104],
- SHOC2[76],
- STUB1[88],
- Src[68],
- TSC22D3[105],
- YWHAB[75][97][106][107][108][109],
- YWHAE[108][109],
- YWHAG[97][110][111],
- YWHAH[97][108][112],
- YWHAQ[90][97][110][113],
- YWHAZ[97][114][115][116][117].
Литература
[править | править код]- Reed J. C., Zha H., Aime-Sempe C., Takayama S., Wang H. G. Structure-function analysis of Bcl-2 family proteins. Regulators of programmed cell death (англ.) // Advances in Experimental Medicine and Biology[англ.] : journal. — Springer Nature, 1997. — Vol. 406. — P. 99—112. — doi:10.1007/978-1-4899-0274-0_10. — PMID 8910675.
- Geyer M., Fackler O. T., Peterlin B. M. Structure–function relationships in HIV-1 Nef (англ.) // EMBO Rep.[англ.] : journal. — 2001. — Vol. 2, no. 7. — P. 580—585. — doi:10.1093/embo-reports/kve141. — PMID 11463741. — PMC 1083955.
- Dhillon A. S., Kolch W. Untying the regulation of the Raf-1 kinase (англ.) // Archives of Biochemistry and Biophysics[англ.] : journal. — Elsevier, 2002. — Vol. 404, no. 1. — P. 3—9. — doi:10.1016/S0003-9861(02)00244-8. — PMID 12127063.
- Greenway A. L., Holloway G., McPhee D. A., Ellis P., Cornall A., Lidman M. HIV-1 Nef control of cell signalling molecules: multiple strategies to promote virus replication (англ.) // J. Biosci.[англ.] : journal. — 2004. — Vol. 28, no. 3. — P. 323—335. — doi:10.1007/BF02970151. — PMID 12734410.
- Chen H., Kunnimalaiyaan M., Van Gompel J. J. Medullary thyroid cancer: the functions of raf-1 and human achaete-scute homologue-1 (англ.) // Thyroid : journal. — 2006. — Vol. 15, no. 6. — P. 511—521. — doi:10.1089/thy.2005.15.511. — PMID 16029117.
Примечания
[править | править код]- ↑ Li P., Wood K., Mamon H., Haser W., Roberts T. Raf-1: a kinase currently without a cause but not lacking in effects (англ.) // Cell : journal. — Cell Press, 1991. — February (vol. 64, no. 3). — P. 479—482. — doi:10.1016/0092-8674(91)90228-Q. — PMID 1846778.
- ↑ 1 2 Rapp U. R., Goldsborough M. D., Mark G. E., Bonner T. I., Groffen J., Reynolds F. H., Stephenson J. R. Structure and biological activity of v-raf, a unique oncogene transduced by a retrovirus (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1983. — July (vol. 80, no. 14). — P. 4218—4222. — doi:10.1073/pnas.80.14.4218. — . — PMID 6308607. — PMC 384008.
- ↑ Bonner T., O'Brien S. J., Nash W. G., Rapp U. R., Morton C. C., Leder P. The human homologs of the raf (mil) oncogene are located on human chromosomes 3 and 4 (англ.) // Science : journal. — 1984. — January (vol. 223, no. 4631). — P. 71—4. — doi:10.1126/science.6691137. — . — PMID 6691137.
- ↑ Entrez Gene: RAF1 v-raf-1 murine leukemia viral oncogene homolog 1. Архивировано 10 апреля 2010 года.
- ↑ Sutrave P., Bonner T. I., Rapp U. R., Jansen H. W., Patschinsky T., Bister K. Nucleotide sequence of avian retroviral oncogene v-mil: homologue of murine retroviral oncogene v-raf (англ.) // Nature. — 1984. — Vol. 309, no. 5963. — P. 85—8. — doi:10.1038/309085a0. — . — PMID 6325930.
- ↑ Moelling K., Heimann B., Beimling P., Rapp U. R., Sander T. Serine- and threonine-specific protein kinase activities of purified gag-mil and gag-raf proteins (англ.) // Nature : journal. — 1984. — Vol. 312, no. 5994. — P. 558—561. — doi:10.1038/312558a0. — . — PMID 6438534.
- ↑ Kolch W., Heidecker G., Lloyd P., Rapp U. R. Raf-1 protein kinase is required for growth of induced NIH/3T3 cells (англ.) // Nature : journal. — 1991. — January (vol. 349, no. 6308). — P. 426—428. — doi:10.1038/349426a0. — . — PMID 1992343.
- ↑ Mark G. E., Rapp U. R. Primary structure of v-raf: relatedness to the src family of oncogenes (англ.) // Science : journal. — 1984. — April (vol. 224, no. 4646). — P. 285—289. — doi:10.1126/science.6324342. — . — PMID 6324342.
- ↑ Kyriakis J. M., App H., Zhang X. F., Banerjee P., Brautigan D. L., Rapp U. R., Avruch J. Raf-1 activates MAP kinase-kinase (англ.) // Nature. — 1992. — July (vol. 358, no. 6385). — P. 417—421. — doi:10.1038/358417a0. — . — PMID 1322500.
- ↑ Shimizu K., Nakatsu Y., Nomoto S., Sekiguchi M. Structure of the activated c-raf-1 gene from human stomach cancer (англ.) // Int. Symp. Princess Takamatsu Cancer Res. Fund : journal. — 1986. — Vol. 17. — P. 85—91. — PMID 2843497.
- ↑ Dozier C., Ansieau S., Ferreira E., Coll J., Stehelin D. An alternatively spliced c-mil/raf mRNA is predominantly expressed in chicken muscular tissues and conserved among vertebrate species (англ.) // Oncogene : journal. — 1991. — August (vol. 6, no. 8). — P. 1307—1311. — PMID 1886707.
- ↑ 1 2 Nassar N., Horn G., Herrmann C., Scherer A., McCormick F., Wittinghofer A. The 2.2 A crystal structure of the Ras-binding domain of the serine/threonine kinase c-Raf1 in complex with Rap1A and a GTP analogue (англ.) // Nature : journal. — 1995. — June (vol. 375, no. 6532). — P. 554—560. — doi:10.1038/375554a0. — . — PMID 7791872.
- ↑ Emerson S. D., Madison V. S., Palermo R. E., Waugh D. S., Scheffler J. E., Tsao K. L., Kiefer S. E., Liu S. P., Fry D. C. Solution structure of the Ras-binding domain of c-Raf-1 and identification of its Ras interaction surface (англ.) // Biochemistry : journal. — 1995. — May (vol. 34, no. 21). — P. 6911—6918. — doi:10.1021/bi00021a001. — PMID 7766599.
- ↑ Moodie S. A., Willumsen B. M., Weber M. J., Wolfman A. Complexes of Ras.GTP with Raf-1 and mitogen-activated protein kinase kinase (англ.) // Science : journal. — 1993. — June (vol. 260, no. 5114). — P. 1658—1661. — doi:10.1126/science.8503013. — . — PMID 8503013.
- ↑ Mott H. R., Carpenter J. W., Zhong S., Ghosh S., Bell R. M., Campbell S. L. The solution structure of the Raf-1 cysteine-rich domain: a novel ras and phospholipid binding site (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1996. — August (vol. 93, no. 16). — P. 8312—8317. — doi:10.1073/pnas.93.16.8312. — . — PMID 8710867. — PMC 38667.
- ↑ 1 2 Daub M., Jöckel J., Quack T., Weber C. K., Schmitz F., Rapp U. R., Wittinghofer A., Block C. The RafC1 cysteine-rich domain contains multiple distinct regulatory epitopes which control Ras-dependent Raf activation (англ.) // Mol. Cell. Biol. : journal. — 1998. — November (vol. 18, no. 11). — P. 6698—6710. — doi:10.1128/mcb.18.11.6698. — PMID 9774683. — PMC 109253.
- ↑ 1 2 Yin X., Zafrullah M., Lee H., Haimovitz-Friedman A., Fuks Z., Kolesnick R. A ceramide-binding C1 domain mediates kinase suppressor of ras membrane translocation (англ.) // Cell. Physiol. Biochem.[англ.] : journal. — 2009. — Vol. 24, no. 3—4. — P. 219—230. — doi:10.1159/000233248. — PMID 19710537. — PMC 2978518.
- ↑ Kraft C. A., Garrido J. L., Fluharty E., Leiva-Vega L., Romero G. Role of phosphatidic acid in the coupling of the ERK cascade (англ.) // J. Biol. Chem. : journal. — 2008. — December (vol. 283, no. 52). — P. 36636—36645. — doi:10.1074/jbc.M804633200. — PMID 18952605. — PMC 2606017.
- ↑ Brtva T. R., Drugan J. K., Ghosh S., Terrell R. S., Campbell-Burk S., Bell R. M., Der C. J. Two distinct Raf domains mediate interaction with Ras (англ.) // J. Biol. Chem. : journal. — 1995. — April (vol. 270, no. 17). — P. 9809—9812. — doi:10.1074/jbc.270.17.9809. — PMID 7730360.
- ↑ 1 2 Cutler R. E., Stephens R. M., Saracino M. R., Morrison D. K. Autoregulation of the Raf-1 serine/threonine kinase (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1998. — August (vol. 95, no. 16). — P. 9214—9219. — doi:10.1073/pnas.95.16.9214. — . — PMID 9689060. — PMC 21318.
- ↑ Hmitou I., Druillennec S., Valluet A., Peyssonnaux C., Eychène A. Differential regulation of B-raf isoforms by phosphorylation and autoinhibitory mechanisms (англ.) // Mol. Cell. Biol. : journal. — 2007. — January (vol. 27, no. 1). — P. 31—43. — doi:10.1128/MCB.01265-06. — PMID 17074813. — PMC 1800654.
- ↑ 1 2 Hatzivassiliou G., Song K., Yen I., Brandhuber B. J., Anderson D. J., Alvarado R., Ludlam M. J., Stokoe D., Gloor S. L., Vigers G., Morales T., Aliagas I., Liu B., Sideris S., Hoeflich K. P., Jaiswal B. S., Seshagiri S., Koeppen H., Belvin M., Friedman L. S., Malek S. RAF inhibitors prime wild-type RAF to activate the MAPK pathway and enhance growth (англ.) // Nature : journal. — 2010. — March (vol. 464, no. 7287). — P. 431—435. — doi:10.1038/nature08833. — . — PMID 20130576.
- ↑ Wan P. T., Garnett M. J., Roe S. M., Lee S., Niculescu-Duvaz D., Good V. M., Jones C. M., Marshall C. J., Springer C. J., Barford D., Marais R. Mechanism of activation of the RAF-ERK signaling pathway by oncogenic mutations of B-RAF (англ.) // Cell : journal. — Cell Press, 2004. — March (vol. 116, no. 6). — P. 855—867. — doi:10.1016/S0092-8674(04)00215-6. — PMID 15035987.
- ↑ Mark G. E., MacIntyre R. J., Digan M. E., Ambrosio L., Perrimon N. Drosophila melanogaster homologs of the raf oncogene (англ.) // Mol. Cell. Biol. : journal. — 1987. — June (vol. 7, no. 6). — P. 2134—2140. — doi:10.1128/mcb.7.6.2134. — PMID 3037346. — PMC 365335.
- ↑ Chong H., Vikis H. G., Guan K. L. Mechanisms of regulating the Raf kinase family (англ.) // Cell. Signal.[англ.] : journal. — 2003. — May (vol. 15, no. 5). — P. 463—469. — doi:10.1016/S0898-6568(02)00139-0. — PMID 12639709.
- ↑ Koveal D., Schuh-Nuhfer N., Ritt D., Page R., Morrison D. K., Peti W. A CC-SAM, for coiled coil-sterile α motif, domain targets the scaffold KSR-1 to specific sites in the plasma membrane (англ.) // Sci Signal[англ.] : journal. — 2012. — December (vol. 5, no. 255). — P. ra94. — doi:10.1126/scisignal.2003289. — PMID 23250398. — PMC 3740349.
- ↑ Hu J., Yu H., Kornev A. P., Zhao J., Filbert E. L., Taylor S. S., Shaw A. S. Mutation that blocks ATP binding creates a pseudokinase stabilizing the scaffolding function of kinase suppressor of Ras, CRAF and BRAF (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2011. — April (vol. 108, no. 15). — P. 6067—6072. — doi:10.1073/pnas.1102554108. — . — PMID 21441104. — PMC 3076888.
- ↑ 1 2 3 Brennan D. F., Dar A. C., Hertz N. T., Chao W. C., Burlingame A. L., Shokat K. M., Barford D. A Raf-induced allosteric transition of KSR stimulates phosphorylation of MEK (англ.) // Nature : journal. — 2011. — April (vol. 472, no. 7343). — P. 366—369. — doi:10.1038/nature09860. — . — PMID 21441910.
- ↑ Ortner E., Moelling K. Heteromeric complex formation of ASK2 and ASK1 regulates stress-induced signaling (англ.) // Biochem. Biophys. Res. Commun.[англ.] : journal. — 2007. — October (vol. 362, no. 2). — P. 454—459. — doi:10.1016/j.bbrc.2007.08.006. — PMID 17714688.
- ↑ Matallanas D., Birtwistle M., Romano D., Zebisch A., Rauch J., von Kriegsheim A., Kolch W. Raf family kinases: old dogs have learned new tricks (англ.) // Genes Cancer : journal. — 2011. — Vol. 2, no. 3. — P. 232—260. — doi:10.1177/1947601911407323. — PMID 21779496. — PMC 3128629.
- ↑ Alexa A., Varga J., Reményi A. Scaffolds are 'active' regulators of signaling modules (англ.) // FEBS J.[англ.] : journal. — 2010. — Vol. 277, no. 21. — P. 4376—4382. — doi:10.1111/j.1742-4658.2010.07867.x. — PMID 20883493.
- ↑ Terai K., Matsuda M. Ras binding opens c-Raf to expose the docking site for mitogen-activated protein kinase kinase (англ.) // EMBO Rep.[англ.] : journal. — 2005. — March (vol. 6, no. 3). — P. 251—255. — doi:10.1038/sj.embor.7400349. — PMID 15711535. — PMC 1299259.
- ↑ Liu D., Bienkowska J., Petosa C., Collier R. J., Fu H., Liddington R. Crystal structure of the zeta isoform of the 14-3-3 protein (англ.) // Nature : journal. — 1995. — July (vol. 376, no. 6536). — P. 191—194. — doi:10.1038/376191a0. — . — PMID 7603574.
- ↑ Fischer A., Baljuls A., Reinders J., Nekhoroshkova E., Sibilski C., Metz R., Albert S., Rajalingam K., Hekman M., Rapp U. R. Regulation of RAF activity by 14-3-3 proteins: RAF kinases associate functionally with both homo- and heterodimeric forms of 14-3-3 proteins (англ.) // J. Biol. Chem. : journal. — 2009. — January (vol. 284, no. 5). — P. 3183—3194. — doi:10.1074/jbc.M804795200. — PMID 19049963.
- ↑ Rodriguez-Viciana P., Oses-Prieto J., Burlingame A., Fried M., McCormick F. A phosphatase holoenzyme comprised of [sic] Shoc2/Sur8 and the catalytic subunit of PP1 functions as an M-Ras effector to modulate Raf activity (англ.) // Mol. Cell[англ.] : journal. — 2006. — April (vol. 22, no. 2). — P. 217—230. — doi:10.1016/j.molcel.2006.03.027. — PMID 16630891.
- ↑ Jaumot M., Hancock J. F. Protein phosphatases 1 and 2A promote Raf-1 activation by regulating 14-3-3 interactions (англ.) // Oncogene : journal. — 2001. — July (vol. 20, no. 30). — P. 3949—3958. — doi:10.1038/sj.onc.1204526. — PMID 11494123.
- ↑ Tzivion G., Luo Z., Avruch J. A dimeric 14-3-3 protein is an essential cofactor for Raf kinase activity (англ.) // Nature : journal. — 1998. — July (vol. 394, no. 6688). — P. 88—92. — doi:10.1038/27938. — . — PMID 9665134.
- ↑ Molzan M., Ottmann C. Synergistic binding of the phosphorylated S233- and S259-binding sites of C-RAF to one 14-3-3ζ dimer (англ.) // J. Mol. Biol.[англ.] : journal. — 2012. — November (vol. 423, no. 4). — P. 486—495. — doi:10.1016/j.jmb.2012.08.009. — PMID 22922483.
- ↑ McKay M. M., Freeman A. K., Morrison D. K. Complexity in KSR function revealed by Raf inhibitor and KSR structure studies (англ.) // Small GTPases : journal. — 2011. — Vol. 2, no. 5. — P. 276—281. — doi:10.4161/sgtp.2.5.17740. — PMID 22292131. — PMC 3265819.
- ↑ Chong H., Guan K. L. Regulation of Raf through phosphorylation and N terminus-C terminus interaction (англ.) // J. Biol. Chem. : journal. — 2003. — September (vol. 278, no. 38). — P. 36269—36276. — doi:10.1074/jbc.M212803200. — PMID 12865432.
- ↑ Shi F., Lemmon M. A. Biochemistry. KSR plays CRAF-ty (англ.) // Science. — 2011. — May (vol. 332, no. 6033). — P. 1043—1044. — doi:10.1126/science.1208063. — . — PMID 21617065.
- ↑ Ye D. Z., Jin S., Zhuo Y., Field J. p21-Activated kinase 1 (Pak1) phosphorylates BAD directly at serine 111 in vitro and indirectly through Raf-1 at serine 112 (англ.) // PLoS ONE : journal / Bauer, Joseph Alan. — 2011. — Vol. 6, no. 11. — P. e27637. — doi:10.1371/journal.pone.0027637. — . — PMID 22096607. — PMC 3214075.
- ↑ Ding Q., Gros R., Gray I. D., Taussig R., Ferguson S. S., Feldman R. D. Raf kinase activation of adenylyl cyclases: isoform-selective regulation (англ.) // Mol. Pharmacol.[англ.] : journal. — 2004. — October (vol. 66, no. 4). — P. 921—928. — doi:10.1124/mol.66.4.921. — PMID 15385642.
- ↑ Broustas C. G., Grammatikakis N., Eto M., Dent P., Brautigan D. L., Kasid U. Phosphorylation of the myosin-binding subunit of myosin phosphatase by Raf-1 and inhibition of phosphatase activity (англ.) // J. Biol. Chem. : journal. — 2002. — January (vol. 277, no. 4). — P. 3053—3059. — doi:10.1074/jbc.M106343200. — PMID 11719507.
- ↑ Pfleiderer P., Sumandea M. P., Rybin V. O., Wang C., Steinberg S. F. Raf-1: a novel cardiac troponin T kinase (неопр.) // J. Muscle Res. Cell. Motil.. — 2009. — Т. 30, № 1—2. — С. 67—72. — doi:10.1007/s10974-009-9176-y. — PMID 19381846. — PMC 2893395.
- ↑ Hindley A., Kolch W. Extracellular signal regulated kinase (ERK)/mitogen activated protein kinase (MAPK)-independent functions of Raf kinases (англ.) // Journal of Cell Science[англ.] : journal. — The Company of Biologists[англ.], 2002. — April (vol. 115, no. Pt 8). — P. 1575—1581. — PMID 11950876.
- ↑ Catling A. D., Schaeffer H. J., Reuter C. W., Reddy G. R., Weber M. J. A proline-rich sequence unique to MEK1 and MEK2 is required for raf binding and regulates MEK function (англ.) // Mol. Cell. Biol. : journal. — 1995. — October (vol. 15, no. 10). — P. 5214—5225. — doi:10.1128/mcb.15.10.5214. — PMID 7565670. — PMC 230769.
- ↑ Pandit B., Sarkozy A., Pennacchio L. A., Carta C., Oishi K., Martinelli S., Pogna E. A., Schackwitz W., Ustaszewska A., Landstrom A., Bos J. M., Ommen S. R., Esposito G., Lepri F., Faul C., Mundel P., López Siguero J. P., Tenconi R., Selicorni A., Rossi C., Mazzanti L., Torrente I., Marino B., Digilio M. C., Zampino G., Ackerman M. J., Dallapiccola B., Tartaglia M., Gelb B. D. Gain-of-function RAF1 mutations cause Noonan and LEOPARD syndromes with hypertrophic cardiomyopathy (англ.) // Nat. Genet. : journal. — 2007. — August (vol. 39, no. 8). — P. 1007—1012. — doi:10.1038/ng2073. — PMID 17603483.
- ↑ Molzan M., Schumacher B., Ottmann C., Baljuls A., Polzien L., Weyand M., Thiel P., Rose R., Rose M., Kuhenne P., Kaiser M., Rapp U. R., Kuhlmann J., Ottmann C. Impaired binding of 14-3-3 to C-RAF in Noonan syndrome suggests new approaches in diseases with increased Ras signaling (англ.) // Mol. Cell. Biol. : journal. — 2010. — October (vol. 30, no. 19). — P. 4698—4711. — doi:10.1128/MCB.01636-09. — PMID 20679480. — PMC 2950525.
- ↑ Storm S. M., Rapp U. R. Oncogene activation: c-raf-1 gene mutations in experimental and naturally occurring tumors (англ.) // Toxicol. Lett.[англ.] : journal. — 1993. — April (vol. 67, no. 1—3). — P. 201—210. — doi:10.1016/0378-4274(93)90056-4. — PMID 8451761. Архивировано 13 февраля 2020 года.
- ↑ Zebisch A., Staber P. B., Delavar A., Bodner C., Hiden K., Fischereder K., Janakiraman M., Linkesch W., Auner H. W., Emberger W., Windpassinger C., Schimek M. G., Hoefler G., Troppmair J., Sill H. Two transforming C-RAF germ-line mutations identified in patients with therapy-related acute myeloid leukemia (англ.) // Cancer Research[англ.] : journal. — American Association for Cancer Research[англ.], 2006. — April (vol. 66, no. 7). — P. 3401—3408. — doi:10.1158/0008-5472.CAN-05-0115. — PMID 16585161.
- ↑ Emuss V., Garnett M., Mason C., Marais R. Mutations of C-RAF are rare in human cancer because C-RAF has a low basal kinase activity compared with B-RAF (англ.) // Cancer Research[англ.] : journal. — American Association for Cancer Research[англ.], 2005. — November (vol. 65, no. 21). — P. 9719—9726. — doi:10.1158/0008-5472.CAN-05-1683. — PMID 16266992.
- ↑ Forbes S. A., Bindal N., Bamford S., Cole C., Kok C. Y., Beare D., Jia M., Shepherd R., Leung K., Menzies A., Teague J. W., Campbell P. J., Stratton M. R., Futreal P. A. COSMIC: mining complete cancer genomes in the Catalogue of Somatic Mutations in Cancer (англ.) // Nucleic Acids Res. : journal. — 2011. — January (vol. 39, no. Database issue). — P. D945—50. — doi:10.1093/nar/gkq929. — PMID 20952405. — PMC 3013785.
- ↑ Capper D., Berghoff A. S., Magerle M., Ilhan A., Wöhrer A., Hackl M., Pichler J., Pusch S., Meyer J., Habel A., Petzelbauer P., Birner P., von Deimling A., Preusser M. Immunohistochemical testing of BRAF V600E status in 1,120 tumor tissue samples of patients with brain metastases (англ.) // Acta Neuropathol.[англ.] : journal. — 2012. — Vol. 123, no. 2. — P. 223—233. — doi:10.1007/s00401-011-0887-y. — PMID 22012135.
- ↑ Capper D., Preusser M., Habel A., Sahm F., Ackermann U., Schindler G., Pusch S., Mechtersheimer G., Zentgraf H., von Deimling A. Assessment of BRAF V600E mutation status by immunohistochemistry with a mutation-specific monoclonal antibody (англ.) // Acta Neuropathol.[англ.] : journal. — 2011. — Vol. 122, no. 1. — P. 11—9. — doi:10.1007/s00401-011-0841-z. — PMID 21638088.
- ↑ Tran N. H., Wu X., Frost J. A. B-Raf and Raf-1 are regulated by distinct autoregulatory mechanisms (англ.) // J. Biol. Chem. : journal. — 2005. — April (vol. 280, no. 16). — P. 16244—16253. — doi:10.1074/jbc.M501185200. — PMID 15710605.
- ↑ Garnett M. J., Rana S., Paterson H., Barford D., Marais R. Wild-type and mutant B-RAF activate C-RAF through distinct mechanisms involving heterodimerization (англ.) // Mol. Cell[англ.] : journal. — 2005. — December (vol. 20, no. 6). — P. 963—969. — doi:10.1016/j.molcel.2005.10.022. — PMID 16364920.
- ↑ Maurer G., Tarkowski B., Baccarini M. Raf kinases in cancer-roles and therapeutic opportunities (англ.) // Oncogene : journal. — 2011. — August (vol. 30, no. 32). — P. 3477—3488. — doi:10.1038/onc.2011.160. — PMID 21577205.
- ↑ Kim D. H., Sim T. Novel small molecule Raf kinase inhibitors for targeted cancer therapeutics (англ.) // Arch. Pharm. Res.[англ.] : journal. — 2012. — March (vol. 35, no. 4). — P. 605—615. — doi:10.1007/s12272-012-0403-5. — PMID 22553052.
- ↑ Zimmermann S., Moelling K. Phosphorylation and regulation of Raf by Akt (protein kinase B) (англ.) // Science : journal. — 1999. — November (vol. 286, no. 5445). — P. 1741—1744. — doi:10.1126/science.286.5445.1741. — PMID 10576742.
- ↑ Chen J., Fujii K., Zhang L., Roberts T., Fu H. Raf-1 promotes cell survival by antagonizing apoptosis signal-regulating kinase 1 through a MEK-ERK independent mechanism (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2001. — July (vol. 98, no. 14). — P. 7783—7788. — doi:10.1073/pnas.141224398. — . — PMID 11427728. — PMC 35419.
- ↑ Wang H. G., Takayama S., Rapp U. R., Reed J. C. Bcl-2 interacting protein, BAG-1, binds to and activates the kinase Raf-1 (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1996. — July (vol. 93, no. 14). — P. 7063—7068. — doi:10.1073/pnas.93.14.7063. — . — PMID 8692945. — PMC 38936.
- ↑ Weber C. K., Slupsky J. R., Kalmes H. A., Rapp U. R. Active Ras induces heterodimerization of cRaf and BRaf (англ.) // Cancer Research[англ.] : journal. — American Association for Cancer Research[англ.], 2001. — May (vol. 61, no. 9). — P. 3595—3598. — PMID 11325826.
- ↑ Wang H. G., Rapp U. R., Reed J. C. Bcl-2 targets the protein kinase Raf-1 to mitochondria (англ.) // Cell : journal. — Cell Press, 1996. — November (vol. 87, no. 4). — P. 629—638. — doi:10.1016/s0092-8674(00)81383-5. — PMID 8929532.
- ↑ Galaktionov K., Jessus C., Beach D. Raf1 interaction with Cdc25 phosphatase ties mitogenic signal transduction to cell cycle activation (англ.) // Genes Dev. : journal. — 1995. — May (vol. 9, no. 9). — P. 1046—1058. — doi:10.1101/gad.9.9.1046. — PMID 7744247.
- ↑ Huang T. S., Shu C. H., Yang W. K., Whang-Peng J. Activation of CDC 25 phosphatase and CDC 2 kinase involved in GL331-induced apoptosis (англ.) // Cancer Research[англ.] : journal. — American Association for Cancer Research[англ.], 1997. — July (vol. 57, no. 14). — P. 2974—2978. — PMID 9230211.
- ↑ Kataoka T., Budd R. C., Holler N., Thome M., Martinon F., Irmler M., Burns K., Hahne M., Kennedy N., Kovacsovics M., Tschopp J. The caspase-8 inhibitor FLIP promotes activation of NF-kappaB and Erk signaling pathways (англ.) // Curr. Biol. : journal. — 2000. — June (vol. 10, no. 11). — P. 640—648. — doi:10.1016/s0960-9822(00)00512-1. — PMID 10837247.
- ↑ 1 2 Cleghon V., Morrison D. K. Raf-1 interacts with Fyn and Src in a non-phosphotyrosine-dependent manner (англ.) // J. Biol. Chem. : journal. — 1994. — July (vol. 269, no. 26). — P. 17749—17755. — PMID 7517401.
- ↑ Nantel A., Huber M., Thomas D. Y. Localization of endogenous Grb10 to the mitochondria and its interaction with the mitochondrial-associated Raf-1 pool (англ.) // J. Biol. Chem. : journal. — 1999. — December (vol. 274, no. 50). — P. 35719—35724. — doi:10.1074/jbc.274.50.35719. — PMID 10585452.
- ↑ Nantel A., Mohammad-Ali K., Sherk J., Posner B. I., Thomas D. Y. Interaction of the Grb10 adapter protein with the Raf1 and MEK1 kinases (англ.) // J. Biol. Chem. : journal. — 1998. — April (vol. 273, no. 17). — P. 10475—10484. — doi:10.1074/jbc.273.17.10475. — PMID 9553107.
- ↑ Stang S., Bottorff D., Stone J. C. Interaction of activated Ras with Raf-1 alone may be sufficient for transformation of rat2 cells (англ.) // Mol. Cell. Biol. : journal. — 1997. — June (vol. 17, no. 6). — P. 3047—3055. — doi:10.1128/MCB.17.6.3047. — PMID 9154803. — PMC 232157.
- ↑ Germani A., Prabel A., Mourah S., Podgorniak M. P., Di Carlo A., Ehrlich R., Gisselbrecht S., Varin-Blank N., Calvo F., Bruzzoni-Giovanelli H. SIAH-1 interacts with CtIP and promotes its degradation by the proteasome pathway (англ.) // Oncogene : journal. — 2003. — December (vol. 22, no. 55). — P. 8845—8851. — doi:10.1038/sj.onc.1206994. — PMID 14654780.
- ↑ Mitin N. Y., Ramocki M. B., Zullo A. J., Der C. J., Konieczny S. F., Taparowsky E. J. Identification and characterization of rain, a novel Ras-interacting protein with a unique subcellular localization (англ.) // J. Biol. Chem. : journal. — 2004. — May (vol. 279, no. 21). — P. 22353—22361. — doi:10.1074/jbc.M312867200. — PMID 15031288.
- ↑ Vargiu P., De Abajo R., Garcia-Ranea J. A., Valencia A., Santisteban P., Crespo P., Bernal J. The small GTP-binding protein, Rhes, regulates signal transduction from G protein-coupled receptors (англ.) // Oncogene : journal. — 2004. — January (vol. 23, no. 2). — P. 559—568. — doi:10.1038/sj.onc.1207161. — PMID 14724584.
- ↑ 1 2 Yuryev A., Wennogle L. P. Novel raf kinase protein-protein interactions found by an exhaustive yeast two-hybrid analysis (англ.) // Genomics : journal. — 2003. — February (vol. 81, no. 2). — P. 112—125. — doi:10.1016/s0888-7543(02)00008-3. — PMID 12620389.
- ↑ 1 2 3 4 Li W., Han M., Guan K. L. The leucine-rich repeat protein SUR-8 enhances MAP kinase activation and forms a complex with Ras and Raf (англ.) // Genes Dev. : journal. — 2000. — April (vol. 14, no. 8). — P. 895—900. — PMID 10783161. — PMC 316541.
- ↑ 1 2 Kiyono M., Kato J., Kataoka T., Kaziro Y., Satoh T. Stimulation of Ras guanine nucleotide exchange activity of Ras-GRF1/CDC25(Mm) upon tyrosine phosphorylation by the Cdc42-regulated kinase ACK1 (англ.) // J. Biol. Chem. : journal. — 2000. — September (vol. 275, no. 38). — P. 29788—29793. — doi:10.1074/jbc.M001378200. — PMID 10882715.
- ↑ Janoueix-Lerosey I., Pasheva E., de Tand M. F., Tavitian A., de Gunzburg J. Identification of a specific effector of the small GTP-binding protein Rap2 (англ.) // Eur. J. Biochem.[англ.] : journal. — 1998. — March (vol. 252, no. 2). — P. 290—298. — doi:10.1046/j.1432-1327.1998.2520290.x. — PMID 9523700.
- ↑ Boettner B., Govek E. E., Cross J., Van Aelst L. The junctional multidomain protein AF-6 is a binding partner of the Rap1A GTPase and associates with the actin cytoskeletal regulator profilin (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2000. — August (vol. 97, no. 16). — P. 9064—9069. — doi:10.1073/pnas.97.16.9064. — . — PMID 10922060. — PMC 16822.
- ↑ Karbowniczek M., Robertson G. P., Henske E. P. Rheb inhibits C-raf activity and B-raf/C-raf heterodimerization (англ.) // J. Biol. Chem. : journal. — 2006. — September (vol. 281, no. 35). — P. 25447—25456. — doi:10.1074/jbc.M605273200. — PMID 16803888.
- ↑ 1 2 Han L., Colicelli J. A human protein selected for interference with Ras function interacts directly with Ras and competes with Raf1 (англ.) // Mol. Cell. Biol. : journal. — 1995. — March (vol. 15, no. 3). — P. 1318—1323. — doi:10.1128/mcb.15.3.1318. — PMID 7862125. — PMC 230355.
- ↑ Jelinek T., Catling A. D., Reuter C. W., Moodie S. A., Wolfman A., Weber M. J. RAS and RAF-1 form a signalling complex with MEK-1 but not MEK-2 (англ.) // Mol. Cell. Biol. : journal. — 1994. — December (vol. 14, no. 12). — P. 8212—8218. — doi:10.1128/mcb.14.12.8212. — PMID 7969158. — PMC 359360.
- ↑ Romero F., Martínez-A C., Camonis J., Rebollo A. Aiolos transcription factor controls cell death in T cells by regulating Bcl-2 expression and its cellular localization (англ.) // EMBO J. : journal. — 1999. — June (vol. 18, no. 12). — P. 3419—3430. — doi:10.1093/emboj/18.12.3419. — PMID 10369681. — PMC 1171421.
- ↑ Morcos P., Thapar N., Tusneem N., Stacey D., Tamanoi F. Identification of neurofibromin mutants that exhibit allele specificity or increased Ras affinity resulting in suppression of activated ras alleles (англ.) // Mol. Cell. Biol. : journal. — 1996. — May (vol. 16, no. 5). — P. 2496—2503. — doi:10.1128/mcb.16.5.2496. — PMID 8628317. — PMC 231238.
- ↑ Hu C. D., Kariya K., Tamada M., Akasaka K., Shirouzu M., Yokoyama S., Kataoka T. Cysteine-rich region of Raf-1 interacts with activator domain of post-translationally modified Ha-Ras (англ.) // J. Biol. Chem. : journal. — 1995. — December (vol. 270, no. 51). — P. 30274—30277. — doi:10.1074/jbc.270.51.30274. — PMID 8530446.
- ↑ Rodriguez-Viciana P., Warne P. H., Khwaja A., Marte B. M., Pappin D., Das P., Waterfield M. D., Ridley A., Downward J. Role of phosphoinositide 3-OH kinase in cell transformation and control of the actin cytoskeleton by Ras (англ.) // Cell : journal. — Cell Press, 1997. — May (vol. 89, no. 3). — P. 457—467. — doi:10.1016/s0092-8674(00)80226-3. — PMID 9150145.
- ↑ Huang Y. Z., Zang M., Xiong W. C., Luo Z., Mei L. Erbin suppresses the MAP kinase pathway (англ.) // J. Biol. Chem. : journal. — 2003. — January (vol. 278, no. 2). — P. 1108—1114. — doi:10.1074/jbc.M205413200. — PMID 12379659.
- ↑ 1 2 Dogan T., Harms G. S., Hekman M., Karreman C., Oberoi T. K., Alnemri E. S., Rapp U. R., Rajalingam K. X-linked and cellular IAPs modulate the stability of C-RAF kinase and cell motility (англ.) // Nat. Cell Biol. : journal. — 2008. — December (vol. 10, no. 12). — P. 1447—1455. — doi:10.1038/ncb1804. — PMID 19011619.
- ↑ Stancato L. F., Chow Y. H., Hutchison K. A., Perdew G. H., Jove R., Pratt W. B. Raf exists in a native heterocomplex with hsp90 and p50 that can be reconstituted in a cell-free system (англ.) // J. Biol. Chem. : journal. — 1993. — October (vol. 268, no. 29). — P. 21711—21716. — PMID 8408024.
- ↑ 1 2 3 Yeung K., Janosch P., McFerran B., Rose D. W., Mischak H., Sedivy J. M., Kolch W. Mechanism of suppression of the Raf/MEK/extracellular signal-regulated kinase pathway by the raf kinase inhibitor protein (англ.) // Mol. Cell. Biol. : journal. — 2000. — May (vol. 20, no. 9). — P. 3079—3085. — doi:10.1128/mcb.20.9.3079-3085.2000. — PMID 10757792. — PMC 85596.
- ↑ Karandikar M., Xu S., Cobb M. H. MEKK1 binds raf-1 and the ERK2 cascade components (англ.) // J. Biol. Chem. : journal. — 2000. — December (vol. 275, no. 51). — P. 40120—40127. — doi:10.1074/jbc.M005926200. — PMID 10969079.
- ↑ English J. M., Pearson G., Hockenberry T., Shivakumar L., White M. A., Cobb M. H. Contribution of the ERK5/MEK5 pathway to Ras/Raf signaling and growth control (англ.) // J. Biol. Chem. : journal. — 1999. — October (vol. 274, no. 44). — P. 31588—31592. — doi:10.1074/jbc.274.44.31588. — PMID 10531364.
- ↑ Kuboki Y., Ito M., Takamatsu N., Yamamoto K. I., Shiba T., Yoshioka K. A scaffold protein in the c-Jun NH2-terminal kinase signaling pathways suppresses the extracellular signal-regulated kinase signaling pathways (англ.) // J. Biol. Chem. : journal. — 2000. — December (vol. 275, no. 51). — P. 39815—39818. — doi:10.1074/jbc.C000403200. — PMID 11044439.
- ↑ Ito M., Yoshioka K., Akechi M., Yamashita S., Takamatsu N., Sugiyama K., Hibi M., Nakabeppu Y., Shiba T., Yamamoto K. I. JSAP1, a novel jun N-terminal protein kinase (JNK)-binding protein that functions as a Scaffold factor in the JNK signaling pathway (англ.) // Mol. Cell. Biol. : journal. — 1999. — November (vol. 19, no. 11). — P. 7539—7548. — doi:10.1128/mcb.19.11.7539. — PMID 10523642. — PMC 84763.
- ↑ Zang M., Hayne C., Luo Z. Interaction between active Pak1 and Raf-1 is necessary for phosphorylation and activation of Raf-1 (англ.) // J. Biol. Chem. : journal. — 2002. — February (vol. 277, no. 6). — P. 4395—4405. — doi:10.1074/jbc.M110000200. — PMID 11733498.
- ↑ 1 2 Wang S., Nath N., Fusaro G., Chellappan S. Rb and prohibitin target distinct regions of E2F1 for repression and respond to different upstream signals (англ.) // Mol. Cell. Biol. : journal. — 1999. — November (vol. 19, no. 11). — P. 7447—7460. — doi:10.1128/mcb.19.11.7447. — PMID 10523633. — PMC 84738.
- ↑ 1 2 3 4 5 6 Van Der Hoeven P. C., Van Der Wal J. C., Ruurs P., Van Dijk M. C., Van Blitterswijk J. 14-3-3 isotypes facilitate coupling of protein kinase C-zeta to Raf-1: negative regulation by 14-3-3 phosphorylation (англ.) // Biochem. J.[англ.] : journal. — 2000. — January (vol. 345, no. 2). — P. 297—306. — doi:10.1042/0264-6021:3450297. — PMID 10620507. — PMC 1220759.
- ↑ Hu C. D., Kariya K., Okada T., Qi X., Song C., Kataoka T. Effect of phosphorylation on activities of Rap1A to interact with Raf-1 and to suppress Ras-dependent Raf-1 activation (англ.) // J. Biol. Chem. : journal. — 1999. — January (vol. 274, no. 1). — P. 48—51. — doi:10.1074/jbc.274.1.48. — PMID 9867809.
- ↑ Okada T., Hu C. D., Jin T. G., Kariya K., Yamawaki-Kataoka Y., Kataoka T. The strength of interaction at the Raf cysteine-rich domain is a critical determinant of response of Raf to Ras family small GTPases (англ.) // Mol. Cell. Biol. : journal. — 1999. — September (vol. 19, no. 9). — P. 6057—6064. — doi:10.1128/mcb.19.9.6057. — PMID 10454553. — PMC 84512.
- ↑ Long X., Lin Y., Ortiz-Vega S., Yonezawa K., Avruch J. Rheb binds and regulates the mTOR kinase (англ.) // Curr. Biol. : journal. — 2005. — April (vol. 15, no. 8). — P. 702—713. — doi:10.1016/j.cub.2005.02.053. — PMID 15854902.
- ↑ Karbowniczek M., Cash T., Cheung M., Robertson G. P., Astrinidis A., Henske E. P. Regulation of B-Raf kinase activity by tuberin and Rheb is mammalian target of rapamycin (mTOR)-independent (англ.) // J. Biol. Chem. : journal. — 2004. — July (vol. 279, no. 29). — P. 29930—29937. — doi:10.1074/jbc.M402591200. — PMID 15150271.
- ↑ Yee W. M., Worley P. F. Rheb interacts with Raf-1 kinase and may function to integrate growth factor- and protein kinase A-dependent signals (англ.) // Mol. Cell. Biol. : journal. — 1997. — February (vol. 17, no. 2). — P. 921—933. — doi:10.1128/mcb.17.2.921. — PMID 9001246. — PMC 231818.
- ↑ Movilla N., Crespo P., Bustelo X. R. Signal transduction elements of TC21, an oncogenic member of the R-Ras subfamily of GTP-binding proteins (англ.) // Oncogene : journal. — 1999. — October (vol. 18, no. 43). — P. 5860—5869. — doi:10.1038/sj.onc.1202968. — PMID 10557073.
- ↑ 1 2 Wang S., Ghosh R. N., Chellappan S. P. Raf-1 physically interacts with Rb and regulates its function: a link between mitogenic signaling and cell cycle regulation (англ.) // Mol. Cell. Biol. : journal. — 1998. — December (vol. 18, no. 12). — P. 7487—7498. — doi:10.1128/mcb.18.12.7487. — PMID 9819434. — PMC 109329.
- ↑ Ayroldi E., Zollo O., Macchiarulo A., Di Marco B., Marchetti C., Riccardi C. Glucocorticoid-induced leucine zipper inhibits the Raf-extracellular signal-regulated kinase pathway by binding to Raf-1 (англ.) // Mol. Cell. Biol. : journal. — 2002. — November (vol. 22, no. 22). — P. 7929—7941. — doi:10.1128/mcb.22.22.7929-7941.2002. — PMID 12391160. — PMC 134721.
- ↑ Truong A. B., Masters S. C., Yang H., Fu H. Role of the 14-3-3 C-terminal loop in ligand interaction (англ.) // Proteins : journal. — 2002. — November (vol. 49, no. 3). — P. 321—325. — doi:10.1002/prot.10210. — PMID 12360521.
- ↑ Yuryev A., Ono M., Goff S. A., Macaluso F., Wennogle L. P. Isoform-specific localization of A-RAF in mitochondria (англ.) // Mol. Cell. Biol. : journal. — 2000. — July (vol. 20, no. 13). — P. 4870—4878. — doi:10.1128/mcb.20.13.4870-4878.2000. — PMID 10848612. — PMC 85938.
- ↑ 1 2 3 Vincenz C., Dixit V. M. 14-3-3 proteins associate with A20 in an isoform-specific manner and function both as chaperone and adapter molecules (англ.) // J. Biol. Chem. : journal. — 1996. — August (vol. 271, no. 33). — P. 20029—20034. — doi:10.1074/jbc.271.33.20029. — PMID 8702721.
- ↑ 1 2 Conklin D. S., Galaktionov K., Beach D. 14-3-3 proteins associate with cdc25 phosphatases (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1995. — August (vol. 92, no. 17). — P. 7892—7896. — doi:10.1073/pnas.92.17.7892. — . — PMID 7644510. — PMC 41252.
- ↑ 1 2 Ewing R. M., Chu P., Elisma F., Li H., Taylor P., Climie S., McBroom-Cerajewski L., Robinson M. D., O'Connor L., Li M., Taylor R., Dharsee M., Ho Y., Heilbut A., Moore L., Zhang S., Ornatsky O., Bukhman Y. V., Ethier M., Sheng Y., Vasilescu J., Abu-Farha M., Lambert J. P., Duewel H. S., Stewart I. I., Kuehl B., Hogue K., Colwill K., Gladwish K., Muskat B., Kinach R., Adams S. L., Moran M. F., Morin G. B., Topaloglou T., Figeys D. Large-scale mapping of human protein-protein interactions by mass spectrometry (англ.) // Mol. Syst. Biol.[англ.] : journal. — 2007. — Vol. 3, no. 1. — P. 89. — doi:10.1038/msb4100134. — PMID 17353931. — PMC 1847948.
- ↑ Autieri M. V., Carbone C. J. 14-3-3Gamma interacts with and is phosphorylated by multiple protein kinase C isoforms in PDGF-stimulated human vascular smooth muscle cells (англ.) // DNA Cell Biol.[англ.] : journal. — 1999. — July (vol. 18, no. 7). — P. 555—564. — doi:10.1089/104454999315105. — PMID 10433554.
- ↑ Ichimura T., Wakamiya-Tsuruta A., Itagaki C., Taoka M., Hayano T., Natsume T., Isobe T. Phosphorylation-dependent interaction of kinesin light chain 2 and the 14-3-3 protein (англ.) // Biochemistry : journal. — 2002. — April (vol. 41, no. 17). — P. 5566—5572. — doi:10.1021/bi015946f. — PMID 11969417.
- ↑ Liu Y. C., Elly C., Yoshida H., Bonnefoy-Berard N., Altman A. Activation-modulated association of 14-3-3 proteins with Cbl in T cells (англ.) // J. Biol. Chem. : journal. — 1996. — June (vol. 271, no. 24). — P. 14591—14595. — doi:10.1074/jbc.271.24.14591. — PMID 8663231.
- ↑ Clark G. J., Drugan J. K., Rossman K. L., Carpenter J. W., Rogers-Graham K., Fu H., Der C. J., Campbell S. L. 14-3-3 zeta negatively regulates raf-1 activity by interactions with the Raf-1 cysteine-rich domain (англ.) // J. Biol. Chem. : journal. — 1997. — August (vol. 272, no. 34). — P. 20990—20993. — doi:10.1074/jbc.272.34.20990. — PMID 9261098.
- ↑ Tzivion G., Luo Z. J., Avruch J. Calyculin A-induced vimentin phosphorylation sequesters 14-3-3 and displaces other 14-3-3 partners in vivo (англ.) // J. Biol. Chem. : journal. — 2000. — September (vol. 275, no. 38). — P. 29772—29778. — doi:10.1074/jbc.M001207200. — PMID 10887173.
- ↑ Koyama S., Williams L. T., Kikuchi A. Characterization of the interaction of Raf-1 with ras p21 or 14-3-3 protein in intact cells (англ.) // FEBS Lett.[англ.] : journal. — 1995. — July (vol. 368, no. 2). — P. 321—325. — doi:10.1016/0014-5793(95)00686-4. — PMID 7628630.
- ↑ Chow C. W., Davis R. J. Integration of calcium and cyclic AMP signaling pathways by 14-3-3 (англ.) // Mol. Cell. Biol. : journal. — 2000. — January (vol. 20, no. 2). — P. 702—712. — doi:10.1128/MCB.20.2.702-712.2000. — PMID 10611249. — PMC 85175.
