Глутаминаза
| Глутаминаза | |
|---|---|
![Кристаллографическая структура димерного белка-глутаминазы из Chryseobacterium proteolyticum[1].](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5e/Glutaminase.png/274px-Glutaminase.png) Кристаллографическая структура димерного белка-глутаминазы из Chryseobacterium proteolyticum[1]. | |
| Идентификаторы | |
| Шифр КФ | 3.5.1.2 |
| Номер CAS | 9001-47-2 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9001-47-2 |
| Глутаминаза | |
|---|---|
 Вероятная глутаминаза из Bacillus subtilis в комплексе с 6-диазо-5-оксо-ʟ-норлейцином. | |
| Идентификаторы | |
| Символ | Glutaminase |
| Pfam | PF04960 |
| Pfam clan | CL0013 |
| InterPro | IPR015868 |
| SCOP | 1mki |
| SUPERFAMILY | 1mki |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
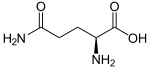
Глутаминаза, также глутаминогидролаза (англ. glutaminase I, L-glutaminase, glutamine aminohydrolase, сокр. GLS) — фермент (КФ 3.5.1.2), из семейства амидогидролазы (класс гидролазы), который катализирует реакцию гидролитического расщепления молекул глутамина до глутамата и аммиака (точнее ионов аммония). Схема реакции:
Глутаминаза имеет тканеспецифические изоферменты. Глутаминаза играет важную роль в азотистом обмене, в частности в регуляции и утилизации токсичного аммиака (посредством превращения его в мочевину). Глутаминазы обнаружены в нервных и глиальных клетках всех высших организмов и могут активироваться фосфатами и ионами кальция (Са2+)[2].
Изоферменты глутаминазы у человека представлены в виде двух типов:
- почечный тип или глутаминаза I (2-формы)
- печёночный тип или глутаминаза II (2-формы).
Глутаминаза I кодируется геном GLS1, который расположен на длинном плече (q-плече) 2-й хромосомы. Ген, кодирующий глутаминазу II — GLS2, локализован на длинном плече (q-плече) 12-й хромосомы.
Структура
[править | править код]Структура глутаминазы была определена с помощью рентгеновской дифракции с разрешением до 1,73 Å (0,173 нм). В длину этот димерный белок состоит из 2 цепей, содержащих 305 аминокислотных остатков. На каждой цепи 23 % аминокислотного состава, или 71 остаток, приходится на 8 спиралей. Двадцать один процент, или 95 остатков, составляют 23 бета-листа[1].
Тканевое распределение
[править | править код]Глутаминаза экспрессируется и активна в перипортальных гепатоцитах, где она синтезирует протонированный аммиак (ионы аммония NH4+), для дальнейшего его превращения в мочевину, как и глутаматдегидрогеназа[3]. Глутаминаза также экспрессируется в эпителиальных клетках почечных канальцев, где образующийся аммиак выводится в виде ионов аммония. Эта экскреция ионов аммония является важным механизмом почечной регуляции кислотно-основного состояния. При хроническом ацидозе в почках индуцируется глутаминаза, что приводит к увеличению количества выделяемых ионов аммония. Глутаминазу можно обнаружить и в кишечнике, при этом печёночный портальный аммиак может достигать концентрации 0,26 мМ (по сравнению с аммиаком артериальной крови 0,02 мМ).
Одна из наиболее важных ролей глутаминазы — в аксональных терминалях нейронов центральной нервной системы. Глутамат — самый распространённый возбуждающий нейротрансмиттер в ЦНС. После высвобождения в синапсе для нейротрансмиссии глутамат быстро поглощается близлежащими астроцитами, которые превращают его в глутамин. Затем этот глутамин поступает в пресинаптические терминали нейронов, где глутаминазы превращают его обратно в глутамат для загрузки в синаптические везикулы. Хотя в мозге экспрессируются глутаминазы как "почечного" (GLS1), так и "печёночного" (GLS2) типа, GLS2, по имеющимся данным, существует только в клеточных ядрах нейронов ЦНС[4].
Регуляция
[править | править код]АДФ — сильнейший адениновый нуклеотидный активатор глутаминазы. Исследования также показали, что АДФ снижает Km для глутамина и увеличивает Vmax. Они обнаружили, что эти эффекты ещё больше усиливаются в присутствии АТФ[5].
Конечный продукт реакции глутаминазы, глутамат, является сильным ингибитором реакции. Таким образом, изменения в глутаматдегидрогеназе, которая превращает глутамат в 2-оксоглутарат и тем самым снижает внутримитохондриальный уровень глутамата, являются важным механизмом регуляции активности глутаминазы.
Предполагается, что фосфат-активируемая митохондриальная глутаминаза (GLS1) связана с повышением метаболизма, снижением уровня внутриклеточных реактивных форм кислорода (АФК) и общим снижением окисления ДНК как в нормальных, так и в стрессовых клетках. Предполагается, что контроль GLS2 над уровнем АФК способствует "усилению возможности p53 защищать клетки от накопления геномных повреждений и позволяет клеткам выживать после лёгкого и поддающегося восстановлению генотоксического стресса"[6].
Изоферменты
[править | править код]У человека экспрессируются 4 изоформы глутаминазы. GLS1 кодирует 2 типа глутаминазы почечного типа с высокой активностью и низким Km. GLS2 кодирует 2 формы глутаминазы печёночного типа с низкой активностью и аллостерической регуляцией[3] .
Клиническое значение
[править | править код]Многие виды рака зависят от глутаминазы, поэтому ингибиторы глутаминазы были предложены в качестве средства лечения рака[7][8]. Некоторые ингибиторы глутаминазы, такие как JHU-083[9], находятся в стадии клинических испытаний. В 2021 году было сообщено, что ингибитор GLS1 устраняет стареющие клетки из различных органов и тканей у пожилых мышей, облегчая возраст-ассоциированную дисфункцию тканей. Результаты свидетельствуют о том, что стареющие клетки зависят от глутаминолиза, и ингибирование глутаминазы I может быть перспективной стратегией для индуцирования сенолиза (гибель постаревших клеток) in vivo[10].
Примечания
[править | править код]- ↑ 1 2 PDB 3A56; Hashizume R, Mizutani K, Takahashi N, Matsubara H, Matsunaga A, Yamaguchi S, Mikami B (2010). "Crystal structure of protein-glutaminase". doi:10.2210/pdb3a56/pdb.
{{cite journal}}: Cite journal требует|journal=(справка) - ↑ Wissenschaft-Online-Lexika: Eintrag zu Glutaminase im Lexikon der Neurowissenschaft, abgerufen am 5. Dezember 2012.
- ↑ 1 2 Botman D, Tigchelaar W, Van Noorden CJ (November 2014). "Determination of phosphate-activated glutaminase activity and its kinetics in mouse tissues using metabolic mapping (quantitative enzyme histochemistry)". The Journal of Histochemistry and Cytochemistry. 62 (11): 813–26. doi:10.1369/0022155414551177. PMC 4230542. PMID 25163927.
- ↑ Olalla L, Gutiérrez A, Campos JA, Khan ZU, Alonso FJ, Segura JA, et al. (October 2002). "Nuclear localization of L-type glutaminase in mammalian brain". The Journal of Biological Chemistry. 277 (41): 38939–44. doi:10.1074/jbc.C200373200. PMID 12163477.
- ↑ Masola B, Ngubane NP (December 2010). "The activity of phosphate-dependent glutaminase from the rat small intestine is modulated by ADP and is dependent on integrity of mitochondria". Archives of Biochemistry and Biophysics. 504 (2): 197–203. doi:10.1016/j.abb.2010.09.002. PMID 20831857.
- ↑ Suzuki S, Tanaka T, Poyurovsky MV, Nagano H, Mayama T, Ohkubo S, et al. (April 2010). "Phosphate-activated glutaminase (GLS2), a p53-inducible regulator of glutamine metabolism and reactive oxygen species". Proceedings of the National Academy of Sciences of the United States of America. 107 (16): 7461–6. Bibcode:2010PNAS..107.7461S. doi:10.1073/pnas.1002459107. PMC 2867754. PMID 20351271.
- ↑ Chen L, Cui H (September 2015). "Targeting Glutamine Induces Apoptosis: A Cancer Therapy Approach". International Journal of Molecular Sciences. 16 (9): 22830–55. doi:10.3390/ijms160922830. PMC 4613338. PMID 26402672.
- ↑ Sheikh TN, Patwardhan PP, Cremers S, Schwartz GK (November 2017). "Targeted inhibition of glutaminase as a potential new approach for the treatment of NF1 associated soft tissue malignancies". Oncotarget. 8 (55): 94054–94068. doi:10.18632/oncotarget.21573. PMC 5706855. PMID 29212209.
- ↑ Yamashita AS, da Costa Rosa M, Stumpo V, Rais R, Slusher BS, Riggins GJ. The glutamine antagonist prodrug JHU-083 slows malignant glioma growth and disrupts mTOR signaling. Neurooncol Adv. 2020 Oct 29;3(1):vdaa149. doi:10.1093/noajnl/vdaa149 PMID 33681764
- ↑ Johmura Y, Yamanaka T, Omori S, Wang TW, Sugiura Y, Matsumoto M, et al. (January 2021). "Senolysis by glutaminolysis inhibition ameliorates various age-associated disorders". Science. 371 (6526): 265–270. Bibcode:2021Sci...371..265J. doi:10.1126/science.abb5916. PMID 33446552. S2CID 231606800.