Tuz köprüsü (protein ve supramoleküler)
Bu madde, öksüz maddedir; zira herhangi bir maddeden bu maddeye verilmiş bir bağlantı yoktur. (Eylül 2022) |

Kimyada, bir tuz köprüsü iki kovalent olmayan etkileşimin bir kombinasyonudur (hidrojen bağı ve iyonik bağı örneği Şekil 1). İyon eşleştirme, kimyada, biyolojik sistemlerde, farklı materyallerde ve iyon çifti kromatografisi gibi birçok uygulamada en önemli kovalent olmayan kuvvetlerden biridir. Proteinlerin entropik olarak elverişsiz katlanmış konformasyonuna kararlılık sağlayan en yaygın faktördür. Kovalent olmayan etkileşimlerin nispeten zayıf etkileşimler olduğu bilinmesine rağmen, küçük stabilize edici etkileşimler bir araya geldiğinde konformer kararlılığına büyük derece bir atkı gerçekleştirebilirler.[1] Sadece proteinlerde değil, tuz köprüleri aynı zamanda supramoleküler kimyada da bulunabilirler.
Proteinlerde bulunan tuz köprüleri
[değiştir | kaynağı değiştir]
Tuz köprüsü en sık aspartik asit ya da glutamik asitteki anyonik karboksilatı (RCOO-) ve lizinin katyonik amonyumu (RNH3+) veya arginin amino asitinin guanidinyumu (RNHC (NH2)2+) arasında görülür (Şekil 2).[1] Bu durum en yaygın vaka olmasına rağmen, başka amino asitlerinde tuz köprisine katılmaları olasıdır. Tuz köprüsüne katılan amino asitler arasındaki mesafe de önemlidir. Gereken mesafe 4 A'dan (400 pm) azdır. Aralarındaki mesafe 4A' dan daha büyük amino asitler aralarında bir tuz köprüsü oluşturmaya uygun değildir.[3] Bir protein boyunca çok sayıda iyonlaşabilir amino asit yan zinciri bulunması nedeniyle, bir proteinin bulunduğu pH, proteinin stabilitesi için çok önemlidir.
Supramoleküler kimya
[değiştir | kaynağı değiştir]

Supramoleküler kimya, makromoleküller arasındaki kovalent olmayan etkileşimlerle ilgilenen bir alandır. Tuz köprüleri, bu alandaki kimyagerler tarafından anyonların algılanması, moleküler kapsüllerin ve çift sarmal polimerlerin sentezi dahil olmak üzere çeşitli ve yaratıcı yollarla kullanılmıştır.
Anyon kompleksleşmesi
[değiştir | kaynağı değiştir]Supramoleküler kimyanın anyonların tanınması ve algılanmasına büyük katkıları olmuştur.[4][5][6][7][8][9] İyon eşleşmesi anyon kompleksi için en önemli itici güçtür, ancak, halid serisinde görüldüğü gibi, seçicilik, çoğunlukla hidrojen bağları katkılarıyla elde edilir.
Moleküler kapsüller
[değiştir | kaynağı değiştir]Moleküler kapsüller, konuk bir molekülü yakalamak ve tutmak için tasarlanmış kimyasal iskelelerdir (Bkz. Moleküler kapsülleme). Szumna ve arkadaşları kiral bir iç kısma sahip yeni bir moleküler kapsül geliştirdiler.[10] Bu kapsül, plastik bir paskalya yumurtası gibi iki yarıdan oluşur (Şekil 6). İki yarım arasındaki tuz köprüsü etkileşimleri, çözeltide iki yarımın kendi kendine toplanmalarına neden olur (Şekil 7). Kapsül 60 °C' ye kadar ısıtıldığında bile stabildir.
Çift sarmal polimerler
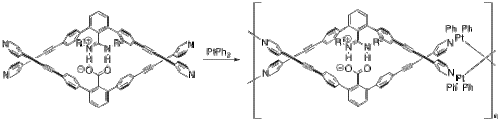
[değiştir | kaynağı değiştir]Yashima ve arkadaşları DNA'ya çok benzeyen bir çift sarmal konformasyonu benimseyen birkaç polimer oluşturmak için tuz köprüleri kullandılar.[11] Bir örnekte, çift sarmal bir metallopolimer oluşturmak için platin eklediler.[12] Bu metallopolimerler, monomeri ve platin (II) bifenilinden başlayarak (Şekil 8), bir dizi ligand değişim reaksiyonu yoluyla kendi kendine bir araya gelir. Monomerin iki yarısı, protondan arındırılmış karboksilat ile protonlanmış nitrojenler arasındaki tuz köprüsünden birbirine sabitlenir.
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b Eric V. Anslyn; Dennis A. Dougherty (2006). Modern Physical Organic Chemistry (İngilizce). University Science Books. ISBN 978-1-891389-31-3.
- ^ "A novel homozygous p.Arg527Leu LMNA mutation in two unrelated Egyptian families causes overlapping mandibuloacral dysplasia and progeria syndrome". European Journal of Human Genetics. 20 (11). Kasım 2012. ss. 1134-40.
- ^ "Close-range electrostatic interactions in proteins". ChemBioChem. 3 (7). Temmuz 2002. ss. 604-17.
- ^ Kolektif (31 Ocak 1997). Supramolecular Chemistry of Anions (İngilizce). Wiley-VCH. ISBN 9780471186229.
- ^ Kristin Bowman-James; Antonio Bianchi; Enrique García-Espana (2012). Anion Coordination Chemistry (İngilizce). John Wiley & Sons. ISBN 978-3527323708.
- ^ Jonathan L. Sessler; Philip A. Gale; Won-Seob Cho (1 Ocak 2006). Anion Receptor Chemistry (İngilizce). Royal Society of Chemistry. ISBN 978-0854049745.
- ^ Gale, Philip A.; Dehaen, Wim (Eylül 2010). Anion Recognition in Supramolecular Chemistry. ISBN 978-3642264702.
- ^ "Applications of supramolecular anion recognition". Chemical Reviews. 115 (15). Mayıs 2015. ss. 8038-155.
- ^ "Advances in anion supramolecular chemistry: From recognition to chemical applications". Angewandte Chemie International Edition. 53 (44). Ekim 2014. ss. 11716-54.
- ^ "A self-assembled chiral capsule with polar interior". Chemical Communications, 15. Nisan 2009. ss. 1959-61.
- ^ "Acetylenic polymers: syntheses, structures, and functions". Chemical Reviews. 109 (11). Kasım 2009. ss. 5799-867.
- ^ "Construction of double-stranded metallosupramolecular polymers with a controlled helicity by combination of salt bridges and metal coordination". Journal of the American Chemical Society. 128 (21). Mayıs 2006. ss. 6806-7.