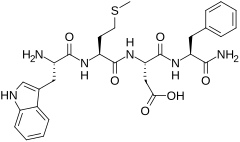
CCK-4
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Dược đồ sử dụng | IV |
| Dữ liệu dược động học | |
| Sinh khả dụng | 100% |
| Chuyển hóa dược phẩm | plasma protease enzymes |
| Chu kỳ bán rã sinh học | 13 minutes |
| Bài tiết | N/A |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| ChEBI | |
| Dữ liệu hóa lý | |
| Công thức hóa học | C29H35N5O7S |
| Khối lượng phân tử | 597.681 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
| (kiểm chứng) | |
Cholecystokinin tetrapeptide (CCK-4, Trp - Met - Asp - Phe -NH2) là một mảnh peptide có nguồn gốc từ hormone peptide lớn hơn cholecystokinin. Không giống như cholecystokin có nhiều vai trò khác nhau trong hệ thống tiêu hóa cũng như tác dụng của hệ thần kinh trung ương, CCK-4 hoạt động chủ yếu trong não như một chất gây mê, mặc dù nó giữ lại một số hiệu ứng GI, nhưng không nhiều như CCK-8 hoặc chiều dài đầy đủ polypeptide CCK-58.
CCK-4 đáng tin cậy gây ra các triệu chứng lo âu nghiêm trọng khi dùng cho người với liều lượng ít nhất là 50μg,[1] và thường được sử dụng trong nghiên cứu khoa học để gây ra các cơn hoảng loạn cho mục đích thử nghiệm các loại thuốc giải lo âu mới.[2][3][4][5] Vì là peptide, CCK-4 phải được tiêm bằng cách tiêm và nhanh chóng bị phá vỡ một lần trong cơ thể nên chỉ có thời gian tác dụng ngắn,[6] mặc dù đã biết rất nhiều chất tương tự tổng hợp có đặc tính biến đổi.[7][8][9][10][11][12][13][14][15][16][17]
Xem thêm
[sửa | sửa mã nguồn]- Pentagastrin
Tham khảo
[sửa | sửa mã nguồn]- ^ Daniela Eser; và đồng nghiệp (2005). “Panic Induction with Cholecystokinin-Tetrapeptide (CCK-4) Increases Plasma Concentrations of the Neuroactive Steroid 3α, 5α Tetrahydrodeoxycorticosterone (3α, 5α-THDOC) in Healthy Volunteers”. Neuropsychopharmacology. 30 (1): 192–195. doi:10.1038/sj.npp.1300572. PMID 15467707.
- ^ Bradwejn J. (tháng 7 năm 1993). “Neurobiological investigations into the role of cholecystokinin in panic disorder”. Journal of Psychiatry and Neuroscience. 18 (4): 178–188. PMC 1188527. PMID 8104032.
- ^ Schunck T, Erb G, Mathis A, Gilles C, Namer IJ, Hode Y, Demaziere A, Luthringer R, Macher JP (tháng 7 năm 2006). “Functional magnetic resonance imaging characterization of CCK-4-induced panic attack and subsequent anticipatory anxiety”. NeuroImage. 31 (3): 1197–1208. doi:10.1016/j.neuroimage.2006.01.035. PMID 16600640.
- ^ Eser D, Schüle C, Baghai T, Floesser A, Krebs-Brown A, Enunwa M, de la Motte S, Engel R, Kucher K, Rupprecht R (tháng 7 năm 2007). “Evaluation of the CCK-4 model as a challenge paradigm in a population of healthy volunteers within a proof-of-concept study”. Psychopharmacology. 192 (4): 479–487. doi:10.1007/s00213-007-0738-7. PMID 17318504.
- ^ Eser D, Leicht G, Lutz J, Wenninger S, Kirsch V, Schüle C, Karch S, Baghai T, Pogarell O, Born C, Rupprecht R, Mulert C (tháng 12 năm 2007). “Functional neuroanatomy of CCK-4-induced panic attacks in healthy volunteers”. Human Brain Mapping. 30 (2): 511–22. doi:10.1002/hbm.20522. PMID 18095276.
- ^ Koulischer D, Moroder L, Deschodt-Lanckman M (tháng 8 năm 1982). “Degradation of cholecystokinin octapeptide, related fragments and analogs by human and rat plasma in vitro”. Regulatory Peptides. 4 (3): 127–139. doi:10.1016/0167-0115(82)90080-5. PMID 6291099.
- ^ Blommaert AG, Dhôtel H, Ducos B, Durieux C, Goudreau N, Bado A, Garbay C, Roques BP (tháng 2 năm 1997). “Structure-based design of new constrained cyclic agonists of the cholecystokinin CCK-B receptor”. Journal of Medicinal Chemistry. 40 (5): 647–58. doi:10.1021/jm9603072. PMID 9057851.
- ^ Bellier B, Million ME, DaNascimento S, Meudal H, Kellou S, Maigret B, Garbay C (tháng 10 năm 2000). “Replacement of glycine with dicarbonyl and related moieties in analogues of the C-terminal pentapeptide of cholecystokinin: CCK(2) agonists displaying a novel binding mode”. Journal of Medicinal Chemistry. 43 (20): 3614–23. doi:10.1021/jm0000416. PMID 11020275.
- ^ Léna I, Dh tel H, Garbay C, Daugé V (tháng 1 năm 2001). “Involvement of D2 dopamine receptors in the opposing effects of two CCK-B agonists in a spatial recognition memory task: role of the anterior nucleus accumbens”. Psychopharmacology. 153 (2): 170–9. doi:10.1007/s002130000517. PMID 11205416.
- ^ Bellier B, Garbay C (2003). “How a single inversion of configuration leads to a reversal of the binding mode: proposal of a novel arrangement of CCK2 ligands in their receptor, and contribution to the development of peptidomimetic or non-peptide CCK2 ligands”. European Journal of Medicinal Chemistry. 38 (7–8): 671–86. doi:10.1016/S0223-5234(03)00112-0. PMID 12932898.
- ^ Bellier B, Crété D, Million ME, Beslot F, Bado A, Garbay C, Daugé V (tháng 11 năm 2004). “New CCK2 agonists confirming the heterogeneity of CCK2 receptors: characterisation of BBL454”. Naunyn-Schmiedeberg's Archives of Pharmacology. 370 (5): 404–13. doi:10.1007/s00210-004-0969-7. PMID 15480577.
- ^ Proskuriakova TV, Bespalova ZhD, Pal'keeva ME, Petrichenko OB, Pankratova NV, Shokhonova VA, Anokhina IP (2005). “[Biological activity of cholecystokinin-(30-33) tetrapeptide analogs]”. Bioorganicheskaia Khimiia (bằng tiếng Nga). 31 (2): 130–9. PMID 15889786.
- ^ Anokhina IP, Proskuriakova TV, Bespalova ZhD, Pal'keeva ME, Shokhonova VA, Petrichenko OB (2006). “[Effect of a cholecystokinin tetrapeptide analogue on opioid reception under acute and chronic morphine administration]”. Bioorganicheskaia Khimiia (bằng tiếng Nga). 32 (3): 276–83. PMID 16808170.
- ^ Agnes RS, Lee YS, Davis P, Ma SW, Badghisi H, Porreca F, Lai J, Hruby VJ (tháng 5 năm 2006). “Structure-activity relationships of bifunctional peptides based on overlapping pharmacophores at opioid and cholecystokinin receptors”. Journal of Medicinal Chemistry. 49 (10): 2868–75. doi:10.1021/jm050921q. PMC 1484468. PMID 16686530.
- ^ Noble F (2007). “Pharmacology of CCKRs and SAR studies of peptidic analog ligands”. Current Topics in Medicinal Chemistry. 7 (12): 1173–9. doi:10.2174/156802607780960447. PMID 17584139.
- ^ García-López MT, González-Muñiz R, Martín-Martínez M, Herranz R (2007). “Strategies for design of non peptide CCK1R agonist/antagonist ligands”. Current Topics in Medicinal Chemistry. 7 (12): 1180–94. doi:10.2174/156802607780960537. PMID 17584140.
- ^ Kalindjian SB, McDonald IM (2007). “Strategies for the design of non-peptide CCK2 receptor agonist and antagonist ligand”. Current Topics in Medicinal Chemistry. 7 (12): 1195–204. doi:10.2174/156802607780960500. PMID 17584141.