Plerixafor
 | |
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Mozobil |
| Đồng nghĩa | JM 3100, AMD3100 |
| AHFS/Drugs.com | Thông tin thuốc cho người dùng |
| MedlinePlus | a609018 |
| Giấy phép | |
| Danh mục cho thai kỳ |
|
| Dược đồ sử dụng | Subcutaneous injection |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Dữ liệu dược động học | |
| Liên kết protein huyết tương | Up to 58% |
| Chuyển hóa dược phẩm | None |
| Chu kỳ bán rã sinh học | 3–5 hours |
| Bài tiết | Thận |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEMBL | |
| Dữ liệu hóa lý | |
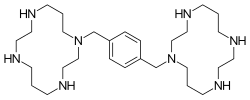
| Công thức hóa học | C28H54N8 |
| Khối lượng phân tử | 502.782 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
| (kiểm chứng) | |
Plerixafor (INN và USAN, tên thương mại Mozobil) là một chất kích thích miễn dịch được sử dụng để huy động các tế bào gốc tạo máu ở bệnh nhân ung thư vào máu. Các tế bào gốc sau đó được chiết xuất từ máu và cấy ghép lại cho bệnh nhân. Thuốc được phát triển bởi AnorMED, sau đó được Genzyme mua.
Sử dụng trong y tế
[sửa | sửa mã nguồn]Việc huy động tế bào gốc máu ngoại vi, điều quan trọng là nguồn tế bào gốc tạo máu để ghép, thường được thực hiện bằng cách sử dụng yếu tố kích thích khuẩn lạc bạch cầu hạt (G-CSF), nhưng không hiệu quả ở khoảng 15 đến 20% bệnh nhân. Kết hợp G-CSF với plerixafor làm tăng tỷ lệ người đáp ứng với trị liệu và sản xuất đủ tế bào gốc để ghép.[1] Thuốc được chấp thuận cho bệnh nhân ung thư hạch và đa u tủy.[2]
Chống chỉ định
[sửa | sửa mã nguồn]Mang thai và cho con bú
[sửa | sửa mã nguồn]Các nghiên cứu trên động vật mang thai đã cho thấy tác dụng gây quái thai. Do đó Plerixafor chống chỉ định ở phụ nữ mang thai trừ những trường hợp nguy kịch. Phụ nữ sinh sản bắt buộc phải sử dụng biện pháp tránh thai. Người ta không biết liệu thuốc được tiết vào sữa mẹ. Nên ngừng cho con bú trong khi điều trị.[2]
Tác dụng phụ
[sửa | sửa mã nguồn]Buồn nôn, tiêu chảy và phản ứng tại chỗ được quan sát thấy ở hơn 10% bệnh nhân. Các vấn đề khác về tiêu hóa và các triệu chứng chung như chóng mặt, đau đầu và đau cơ cũng tương đối phổ biến; họ đã được tìm thấy ở hơn 1% bệnh nhân. Dị ứng xảy ra trong ít hơn 1% trường hợp. Hầu hết các tác dụng phụ trong các thử nghiệm lâm sàng là nhẹ và thoáng qua.[2][3]
Cơ quan Dược phẩm Châu Âu đã liệt kê một số mối quan tâm về an toàn sẽ được đánh giá trên cơ sở hậu tiếp thị, đáng chú ý nhất là khả năng lý thuyết của vỡ lách và huy động tế bào khối u. Mối quan tâm đầu tiên đã được nêu ra vì lách to đã được quan sát trong các nghiên cứu trên động vật và G-CSF có thể gây vỡ lách trong những trường hợp hiếm gặp. Việc huy động các tế bào khối u đã xảy ra ở những bệnh nhân mắc bệnh bạch cầu được điều trị bằng plerixafor.[4]
Tương tác
[sửa | sửa mã nguồn]Không có nghiên cứu tương tác đã được tiến hành. Việc plerixafor không tương tác với hệ thống cytochrom cho thấy khả năng tương tác thấp với các loại thuốc khác.[2]
Dược lý
[sửa | sửa mã nguồn]Cơ chế hoạt động
[sửa | sửa mã nguồn]Ở dạng phức hợp kẽm, plerixafor hoạt động như một chất đối vận (hoặc có lẽ chính xác hơn là chất chủ vận từng phần) của thụ thể alpha chemokine CXCR4 và chất chủ vận allosteric của CXCR7.[5] Các CXCR4 alpha- chemokine thụ và là một trong của nó ligand, SDF-1, rất quan trọng trong tế bào gốc tạo máu homing đến tủy xương và tế bào gốc tạo máu yên lặng. Tác dụng in vivo của plerixafor liên quan đến ubiquitin, phối tử nội sinh thay thế của CXCR4, vẫn chưa được biết. Plerixafor đã được tìm thấy là một chất gây cảm ứng mạnh mẽ của việc huy động các tế bào gốc tạo máu từ tủy xương đến máu như các tế bào gốc máu ngoại vi.[6] Ngoài ra, plerixafor ức chế biểu hiện CD20 trên các tế bào B bằng cách can thiệp vào trục CXCR4 / SDF1 điều chỉnh biểu thức của nó. [cần dẫn nguồn] [ <span title="This claim needs references to reliable sources. (November 2018)">cần dẫn nguồn</span> ]
Dược động học
[sửa | sửa mã nguồn]Sau khi tiêm dưới da, plerixafor được hấp thu nhanh chóng và nồng độ đỉnh đạt được sau 30 đến 60 phút. Có tới 58% liên kết với protein huyết tương, phần còn lại chủ yếu nằm trong các khoang ngoại mạch. Thuốc không được chuyển hóa với số lượng đáng kể; không có tương tác với các enzyme cytochrom P450 hoặc P-glycoprotein đã được tìm thấy. Nửa đời trong huyết tương là 3 đến 5 giờ. Plerixafor được bài tiết qua thận, với 70% thuốc được bài tiết trong vòng 24 giờ.[2]
Hóa học
[sửa | sửa mã nguồn]Plerixafor là một hợp chất macrocyclic và một dẫn xuất bi cyclam, các vòng cyclam được liên kết tại các nguyên tử nitơ amin bằng một miếng đệm 1,4 xylyl.[1] Đó là một cơ sở mạnh mẽ; tất cả tám nguyên tử nitơ chấp nhận proton dễ dàng. Hai vòng macrocyclic tạo thành phức chelate với các ion kim loại hóa trị hai, đặc biệt là kẽm, đồng và niken, cũng như coban và rhodium. Dạng hoạt tính sinh học của plerixafor là phức hợp kẽm của nó.[7]
Tổng hợp
[sửa | sửa mã nguồn]Ba trong số bốn nguyên tử nitơ của macrocycl cyclam (1,4,8,11-tetraazacyclotetradecane) được bảo vệ bằng các nhóm tosyl. Sản phẩm được xử lý bằng benzen 1,4-bis (brommethyl) và kali cacbonat trong acetonitril. Sau khi tách các nhóm tosyl bằng axit hydrobromic, thu được plerixafor octahydrobromide.[8]
Lịch sử
[sửa | sửa mã nguồn]Phân tử này lần đầu tiên được tổng hợp vào năm 1987 để thực hiện các nghiên cứu cơ bản về hóa học oxy hóa khử của các hợp chất phối hợp dimetallic.[9] Sau đó, nó đã tình cờ phát hiện bởi nhà hóa học khác mà một phân tử như vậy có thể có một tiềm năng sử dụng trong điều trị HIV vì vai trò của nó trong việc ngăn chặn của CXCR4, một thụ thể chemokine hoạt động như một đồng thụ thể cho một số chủng HIV (cùng với thụ thể tế bào chính của virus, CD4).[10] Sự phát triển của chỉ định này đã bị chấm dứt do thiếu khả năng uống và rối loạn tim. Các nghiên cứu sâu hơn đã dẫn đến chỉ định mới cho bệnh nhân ung thư.
Xã hội và văn hoá
[sửa | sửa mã nguồn]Plerixafor có tình trạng thuốc mồ côi ở Hoa Kỳ và Liên minh Châu Âu để huy động các tế bào gốc tạo máu. Nó đã được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ chấp thuận cho chỉ định này vào ngày 15 tháng 12 năm 2008 [11] Tại châu Âu, loại thuốc này đã được phê duyệt sau khi có báo cáo đánh giá tích cực về sản phẩm dược phẩm cho con người vào ngày 29 tháng 5 năm 2009.[4] Thuốc đã được Bộ Y tế Canada phê duyệt sử dụng tại Canada vào ngày 8 tháng 12 năm 2011.[12]
Nghiên cứu
[sửa | sửa mã nguồn]Đặc tính chống ung thư
[sửa | sửa mã nguồn]Plerixafor đã được nhìn thấy để làm giảm sự di căn ở chuột trong một số nghiên cứu.[13] Nó cũng đã được chứng minh là làm giảm sự tái phát của u nguyên bào thần kinh đệm trong mô hình chuột sau khi xạ trị. Trong mô hình này, các tế bào ung thư sống sót sau bức xạ phụ thuộc rất nhiều vào các tế bào có nguồn gốc từ tủy xương để tạo mạch, và việc tuyển dụng sau này đã qua trung gian bởi các tương tác SDF-1 CXCR4, bị chặn bởi plerixafor.[14]
Sử dụng trong nghiên cứu tế bào gốc
[sửa | sửa mã nguồn]Các nhà nghiên cứu tại Đại học Hoàng gia đã chứng minh rằng plerixafor kết hợp với yếu tố tăng trưởng nội mô mạch máu (VEGF) có thể huy động các tế bào gốc trung mô và tế bào tiền thân nội mô vào máu ngoại vi của chuột.[15]
Thần kinh
[sửa | sửa mã nguồn]Việc phong tỏa tín hiệu CXCR4 bằng plerixafor cũng bất ngờ được phát hiện là có hiệu quả trong việc chống lại chứng tăng opioid gây ra do điều trị mãn tính với morphin, mặc dù chỉ có các nghiên cứu trên động vật được thực hiện.[16]
Bệnh sốt rét
[sửa | sửa mã nguồn]Một nghiên cứu năm 2018 trong các giả thuyết y khoa đề xuất rằng plerixafor có thể được sử dụng trong điều trị sốt rét [17].
Tham khảo
[sửa | sửa mã nguồn]- ^ a b “Plerixafor”. Drugs in R&D. 8 (2): 113–119. 2007. doi:10.2165/00126839-200708020-00006. PMID 17324009.
- ^ a b c d e Haberfeld, H biên tập (2009). Austria-Codex (bằng tiếng Đức) . Vienna: Österreichischer Apothekerverlag. ISBN 978-3-85200-196-8.
- ^ Wagstaff, A. J. (2009). “Plerixafor: in patients with non-Hodgkin's lymphoma or multiple myeloma”. Drugs. 69 (3): 319–26. doi:10.2165/00003495-200969030-00007. PMID 19275275.
- ^ a b “CHMP Assessment Report for Mozobil” (PDF). European Medicines Agency. Bản gốc (PDF) lưu trữ ngày 18 tháng 6 năm 2018. Truy cập ngày 25 tháng 8 năm 2019.
- ^ Kalatskaya, I.; Berchiche, Y. A.; Gravel, S.; Limberg, B. J.; Rosenbaum, J. S.; Heveker, N. (2009). “AMD3100 is a CXCR7 Ligand with Allosteric Agonist Properties”. Molecular Pharmacology. 75 (5): 1240–7. doi:10.1124/mol.108.053389. PMID 19255243.
- ^ Cashen, A. F.; Nervi, B.; Dipersio, J. (2007). “AMD3100: CXCR4 antagonist and rapid stem cell-mobilizing agent”. Future Oncology. 3 (1): 19–27. doi:10.2217/14796694.3.1.19. PMID 17280498.
- ^ Esté, J. A.; Cabrera, C.; De Clercq, E.; Struyf, S.; Van Damme, J.; Bridger, G.; Skerlj, R. T.; Abrams, M. J.; Henson, G. (1999). “Activity of different bicyclam derivatives against human immunodeficiency virus depends on their interaction with the CXCR4 chemokine receptor”. Molecular Pharmacology. 55 (1): 67–73. PMID 9882699.
- ^ Bridger, G.; và đồng nghiệp (1993). “Linked cyclic polyamines with activity against HIV. WO/1993/012096”.[liên kết hỏng]
- ^ Ciampolini, M.; Fabbrizzi, L.; Perotti, A.; Poggi, A.; Seghi, B.; Zanobini, F. (1987). “Dinickel and dicopper complexes with N,N-linked bis(cyclam) ligands. An ideal system for the investigation of electrostatic effects on the redox behavior of pairs of metal ions”. Inorganic Chemistry. 26 (21): 3527–3533. doi:10.1021/ic00268a022.
- ^ Davies, S. L.; Serradell, N.; Bolós, J.; Bayés, M. (2007). “Plerixafor Hydrochloride”. Drugs of the Future. 32 (2): 123. doi:10.1358/dof.2007.032.02.1071897.
- ^ “Mozobil approved for non-Hodgkin's lymphoma and multiple myeloma” (Thông cáo báo chí). Monthly Prescribing Reference. ngày 18 tháng 12 năm 2008. Truy cập ngày 3 tháng 1 năm 2009.
- ^ Notice of Decision for MOZOBIL[liên kết hỏng]
- ^ Smith, M. C. P.; Luker, K. E.; Garbow, J. R.; Prior, J. L.; Jackson, E.; Piwnica-Worms, D.; Luker, G. D. (2004). “CXCR4 Regulates Growth of Both Primary and Metastatic Breast Cancer”. Cancer Research. 64 (23): 8604–8612. doi:10.1158/0008-5472.CAN-04-1844. PMID 15574767.
- ^ Kioi, M.; Vogel, H.; Schultz, G.; Hoffman, R. M.; Harsh, G. R.; Brown, J. M. (2010). “Inhibition of vasculogenesis, but not angiogenesis, prevents the recurrence of glioblastoma after irradiation in mice”. Journal of Clinical Investigation. 120 (3): 694–705. doi:10.1172/JCI40283. PMC 2827954. PMID 20179352.
- ^ Pitchford, S.; Furze, R.; Jones, C.; Wengner, A.; Rankin, S. (2009). “Differential Mobilization of Subsets of Progenitor Cells from the Bone Marrow”. Cell Stem Cell. 4 (1): 62–72. doi:10.1016/j.stem.2008.10.017. PMID 19128793.
- ^ Wilson NM, Jung H, Ripsch MS, Miller RJ, White FA (tháng 3 năm 2011). “CXCR4 Signaling Mediates Morphine-induced Tactile Hyperalgesia”. Brain, Behavior, and Immunity. 25 (3): 565–73. doi:10.1016/j.bbi.2010.12.014. PMC 3039030. PMID 21193025.
- ^ Abiri, Ardavan (tháng 9 năm 2018). “Plerixafor and related macrocyclic amines are potential drug candidates in treatment of malaria by "filling the flap" region of plasmepsin enzymes”. Medical Hypotheses. 118: 68–73. doi:10.1016/j.mehy.2018.06.020.