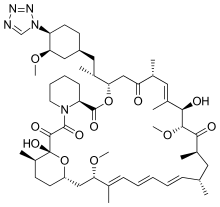
Zotarolimus
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Đồng nghĩa | (42S)-42-Deoxy-42-(1H-tetrazol-1-yl)-rapamycin |
| Mã ATC |
|
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEMBL | |
| Dữ liệu hóa lý | |
| Công thức hóa học | C52H79N5O12 |
| Khối lượng phân tử | 966.21 |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
Zotarolimus (INN, tên mã ABT-578) là một chất ức chế miễn dịch. Nó là một dẫn xuất bán tổng hợp của sirolimus (rapamycin). Nó được thiết kế để sử dụng trong stent với phosphorylcholine như một chất mang. Zotarolimus, hoặc ABT-578, ban đầu được sử dụng trên nền tảng stent mạch vành của Abbott để giảm viêm sớm và phục hồi; tuy nhiên, Zotarolimus đã thất bại trong điểm cuối chính của Abbott khi đưa hệ thống phân phối thuốc / stent của họ ra thị trường. Thuốc đã được bán / phân phối cho Medtronic để sử dụng trên nền tảng stent của họ, đây là loại thuốc họ sử dụng ngày nay. Stent mạch vành làm giảm các biến chứng sớm và cải thiện kết quả lâm sàng muộn ở bệnh nhân cần điều trị tim mạch can thiệp.[1] Cấy ghép stent mạch vành đầu tiên của con người được thực hiện lần đầu tiên vào năm 1986 bởi Puel et al.[2] Tuy nhiên, có những biến chứng liên quan đến việc sử dụng stent, phát triển huyết khối làm cản trở hiệu quả của stent mạch vành, biến chứng xuất huyết và phục hồi là những vấn đề liên quan đến stent.
Những biến chứng này đã thúc đẩy sự phát triển của stent rửa thuốc. Stent bị ràng buộc bởi một màng bao gồm các polyme không chỉ giải phóng chậm zotarolimus và các dẫn xuất của nó vào các mô xung quanh mà còn không tạo ra phản ứng viêm của cơ thể.
Medtronic đang sử dụng zotarolimus làm chất chống tăng sinh trong lớp phủ polymer của các sản phẩm Endeavour và Resolute của họ.[3]
Lý lịch
[sửa | sửa mã nguồn]Các đặc tính ức chế tăng trưởng vốn có của nhiều tác nhân chống ung thư làm cho các loại thuốc này trở thành ứng cử viên lý tưởng cho việc ngăn chặn sự phục hồi. Tuy nhiên, những đặc tính tương tự này thường liên quan đến độc tế bào ở liều làm tăng sinh tế bào. Do đó, bản chất tế bào học độc đáo của rapamycin ức chế miễn dịch là cơ sở cho sự phát triển zotarolimus của Johnson và Johnson. Rapamycin ban đầu được chấp thuận để ngăn ngừa thải ghép thận vào năm 1999. Gần đây, Phòng thí nghiệm Abbott đã phát triển một hợp chất từ cùng loại, zotarolimus (trước đây là ABT-578), là tác nhân tế bào học đầu tiên chỉ được sử dụng để chuyển từ stent rửa thuốc để ngăn chặn sự phục hồi.[4]
Stent rửa thuốc
[sửa | sửa mã nguồn]Stent tẩy rửa thuốc đã cách mạng hóa lĩnh vực can thiệp tim mạch và đã cung cấp một sự đổi mới đáng kể để ngăn ngừa động mạch vành tái hẹp. Các lớp phủ polymer cung cấp thuốc chống tăng sinh vào thành mạch là thành phần chính của các thiết bị y tế mang tính cách mạng này. Sự phát triển của stent giúp loại bỏ tác nhân chống tăng sinh mạnh, zotarolimus, từ một loại polymer dựa trên phosphorylcholine tổng hợp được biết đến với cấu hình tương thích sinh học. Zotarolimus là loại thuốc đầu tiên được phát triển dành riêng cho việc giao hàng tại địa phương từ stent để ngăn ngừa sự phục hồi và đã được thử nghiệm rộng rãi để hỗ trợ chỉ định này. Kinh nghiệm lâm sàng với polymer PC cũng rất rộng lớn, vì hơn 120.000 bệnh nhân đã được cấy ghép cho đến nay với stent có chứa lớp phủ không gây huyết khối này.[4]
Cấu trúc và tính chất
[sửa | sửa mã nguồn]Zotarolimus là một chất tương tự được tạo ra bằng cách thay thế một vòng tetrazole thay cho nhóm hydroxyl tự nhiên ở vị trí 42 trong rapamycin được phân lập và tinh chế như một sản phẩm tự nhiên từ quá trình lên men. Trang web sửa đổi này đã được tìm thấy là vị trí khoan dung nhất để giới thiệu những thay đổi cấu trúc mới mà không làm suy yếu hoạt động sinh học. Hợp chất này cực kỳ ưa lipid, với chỉ số octanol rất cao: hệ số phân chia nước, và do đó khả năng hòa tan trong nước bị hạn chế. Những đặc tính này rất thuận lợi cho việc thiết kế stent chứa thuốc có chứa zotarolimus để có được sự giải phóng thuốc kéo dài từ stent trực tiếp vào thành mạch vành. Độ hòa tan trong nước kém ngăn cản sự giải phóng nhanh chóng vào tuần hoàn, vì việc rửa thuốc khỏi stent sẽ bị giới hạn một phần tốc độ hòa tan. Tốc độ giải phóng chậm và khuếch tán tiếp theo của phân tử tạo điều kiện duy trì nồng độ thuốc điều trị tách khỏi stent. Ngoài ra, nhân vật lipophilic của nó ủng hộ xuyên qua màng tế bào để ức chế sự tăng sinh của mô đích. Chỉ số octanol: hệ số phân vùng nước của một số hợp chất, gần đây thu được trong một nghiên cứu so sánh, chỉ ra rằng zotarolimus là loại lipophilic nhất trong tất cả các thuốc DES [4]
Restenosis
[sửa | sửa mã nguồn]Zotarolimus được sử dụng để chống lại sự phục hồi. Restenosis thường được mô tả bằng các thử nghiệm lâm sàng theo cách tiếp cận nhị phân, còn được gọi là "restenosis nhị phân" hoặc chỉ là "hẹp nhị phân". Hẹp nhị phân được định nghĩa là hẹp> 50% trong đường kính mạch máu (hẹp đường kính), hoặc mất> 50% mức tăng luminal cấp tính, còn được gọi là "mất muộn" sau "tăng cấp" trong đường kính lum sau khi đặt stent.[1] Thuật ngữ "nhị phân" có nghĩa là bệnh nhân được đặt trong 2 nhóm, những người bị hẹp> 50% và những người bị hẹp <50%. Một tắc nghẽn, hoặc chặn tất cả lưu lượng máu qua một mạch, được coi là hẹp 100%.
Trước đây, restenosis được cho là phát sinh do sự phát triển của dày lên do sự kích thích cơ trơn.[1] Tuy nhiên, bây giờ người ta nghĩ rằng co rút giãn mạch máu là cơ chế. Điều này giải thích tại sao đặt stent, làm tăng diện tích vùng thắt lưng, rất hiệu quả trong việc làm giảm sự xuất hiện của restenosis. Hẹp mạch máu thường được phát hiện bằng chụp động mạch, nhưng cũng có thể được phát hiện bằng siêu âm song song và các kỹ thuật hình ảnh khác.
Ngăn ngừa hạn chế
[sửa | sửa mã nguồn]Những tiến bộ chính trong phòng ngừa restenosis là sử dụng stent. Nghiên cứu Stent Restenosis (STRESS) chỉ ra rằng stent tỷ lệ phục hồi thấp hơn đến 32% so với các kỹ thuật y tế khác kết hợp để chỉ hạ thấp nó xuống 42%.[1]
Tác dụng sinh lý
[sửa | sửa mã nguồn]Sự kiện sinh học quan trọng liên quan đến quá trình phục hồi rõ ràng là sự tăng sinh của các tế bào cơ trơn để đáp ứng với sự mở rộng của một cơ thể nước ngoài chống lại thành mạch. Phản ứng tăng sinh này được bắt đầu bằng sự biểu hiện sớm của các yếu tố tăng trưởng như đồng dạng PDGF, bFGF, thrombin, liên kết với các thụ thể tế bào.
Tuy nhiên, chìa khóa để hiểu cơ chế mà các hợp chất như zotarolimus ức chế sự tăng sinh tế bào dựa trên các sự kiện xảy ra ở hạ lưu của liên kết yếu tố tăng trưởng này. Các sự kiện tải nạp tín hiệu mà đỉnh điểm là bắt giữ chu kỳ tế bào trong pha G1 được bắt đầu do kết quả phối tử với một immunophilin được gọi là protein liên kết FK-12. Việc chỉ định FK dựa trên các nghiên cứu ban đầu được thực hiện với tacrolimus, trước đây gọi là FK-506, liên kết protein tế bào chất này với ái lực cao.
Các cuộc điều tra sau đó cho thấy rapamycin cũng liên kết với mục tiêu nội bào này, tạo thành phức hợp rapamycin FKBP12, không gây ức chế, nhưng có khả năng ngăn chặn một protein kinase tách rời được gọi là mục tiêu của rapamycin (TOR). TOR lần đầu tiên được phát hiện trong nấm men [5] và sau đó được xác định trong các tế bào nhân chuẩn, nơi nó được chỉ định là mTOR, mục tiêu động vật có vú của rapamycin. Tầm quan trọng của mTOR dựa trên khả năng phosphoryl hóa một số protein quan trọng, bao gồm cả những protein liên quan đến tổng hợp protein (p70s6kinase) và bắt đầu dịch mã (4E-BP1).
Điều đặc biệt quan trọng là vai trò của mTOR trong việc điều chỉnh p27kip1, một chất ức chế các kinase phụ thuộc cyclin như cdk2. Sự ràng buộc của các tác nhân như rapamycin và zotarolimus với mTOR được cho là ngăn chặn vai trò quan trọng của mTOR trong các sự kiện tế bào này, dẫn đến việc bắt giữ chu kỳ tế bào và cuối cùng là tăng sinh tế bào.
Tham khảo
[sửa | sửa mã nguồn]- ^ a b c d Braunwald E, Zipes D, Libby P biên tập (2001). Heart diseases: a textbook of cardiovascular disease (ấn bản thứ 6). Philadelphia: Saunders Elsevier.
- ^ Sigwart, U; Puel, J; Mirkovitch, V; Joffre, F; Kappenberger, L (1987). “Intravascular stents to prevent occlusion and restenosis after transluminal angioplasty”. The New England Journal of Medicine. 316 (12): 701–6. doi:10.1056/NEJM198703193161201. PMID 2950322.
- ^ “Medtronic Receives FDA Approval for Endeavor Zotarolimus-Eluting Coronary Stent System”. Bản gốc lưu trữ ngày 16 tháng 2 năm 2012.
- ^ a b c Burke, Sandra E.; Kuntz, Richard E.; Schwartz, Lewis B. (2006). “Zotarolimus (ABT-578) eluting stents”. Advanced Drug Delivery Reviews. 58 (3): 437–46. doi:10.1016/j.addr.2006.01.021. PMID 16581153.
- ^ Heitman, J; Movva, NR; Hall, MN (1991). “Targets for cell cycle arrest by the immunosuppressant rapamycin in yeast”. Science. 253 (5022): 905–9. doi:10.1126/science.1715094. PMID 1715094.