Telaprevir
Bài viết này là một bản dịch thô từ ngôn ngữ khác. Đây có thể là kết quả của máy tính hoặc của người chưa thông thạo dịch thuật. |
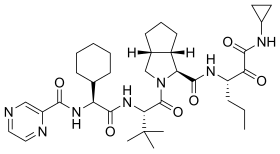 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Incivek, Incivo |
| AHFS/Drugs.com | Thông tin thuốc cho người dùng |
| MedlinePlus | a611038 |
| Giấy phép |
|
| Danh mục cho thai kỳ |
|
| Dược đồ sử dụng | Oral[1] |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Dữ liệu dược động học | |
| Liên kết protein huyết tương | 59–76% [2] |
| Chuyển hóa dược phẩm | extensive Gan |
| Chu kỳ bán rã sinh học | 9–11 hours [2] |
| Bài tiết | 90% (bile), 9% (exhaled air), 1% (urine) |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| NIAID ChemDB | |
| ECHA InfoCard | 100.129.857 |
| Dữ liệu hóa lý | |
| Công thức hóa học | C36H53N7O6 |
| Khối lượng phân tử | 679.85 g/mol |
Định danh hóa học quốc tế
| |
| (kiểm chứng) | |
Telaprevir (VX-950), được bán trên thị trường dưới tên thương hiệu Incivek và Incivo, là một loại dược phẩm để điều trị viêm gan C do Vertex Enterprises và Johnson & Johnson hợp tác phát triển. Nó là thành viên của một nhóm thuốc chống vi rút được gọi là thuốc ức chế protease.[3] Cụ thể, telaprevir ức chế protease NS3/4A.[4] Telaprevir chỉ được chỉ định để sử dụng chống lại nhiễm virut viêm gan C genotype 1 và chưa được chứng minh là có ảnh hưởng hoặc an toàn khi sử dụng cho các kiểu gen khác của virus.
Thử nghiệm lâm sàng và phê duyệt
[sửa | sửa mã nguồn]Trong một thử nghiệm ngẫu nhiên có kiểm soát (PRISE3) ở những bệnh nhân từng thất bại với phác đồ chuẩn với peginterferon alfa-2a và ribavirin, tái điều trị với việc bổ sung telaprevir vào phác đồ cho tỷ lệ đáp ứng siêu vi bền vững (SVR) cao hơn so với tái điều trị bằng peginterferon alfa-2a và ribavirin.[5] Ở những bệnh nhân được điều trị peginterferon alfa-2a và ribavirin trong một năm, nhóm được bổ sung telaprevir trong 24 tuần cùng với việc điều trị chuẩn trong 48 tuần đạt được SVR là 53% so với 14% ở những bệnh nhân không dùng telaprevir. Trong nghiên cứu đó, điều trị ngắn chỉ với ba tháng telaprevir và sáu tháng điều trị bằng peginterferon alfa-2a và ribavirin đạt được SVR là 51%. Trong một thử nghiệm ngẫu nhiên có kiểm soát thứ hai (REALIZE) ở những bệnh nhân đã tái phát hoặc không đạt SVR với điều trị trước, tỷ lệ đạt SVR cao hơn ở những bệnh nhân được điều trị bằng telaprevir (83% đến 88%) so với 24% ở nhóm chứng.[6] Trong một thử nghiệm thứ ba (ADVANCE) cho những bệnh nhân chưa được điều trị trước đó,[7] số lượng bệnh nhân dùng telaprevir đạt SVR cao hơn (69% đến 75%) so với 44% ở nhóm đối chứng.
Vào ngày 28 tháng 4 năm 2011, Ủy ban Tư vấn về Thuốc chống vi-rút của FDA đã bầu chọn 18-0 để đề xuất telaprevir cho những người mắc bệnh viêm gan C mạn tính kiểu gen 1. Ủy ban đã xem xét dữ liệu thử nghiệm lâm sàng (bao gồm các phát hiện từ các nghiên cứu giai đoạn III) cho thấy rằng việc kết hợp telaprevir với pegylated interferon và ribavirin tạo ra tỷ lệ chữa khỏi cao hơn và trong thời gian ngắn hơn so với điều trị tiêu chuẩn đơn thuần. Sự cải thiện này là đáng chú ý nhất đối với những bệnh nhân khó điều trị bao gồm cả những người có HCV genotype 1, những người bị xơ gan và những người không đáp ứng với liệu pháp điều trị dựa trên interferon trước đó. Boceprevir của Merck, cũng là một thuốc chống viêm gan C mới, đã được đưa ra một đề nghị tích cực bởi các ủy ban tương tự, vào ngày hôm trước.[8] Telaprevir đã được phê duyệt hoàn toàn để sử dụng tại Hoa Kỳ vào tháng 5 năm 2011.[9]
Có giả thuyết cho rằng di truyền vật chủ đóng một vai trò thiết yếu trong khả năng không chỉ xóa nhiễm viêm gan C cấp tính mà còn đạt được đáp ứng virus học bền vững (SVR) đối với liệu pháp dựa trên interferon đã được chứng minh với phát hiện gần đây về hai đa hình đơn nucleotide trên nhiễm sắc thể 19. Các biến thể trong alen nhỏ rs8099917 và đa hình proximate rs12979860, ngược dòng 3 kb của gen interleukin (IL)-28B, mã hóa cytokine IFN-của virus chống vi rút nội sinh. Tần số khác nhau của các alen này trong các nhóm dân tộc trên toàn thế giới cũng có thể giải thích tỷ lệ khác nhau của SVR giữa chúng. Xét nghiệm cho một trong những đa hình này hiện có sẵn trên thị trường và có thể đóng vai trò là một yếu tố dự báo mạnh mẽ về cơ hội đạt được SVR của bệnh nhân. Có lẽ quan trọng hơn, xét nghiệm có thể giúp cá nhân bác sĩ lâm sàng điều chỉnh thời gian và thậm chí là loại trị liệu thích hợp nhất cho một bệnh nhân, mới nhiễm virus viêm gan C mạn tính.
Tác dụng phụ
[sửa | sửa mã nguồn]Tác dụng phụ phổ biến nhất là phát ban. Các tác dụng phụ cấp 3 (chủ yếu là thiếu máu và giảm bạch cầu/giảm bạch cầu trung tính) thường gặp hơn ở các nhóm telaprevir so với nhóm đối chứng (37% so với 22%). Sau khi nhận được báo cáo về các phản ứng da nghiêm trọng, một số bệnh nhân tử vong, ở bệnh nhân dùng thuốc viêm gan C Incivek (telaprevir) kết hợp với thuốc peginterferon alfa và ribavirin (điều trị kết hợp Incivek), Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã thêm một hộp đen cảnh báo cho nhãn của sản phẩm Vertex Pharmaceutical Inc này. 1 Vào ngày 19 tháng 12 năm 2012, Vertex tuyên bố sẽ bổ sung một cảnh báo đóng hộp về các tác dụng phụ có thể xảy ra trên nhãn telaprevir của Hoa Kỳ, sau "báo cáo về một số ít phản ứng da gây tử vong ở những bệnh nhân tiếp tục điều trị kết hợp Incivek sau một làn da nghiêm trọng phản ứng đã được xác định. FDA báo cáo hai người đã chết vì các phản ứng da nghiêm trọng do điều trị kết hợp Incivek và tổng cộng 112 bệnh nhân đã phát triển các phản ứng da nghiêm trọng thuộc hai loại khác nhau.[10]
Khả dụng
[sửa | sửa mã nguồn]Chi phí điều trị ba lần dựa trên telaprevir cho viêm gan C là $ 189.000 mỗi phản ứng siêu vi kéo dài.[11]
Vào ngày 12 tháng 8 năm 2014, Công ty Dược phẩm Vertex tuyên bố sẽ ngừng sản xuất nhãn hiệu telaprevir, Incivek, do nhu cầu thuốc giảm do cạnh tranh từ các phương pháp điều trị viêm gan C mới hơn.[12]
Tham khảo
[sửa | sửa mã nguồn]- ^ Kim, Jenny; Culley, Colleen; Mohammad Rima, Telaprevir (2012). “An Oral Protease Inhibitor for Hepatitis C Virus Infection”. Am J Health Syst Pharm. 69 (1): 19–33. doi:10.2146/ajhp110123. PMID 22180548.
- ^ a b Kiser JJ, Burton JR, Anderson PL, Everson GT (tháng 5 năm 2012). “Review”. Hepatology. 55 (5): 1620–8. doi:10.1002/hep.25653. PMC 3345276. PMID 22331658.
- ^ Revill P, Serradell N, Bolos J, Rosa E (2007). “Telaprevir”. Drugs of the Future. 32 (9): 788. doi:10.1358/dof.2007.032.09.1138229.
- ^ Lin C, Kwong AD, Perni RB (tháng 3 năm 2006). “Discovery and development of VX-950, a novel, covalent, and reversible inhibitor of hepatitis C virus NS3.4A serine protease”. Infect Disord Drug Targets. 6 (1): 3–16. doi:10.2174/187152606776056706. PMID 16787300.
- ^ McHutchison JG, Manns MP, Muir AJ, và đồng nghiệp (2010). “Telaprevir for previously treated chronic HCV infection”. N Engl J Med. 362 (14): 1292–303. doi:10.1056/NEJMoa0908014. PMID 20375406.
- ^ Zeuzem S, Andreone P, Pol S, và đồng nghiệp (2011). “Telaprevir for retreatment of HCV infection”. N Engl J Med. 364 (25): 2417–28. doi:10.1056/NEJMoa1013086. PMID 21696308.
- ^ Jacobson IM, McHutchison JG, Dusheiko G, và đồng nghiệp (2011). “Telaprevir for previously untreated chronic hepatitis C virus infection”. N Engl J Med. 364 (25): 2405–16. doi:10.1056/NEJMoa1012912. PMID 21696307.
- ^ “FDA recommends approval for Telaprevir and Boceprevir”. ngày 3 tháng 5 năm 2011. Bản gốc lưu trữ ngày 22 tháng 8 năm 2021. Truy cập ngày 16 tháng 6 năm 2019.
- ^ “FDA Approves Telaprevir for HCV”. ngày 23 tháng 5 năm 2011.
- ^ Staff, Boston.com. ngày 19 tháng 12 năm 2012. Vertex updates label of hepatitis C drug after reports of a ‘small number of fatal skin reactions’
- ^ Tucker, Miriam E (ngày 13 tháng 11 năm 2013). “Costs for Hepatitis C Treatment Skyrocket”. Medscape Medical News.
- ^ Silverman, Ed (ngày 12 tháng 8 năm 2014). “From Riches to Rags: Vertex Discontinues Incivek as Sales Evaporate”. Pharmalot (Blog). Dow Jones & Company. Truy cập ngày 13 tháng 8 năm 2014.
 GIẢM
50%
GIẢM
50%
 GIẢM
26%
GIẢM
26%
 GIẢM
47%
GIẢM
47%
 GIẢM
49%
GIẢM
49%
 GIẢM
19%
GIẢM
19%



![[Giả thuyết] Paimon là ai?](https://www.creativeuncut.com/gallery-39/art/gi-paimon-illustration.jpg)