Implantacija (zametak)
| Implantacija | |
|---|---|
 Implantacija kao jedna od ranih faza ljudskog embrionskog razvoja | |
| Detalji | |
| Carnegie stage | 3 |
| Dani | 5–9 |
| Gives rise to | Gastrula |
| Sistem | Ženski reproduktivni |
| Anatomska terminologija | |
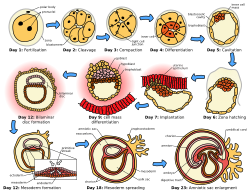
Implantacija, znana i kao nidacija (=ugnježđivanje)[1] je faza embrionskog razvoja sisara sa placentom u kojoj blastocist nastaje, pričvrsti, priljubii i upadne u zid materica ženki.[2] Implantacija je prva faza gestacije i, kada je uspješna, ženka se smatra trudnom.[3] Kod žena implantirani embrion se otkriva prisustvom povećanih nivoa ljudskog horionskog gonadotropina (hCG) u testu trudnoće.[3] Implantirani embrion će dobiti kisik i hranljive materije kako bi rastao.
Postoji velika varijacija u tipu trofoblastnih ćelija i strukturama placente kod različitih vrsta sisara.[4] Od pet priznatih faza implantacije, uključujući dvije preimplantacijske faze koje prethode placentaciji, prva četiri su slična za sve vrste. Pet faza su migracija i izlijeganje, prekontakt, vezanje, adhezija i invazija.[4] Dvije faze prije implantacije su povezane sa preimplantacijskim embrionom.[5][6]
Kod ljudi, nakon faze izlijeganja koja se odvija oko četiri do pet dana nakon oplodnje, počinje proces implantacije. Do kraja prve sedmice, blastocista je površno pričvršćena za maternični endometrij. Do kraja druge sedmice implantacija je završena.[7]
Faze implantacije
[uredi | uredi izvor]Postoji pet prepoznatih faza implantacije kod sisara, uključujući dvije preimplantacijske faze koje prethode formiranju posteljice. To su: migracija i izlijeganje, pretkontakt, vezanje, adhezija i invazija. Prve četiri faze su slične kod svih vrsta s promjenjivim procesom invazije.[4][8] Ove tri faze apozicije, privrženosti i invazije se također alternativno nazivaju kontakt (apozicija), adhezija (vezanost) i penetracija (invazija),[5][6] i mogu se odvijati samo tokom ograničenog vremenskog okvira poznatog kao prozor implantacije kada je maternica najprijemčivija.
Migracija i izlijeganje
[uredi | uredi izvor]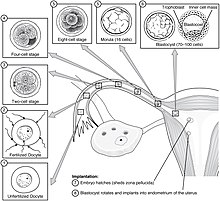
Postoje dvije faze migracije uključene u implantaciju, prva je migracija zigota, a druga je migracija trofoblasta.[9] Oplodnja oocita, odvija se u ampuli jajovoda. Ciliije na sluznici jajovoda pomjeraju zigot u migraciji prema materici.
Tokom ove migracije, zigot prolazi kroz izvjestan broj dioba i stvara klupko od 16 kompaktiranih blastomera koje se naziva morula.[10] Morula ulazi u maternicu nakon tri ili četiri dana, a pri tome se u moruli formira šupljina koja se zove blastocel koja proizvodi blastocistu. Blastocista sadrži unutrašnju ćelijsku masu koja će se dalje razviti u pravi embrion, i vanjski ćelijski sloj trofoblasta koji će se razviti u vanembrionske membrane (fetusne membrane).[11]
Blastocista je i dalje zatvorena u omotaču jajeta poznatom kao zona pellucida, i da bi mogla da se implantira u zid maternice, mora se osloboditi ovog omotača. Ova faza je poznata kao zona izlijeganja, i kada se dovoljno rastvori, blastocista je u stanju da započne fazu apozicije implantacije. Lizni faktori u šupljini maternice, kao i faktori iz same blastociste su bitni za razgradnju omotača jajeta. Mehanizmi u potonjem su naznačeni time da zona pellucida ostaje netaknuta ako se neoplođeno jaje stavi u maternicu pod istim uslovima.[12]
Među poznatim molekulskim regulatorima koji podstiču izlijeganje su pretežno proteaze koje su stimulisane raznim faktorima rasta.[13] Blastocista takođe proizvodi citokine, i proupalne i antiupalne, koji imaju ključnu ulogu tokom implantacije i drugih faza trudnoće. Oba tipa citokina moduliraju aktivnost proteaza, uključujući MMP, plazminogenske aktivatore i katepsine.[13] Nije poznato da li su citokini koji su uključeni u izlijeganje proupalni ili protivupalni, ili koje su proteaze uključene. Međutim, dobro je prihvaćeno da su proupalni citokini dominantni tokom implantacije. Citokini su također prisutni u mlijeku materice koji bi mogli regulirati razvoj i funkciju blastocista, ali nema dokaza koji podržavaju njihovu uključenost u izlijeganje. Faktor inhibicije leukemije (LIF) je proupalni citokin koji se eksprimira u endometriju tokom luteusne faze menstruacijskog ciklusa, sa najvećom ekspresijom uočenom tokom perioda implantacije. LIF ima ulogu u adheziji i invaziji.[13]
Pomoćna zona izlijeganja može se odvijati u potpomognutoj reprodukciji, gdje zona pellucida može biti vještački probušena, kako bi se olakšalo izlijeganje.[14]
Apozicija
[uredi | uredi izvor]Nakon zone izlijeganja, prva labava veza ili kontakt između blastociste i endometrija naziva se apozicija. Apozicija se obično vrši tamo gdje postoji mala kripta u endometriju, kao i tamo gdje je došlo do dovoljnog razbijanja zona pellucida da bi se omogućilo blastocistnom trofoblastu da direktno kontaktira endometrij koji leži ispod. Na kraju, unutrašnja ćelijska masa (također zvana embrioblast), unutar sloja trofoblasta, je najbliže decidui. Ako unutrašnja ćelijska masa nije poravnata sa deciduom pri apoziciji, ona ima sposobnost da se slobodno rotira unutar trofoblasta i postigne ovo poravnanje. Apozicija je samo slaba interakcija trofektoderma sa epitelom maternice koja je nestabilna na smicanje. Apozicija je također reverzibilna što omogućava repoziciju blastociste u maternici.[10]
Adhezija
[uredi | uredi izvor]Adhezija je mnogo jače vezivanje za endometrij od labave apozicije.
Trofoblasti prianjaju prodiranjem u endometrij, sa izbočinama ćelija trofoblasta.
Ovu aktivnost prianjanja vrše mikroresice koje se nalaze na trofoblastu. Trofoblast ima veze vezivnih vlakana, kao što su laminin, kolagen tipa IV i integrini koji pomažu u ovom procesu adhezije.[15]
Mucin-16 je transmembranski mucin eksprimiran na apikalnoj površini materničnog epitela. Ovaj mucin sprečava da se blastocista implantira u nepoželjno locirano na epitelu. Dakle, MUC-16 inhibira adheziju ćelija-ćelija. Pokazalo se da njegovo uklanjanje tokom formiranja pinopoda olakšava invaziju trofoblasta in vitro.[16]
Identitet molekula na trofoblastu i epitelu endometrija koji posreduju u početnoj interakciji između njih ostaje neidentifikovan. Međutim, brojne istraživačke grupe su predložile da je uključen MUC1, član mucinske porodice glikozilovanih proteina.[17] MUC1 je transmembranski glikoprotein koji se eksprimira na apikalnoj površini epitelnih ćelija endometrija tokom perioda implantacije kod ljudi i pokazalo se da je različito izražen između plodnih i neplodnih subjekata tokom tog vremena.[17] MUC1 eksprimira dijelove ugljikohidrata na svoj vanćelijskom domenu koji su ligandi L-selektina, molekula ćelijske adhezije na površini ćelija trofoblasta.[18][19] Model implantacije n vitro dao je dokaze koji podržavaju hipotezu da L-selektin posreduje apoziciju blastociste na epitel materice, interakcijom sa njegovim ligandima.[20]
Invazija
[uredi | uredi izvor]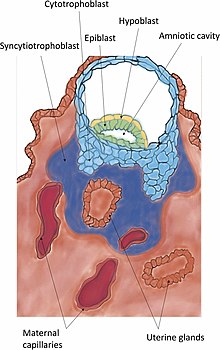
Invazija je dalje uspostavljanje blastociste u endometriju. Protruzije ćelija trofoblasta koje se prianjaju u endometrij nastavljaju da se razmnožavaju i prodiru u u njega pomoću želatinaze A i B.[21] Trofoblasti invadiraju matericu, pokušavajući da dođu do majčinog dotoka krvi, za postavljanje temelja za fetusni protok krvi.[22] Kako ovi trofoblasti prodiru, oni se konačno diferenciraju u višejedarno tkivo, sincicij poznato kao sincitiotrofoblast. Između ovog sloja i blastociste leži citotrofoblast.[23]
Kada sincitiotrofoblast dostigne baznu membranu ispod ćelija decidue, istisne ih kako bi dalje invadirao u stromu materice. Pomjeranje se postiže razgradnjom molekula ćelijske adhezije (CAM) koji povezuju ćelije decidue i pripadajući vanćelijski matriks. Degradacija se postiže lučenjem faktora nekroze tumora-alfa iz sincitiotrofoblasta, koji inhibira ekspresiju CAM-a i beta-katenina. Vanćelijski matriks razgrađuje metaloproteinaze kao što su kolagenaze, želatinaze i matriksne metaloproteinaze, te serinska proteaza.[24] Kolagenaze probavljaju lolagene tip I, II, III, VII i X.[24] Želatinaze postoje u dva oblika; jedan probavlja kolagen tipa IV|, a drugi želatin.[24] Vasnćelijsdki matriks razgrađuje serinske endopeptidaze i metaloproteinaze. Sincitiotrofoblast tada može upasti u endometrij, odvodeći embrio sa sobom gdje se ugrađuje.[24] Na kraju, sincitiotrofoblast dolazi u kontakt s majčinom krvlju i formira horionske resice – početak placentacije. Nakon invazije, pukotina u epitelu materice napravljena ulaskom blastociste je zapečaćena fibrinskim čepom. Fibrinski čep je koagulacija krvnog ugruška i ćelijskih ostataka.[7]
Vanvilozni trofoblasti
[uredi | uredi izvor]Vanvilozni trofoblast ili vanresični trofoblast su ćelije iz invazivnih resica koje migriraju u miometrij majčine maternice. Ove ćelije remodeliraju spiralne arterije kako bi poboljšale i osigurale protok krvi majke u rastućem embriju. Postoje i dokazi da se ovaj proces događa sa venama maternice, stabilizirajući ih kako bi se poboljšala drenaža fetusne krvi i metaboličkog otpada.[25] Također je dokumentovano da trofoblasti migriraju u različita tkiva majke. Zbog toga su trofoblasti uključeni u fenomen poznat kao fetomaterinski mikrohimerizam gdje fetusne ćelije uspostavljaju ćelijske linije u tkivima majke.[26]
Blastocista luči faktore za različite svrhe tokom invazije. Luči nekoliko autokrinih faktora, ciljajući se i stimulirajući ga da dalje napadne endometrij. Horionski gonadotropin je autokrini faktor rasta za blastocistu, dok insulinoliki faktor rasta 2 stimuliše njenu invazivnost.[24] Nadalje, izlučevine odvajaju decidualne ćelije jednu od druge, sprečavaju embrion od odbacivanja od strane majke, pokreću konačnu decidualizaciju i sprečavaju menstruaciju.
Imunosupresivnost
[uredi | uredi izvor]Embrion se razlikuje od majčinih ćelija i bio bi odbačen kao parazit od strane imunskog sistema majke da ne luči imunosupresivne agense. Takvi agensi uključuju faktor aktivacije trombocita, horionski gonadotropin, faktor rane trudnoće, prostaglandin E2, interleukin-1 alfa, interleukin 6 , interferon-alfa, inhibicijski faktor leukemije i kolonije-stimulirajući faktor.
Prevencija menstruacije
[uredi | uredi izvor]Ljudski horionski gonadotropin (hCG) ne djeluje samo kao imunosupresiv,[24], već i signalizira majci da je trudna, sprječavajući luteolizu corpus luteum i menstruacije, održavajući funkciju žutog tijela.
Ostalii faktori
[uredi | uredi izvor]Ostali faktori koje luče blastocista su;
- Faktor oslobađanja histamina Izveden iz embrija
- Aktivator tkivnog plazminogena kao i njegovi inhibitori
- Estradiol
- β1-integrini
- Faktor rasta fibroblasta
- CYTL1[27]
- Transformirajući faktor rasta alfa
- Inhibin
- Preimplantacijski faktor
Receptivnost materice
[uredi | uredi izvor]Da bi se omogućila implantacija, maternica prolazi kroz promjene kako bi mogla primiti koncept. Receptivnost uključuje promjene u ćelijama endometrija u formiranju pinopoda koji pomažu u apsorpciji materične tekućine; promjene u debljini endometrija i razvoju njegove opskrbe krvlju, te formiranju deciduu. Kolektivno su ove promjene poznate kao transformacija plazmamembrane i približavaju blastocist endometriju i imobiliziraju ga. Tokom ove faze blastocista se još uvijek može eliminirati ispiranjem iz maternice.[28][29]
Uspješna implantacija koovisna je o održivosti embrija i receptivnosti materice.[30] Kritičan uključen faktor je razvojna sinhronija između embrija i materice.[31] Sinhronija daje kratak period receptivnosti poznat kao prozor implantacije i uključuje mnogo usaglašavanja između blastociste i endometrija u ovoj fazi.[32][33][34] Tokom adhezije ova komunikacija se prenosi interakcijom receptor-ligand, kako integrin-matriksnj tako i proteoglikanski. Proteoglikanski receptori se nalaze na površini decidua, a njihovi dvojnici, proteoglikani, nalaze se oko ćelija trofoblasta blastociste. Ovaj ligand-receptorski sistem je takođe prisutan samo na prozoru implantacije.[24] Blastocista signalizira endometriju da se dalje prilagodi njegovom prisustvu, naprimjer promjenama u citoskeletu decidualnih ćelija. Ovo zauzvrat pomjera decidualne ćelije iz njihove veze sa osnovnom baznom laminom, što omogućava blastocisti da izvrši sledeću invaziju.[24]
Prozor implantacije
[uredi | uredi izvor]Prozor implantacije je ograničen vremenski okvir za uspješno pričvršćivanje blastociste.[35] Kod ljudi je receptivnost materice optimalna 20-24 dana sekretorne faze menstrualnog ciklusa kada su nivoi luteinizirajućeg hormona na svom vrhuncu.[5][36] In humans the window of implantation is only available for 24–36 hours.[37]
mikrobiom endometrija ima važnu ulogu u uspešnoj implantaciji u kontroli funkcije ćelija endometrija i funkcije lokalnog imunskog sistema koji sprečava rast patogena. To je povezano sa lučenjem zaštitnih supstanci.[38][39]
Pinopode
[uredi | uredi izvor]Pinopode se formiraju na početku prozora implantacije i nalaze se kod mnogih vrsta.[35][40] To su izbočine nalik pečurkama iz apikalne ćelijske membrane epitelnih ćelija materice.[35] Pinopode se formiraju oticanjem ovih epitelnih ćelija i spajanjem niza mikroresica, kako bi se postigla maksimalna veličina.[40] Pojavljuju se između 19. i 21. dana gestacijske dobi, a potpuno se formiraju 20. dana.[35] Ovo odgovara dobu oplodnje od otprilike pet do sedam dana, što dobro odgovara vremenu implantacije. Pinopode opstaju samo najviše dva dana i smatraju se ultrastrukturnim markerima receptivnosti.[40]
Njihov razvoj pojačava progesteron, a inhibiraju estrogeni. Tokom perioda implantacije, adheziju ćelije na ćeliju inhibira MUC1 glikoprotein na površini ćelije, koji pripada glikokaliksu. Pinopode su više od mikroresica i strše kroz glikokaliks, omogućavajući direktan kontakt sa prianjajućim trofoblastom. Najvažniji atribut pinopoda je ovo uklanjanje glikoproteina sa ćelijskih površina epitelnih ćelija maternice.[5] MUC16 takođe nestaje sa ćelijskih površina sa razvojem pinopoda. Neka istraživanja su objavila da pinopode hvataju cilijama, što sprečava kretanje embrija, a tokom implantacije omogućava bliski kontakt i prianjanje embrija.[35]
Pinopode donose materničnu tečnost i njene makromolekule u ćelije procesom endocitoze. Ovo smanjuje volumen materice, približavajući zidove blastocisti koja pluta u njoj. Dakle, period aktivnih pinopoda može ograničiti prozor implantacije.[24] Pinopode nastavljaju da apsorbuju tečnost, uklanjajući je većinu tokom ranih faza implantacije.
Predecidualizacija
[uredi | uredi izvor]Endometrij se deblja, postaje vaskulariziran i njegove materične žlijezde|žlijezde]] postaju krivudave i pojačane u svojim sekretima. Ove promjene dostižu svoj maksimum oko sedam dana nakon ovulacija.
Nadalje, površina endometrija stvara neki tip zaobljenih ćelija, koje pokrivaju cijelo područje prema šupljini matermice. To se dešava oko 9 do 10 dana nakon ovulacije.[24] Ove ćelije se nazivaju decidualne ćelije, što naglašava da se cijeli njihov sloj odvaja tokom svake menstruacije ako ne dođe do trudnoće, baš kao i lišće listopadnog drveća. Žlijezde materice, s druge strane, smanjuju aktivnost i degeneriraju oko 8 do 9 dana[24] nakon ovulacije u odsustvu trudnoće.
Decidualne ćelije potiču od stromnih ćelija koje su uvijek prisutne u endometriju i čine novi sloj, decidua. Ostatak endometrija, osim toga, izražava razlike između lumenske i bazne strane. Lumenske ćelije formiraju stratum compactum endometrija, za razliku od bazalolateralnog stratum spongiosum, koji se sastoji od prilično spužvastih stromnih ćelija.[24]
Decidualizacija
[uredi | uredi izvor]Decidualizacija se širi ako dođe do trudnoće, dalje razvijajući žlijezde materice, zona compacta i epitel decidualnih ćelija koji ga oblažu. Decidualne ćelije se pune lipidima i glikogenom i poprimaju poliedarski oblik karakterističan za decidualne ćelije. Faktori iz blastociste također pokreću konačno formiranje decidualnih ćelija u njihov pravi oblik. Nasuprot tome, neke decidualne ćelije u blizini blastociste degenerišu, dajući joj hranljive materije.[24] Indikacija embrionskog uticaja je da se decidualizacija dešava u većem stepenu u ciklusima začeća nego u ciklusima bez začeća.[24] Nadalje, slične promjene se primjećuju kada se daju stimulansi koji oponašaju prirodnu invaziju embrija.[24]
Embrion oslobađa serinske proteaze koje uzrokuju depolarizaciju epitelne ćelijske membrane i aktiviraju epitelni natrijski kanal. Ovo pokreće priliv kalcijevih iona (Ca2+) i fosforilaciju CREB. Fosforilacija CREB povećava ekspresiju COX2, što dovodi do oslobađanja prostaglandina E2 (PGE2) iz epitelnih ćelija. PGE2 djeluje na ćelije strome aktivirajući cAMP-ove puteve u stromnim ćelijama, što dovodi do decidualizacije.[41]
Dijelovi decidue
[uredi | uredi izvor]Decidue se mogu organizovati u zasebne sekcije, iako imaju isti sastav.
- Decidua basalis – Ovo je dio decidua koji se nakon implantacije nalazi bazalolateralno u odnosu na embrion.
- Decidua capsularis – Raste preko embriona na lumenskoj strani, zatvarajući ga u endometrij. Okružuje embrion zajedno sa decidua basalis.
- Decidua parietalis – Sve ostale decidue na površini materice pripadaju decidua parietalis.
Decidua tokom trudnoće
[uredi | uredi izvor]Nakon implantacije, decidua ostaje, barem u prvom tromjesečju.[24] Međutim, njeno najizraženije vrijeme je u ranim fazama trudnoće, tokom implantacije. Njenu funkciju okolnog tkiva zamjenjuje definitivna posteljica. Međutim, neki elementi decidualizacije ostaju tokom trudnoće.[24]
Slojevi kompakta i spongioze su još uvijek vidljivi ispod decidua u trudnoći. Žlijezde spongioznog sloja nastavljaju da luče tokom prvog trimestra, kada degenerišu. Međutim, prije tog nestanka, neke žlijezde luče nejednako mnogo. Ovaj fenomen hipersekrecije naziva se Fenomen Arias-Stella,[24] po patologu Javieru Arias-Stelli.
Prilagodba sekreta
[uredi | uredi izvor]| Proteini, glikoproteini i peptidi
koje luči žlijezda materice[24] |
| Matriks-vezani: |
| Fibronektin |
| Laminin |
| Entaktin |
| Kolagen tipa IV |
| Heparan-sulfat |
| Proteoglikan |
| Integrini |
| – |
| Ostali: |
| Mucini |
| Prolaktin |
| IGFBP-1 |
| Glikodelin |
| Endometrijski protein 15 |
| Albumin |
| Beta-lipoprotein |
| Relaksin |
| Faktor rasta fibroblasta 1 |
| Faktor rasta fibroblasta 2 |
| Papalizin-1 |
| Protein odgovora na stres 27 (SRP-27) |
| CA-125 |
| Beta-endorfin |
| Leu-enkefalin |
| Diamin-oksidaza |
| Aktivator tkivnog plazminogena |
| Renin |
| Karboanhidraza zavisna od progesterona |
| Laktoferin |
Ne transformiše se samo sluznica materice, već se menja i sekret iz njenih žlijezda. Ova promena je izazvana povećanim nivoom progesteron iz žutog tela. Meta izlučevina je embrioblast i na njemu ima nekoliko funkcija.
Ishrana
[uredi | uredi izvor]Embrion provede otprilike 72 sata u šupljini materice prije implantacije. U tom periodu ne može dobiti hranu direktno iz krvi majke, već se mora oslanjati na izlučene hranljive materije u materničnu šupljinu, npr. gvožđe i vitamini rastvorljivi u mastima.[24]
Rast i implantacija
[uredi | uredi izvor]Osim ishrane, endometrij luči nekoliko steroidno zavisnih proteina, važnih za rast i implantaciju. Holesterol, kao i steroidi se također luči.[24] Implantacija je dodatno olakšana sintezom matriksnih supstanci, molekula adhezije i površinskih receptora za matrične supstance.
Klinički značaj
[uredi | uredi izvor]Neuspjeh implantacije
[uredi | uredi izvor]Reprodukcija kod ljudi nije veoma efikasna. Samo oko 30% prirodnih začeća rezultira uspješnom trudnoćom. Od neuspjelih trudnoća oko 85% je zbog neuspjeha implantacije.[42] Smatra se da je neuspjeh implantacije uzrokovan neadekvatnom receptivnošću materice u dvije trećine slučajeva, a problemima sa samim embrionom u preostaloj trećini.[43] Većina postupaka IVF ne uspijeva zbog neuspjeha implantacije, što čini skoro polovinu svih neuspjeha trudnoće.[42]
Neadekvatna receptivnost materice može biti uzrokovana abnormalnom citokinskom i hormonskom signalizacijom, kao i epigenetičkim promjenama.[44] Ponovljeni neuspjeh implantacije je uzrok ženske neplodnosti. Stoga se stopa trudnoće može poboljšati optimizacijom receptivnosti endometrija za implantaciju.[44] Procjena implantacijskih markera može pomoći da se predvidi ishod trudnoće i otkrije okultni nedostatak implantacije.[44] Kao dio programa zvanog organ na čipu, razvijen je endometrij na čipu za modeliranje funkcioniranja endometrija koji bi mogao jasnije identificirati uzroke neuspjeha implantacije.[45] Za modeliranje endometrija i njegove uloge u implantaciji razvijeni su također organoidi.[46]
Kod žena sa više od tri neuspjeha implantacije u potpomognutoj reprodukciji, pregled nekoliko malihrandomiziranih kontroliranih studija procijenio je da je upotreba pomoćnog niskomolekulskog heparina poboljšava stopu živorađanih za približno 80%.[47] Podrška lutealnoj fazi može uključivati upotrebu progesterona i ljudskog horionskog gonadotropina (hCG) kako bi se poboljšale šanse za uspješnu implantaciju.[48]
Nedostatak cinka
[uredi | uredi izvor]Cink je ključan za pre začeća (i uspješnu trudnoću), a njegov nedostatak može dovesti do nesposobnog razvoja blastocista. Jednom kada je jaje oplođeno, cink se oslobađa u „cinkovoj iskri“ koja podstiče promjene koje uključuju stvrdnjavanje zona pellucida, sprečavajući polispermiju.[49]
Implantacijsko krvarenje
[uredi | uredi izvor]Krvarenje i mrlje su uobičajene tokom luteusne faze menstruacijskog ciklusa i ranih faza trudnoće, ali nisu povezane sa implantacijom. Implantacijsko krvarenje se javlja između 7 i 14 dana nakon oplodnje,[50] i predstavlja malu količinu blijedog vaginskog krvarenenja ili mrlje koje se mogu pojaviti u ranoj trudnoći zbog prodiranja blastociste u sluznicu materice tokom implantacije.[51][52][53] Do 13. dana mjesto penetracije u endometriju obično je zatvoreno fibrinskim čepom, ali pojačan protok krvi u sincitiotrofoblastne prostore ponekad može uzrokovati krvarenje na tom mjestu.[51] Implantacijsko krvarenje može biti praćeno simptomima kao što su kao što su grčevi, mučnina, osetljivost dojki i glavobolja.[54] Implantacijsko krvarenje se može razlikovati od krvarenje u periodu menstruacije po boji, zgrušavanju, jačini i trajanju protoka.[55][56]
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ "Definition of implantation". www.merriam-webster.com (jezik: engleski). Pristupljeno 26. 4. 2023.
- ^ Niringiyumukiza JD, Cai H, Xiang W (maj 2018). "Prostaglandin E2 involvement in mammalian female fertility: ovulation, fertilization, embryo development and early implantation". Reproductive Biology and Endocrinology. 16 (1): 43. doi:10.1186/s12958-018-0359-5. PMC 5928575. PMID 29716588.
- ^ a b Wilcox AJ, Harmon Q, Doody K, Wolf DP, Adashi EY (april 2020). "Preimplantation loss of fertilized human ova: estimating the unobservable". Human Reproduction. 35 (4): 743–750. doi:10.1093/humrep/deaa048. PMC 8287936 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 32296829. - ^ a b c Imakawa K, Bai R, Fujiwara H, Kusama K (januar 2016). "Conceptus implantation and placentation: molecules related to epithelial-mesenchymal transition, lymphocyte homing, endogenous retroviruses, and exosomes". Reproductive Medicine and Biology. 15 (1): 1–11. doi:10.1007/s12522-015-0215-7. PMC 5715838. PMID 29259417.
- ^ a b c d Kim SM, Kim JS (decembar 2017). "A Review of Mechanisms of Implantation". Development & Reproduction. 21 (4): 351–359. doi:10.12717/DR.2017.21.4.351. PMC 5769129. PMID 29359200.
- ^ a b McGowen MR, Erez O, Romero R, Wildman DE (2014). "The evolution of embryo implantation". The International Journal of Developmental Biology. 58 (2–4): 155–161. doi:10.1387/ijdb.140020dw. PMC 6053685. PMID 25023681.
- ^ a b Moore KL (2020). The developing human: clinically oriented embryology (Eleventh izd.). Edinburgh. str. 35–42. ISBN 978-0-323-61154-1.
- ^ Cakmak H, Taylor HS (mart 2011). "Implantation failure: molecular mechanisms and clinical treatment". Human Reproduction Update. 17 (2): 242–253. doi:10.1093/humupd/dmq037. PMC 3039220. PMID 20729534.
- ^ Ochoa-Bernal MA, Fazleabas AT (mart 2020). "Physiologic Events of Embryo Implantation and Decidualization in Human and Non-Human Primates". International Journal of Molecular Sciences. 21 (6): 1973. doi:10.3390/ijms21061973. PMC 7139778. PMID 32183093.
- ^ a b Gauster M, Moser G, Wernitznig S, Kupper N, Huppertz B (juni 2022). "Early human trophoblast development: from morphology to function". Cellular and Molecular Life Sciences. 79 (6): 345. doi:10.1007/s00018-022-04377-0. PMC 9167809 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 35661923 Provjerite vrijednost parametra|pmid=(pomoć). - ^ Sadler TW (2010). Langman's medical embryology (11th izd.). Philadelphia: Lippincott William & Wilkins. str. 45. ISBN 9780781790697.
- ^ Boron 2004, str. 1172.
- ^ a b c Seshagiri PB, Vani V, Madhulika P (mart 2016). "Cytokines and Blastocyst Hatching". American Journal of Reproductive Immunology. 75 (3): 208–17. doi:10.1111/aji.12464. PMID 26706391. S2CID 11540123.
- ^ IVF-infertility.com
- ^ Singh H, Aplin JD (juli 2009). "Adhesion molecules in endometrial epithelium: tissue integrity and embryo implantation". Journal of Anatomy. 215 (1): 3–13. doi:10.1111/j.1469-7580.2008.01034.x. PMC 2714633. PMID 19453302.
- ^ Gipson IK, Blalock T, Tisdale A, Spurr-Michaud S, Allcorn S, Stavreus-Evers A, Gemzell K (januar 2008). "MUC16 is lost from the uterodome (pinopode) surface of the receptive human endometrium: in vitro evidence that MUC16 is a barrier to trophoblast adherence". Biology of Reproduction. 78 (1): 134–142. doi:10.1095/biolreprod.106.058347. PMID 17942799. S2CID 44999196.
- ^ a b Margarit L, Taylor A, Roberts MH, Hopkins L, Davies C, Brenton AG, et al. (decembar 2010). "MUC1 as a discriminator between endometrium from fertile and infertile patients with PCOS and endometriosis". The Journal of Clinical Endocrinology and Metabolism. 95 (12): 5320–5329. doi:10.1210/jc.2010-0603. PMID 20826587.
- ^ Carson DD, Julian J, Lessey BA, Prakobphol A, Fisher SJ (septembar 2006). "MUC1 is a scaffold for selectin ligands in the human uterus". Frontiers in Bioscience. 11 (1): 2903–2908. doi:10.2741/2018. PMID 16720361.
- ^ Francis LW, Yao SN, Powell LC, Griffiths S, Berquand A, Piasecki T, et al. (februar 2021). "Highly glycosylated MUC1 mediates high affinity L-selectin binding at the human endometrial surface". Journal of Nanobiotechnology. 19 (1): 50. doi:10.1186/s12951-021-00793-9. PMC 7890821. PMID 33596915.
- ^ Genbacev OD, Prakobphol A, Foulk RA, Krtolica AR, Ilic D, Singer MS, et al. (januar 2003). "Trophoblast L-selectin-mediated adhesion at the maternal-fetal interface". Science. 299 (5605): 405–408. Bibcode:2003Sci...299..405G. doi:10.1126/science.1079546. PMID 12532021. S2CID 15462671.
- ^ Zhu JY, Pang ZJ, Yu YH (2012). "Regulation of trophoblast invasion: the role of matrix metalloproteinases". Reviews in Obstetrics & Gynecology. 5 (3–4): e137–e143. PMC 3594863. PMID 23483768.
- ^ Carter AM, Enders AC, Pijnenborg R (mart 2015). "The role of invasive trophoblast in implantation and placentation of primates". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 370 (1663): 20140070. doi:10.1098/rstb.2014.0070. PMC 4305171. PMID 25602074.
- ^ Gardiner C, Tannetta DS, Simms CA, Harrison P, Redman CW, Sargent IL (2011). "Syncytiotrophoblast microvesicles released from pre-eclampsia placentae exhibit increased tissue factor activity". PLOS ONE. 6 (10): e26313. Bibcode:2011PLoSO...626313G. doi:10.1371/journal.pone.0026313. PMC 3194796. PMID 22022598.
- ^ a b c d e f g h i j k l m n o p q r s t u Boron W]], Boulpaep EW (2004). Medical Physiology: A Cellular And Molecular Approaoch. Oxford: Elsevier. ISBN 1-4160-2328-3. OCLC 61527528. Greška u vankuverskom stilu: name u nazivu 1 (pomoć)
- ^ Moser G, Weiss G, Sundl M, Gauster M, Siwetz M, Lang-Olip I, Huppertz B (mart 2017). "Extravillous trophoblasts invade more than uterine arteries: evidence for the invasion of uterine veins". Histochemistry and Cell Biology. 147 (3): 353–366. doi:10.1007/s00418-016-1509-5. PMC 5344955. PMID 27774579.
- ^ Dawe GS, Tan XW, Xiao ZC (januar 2007). "Cell migration from baby to mother". Cell Adhesion & Migration. 1 (1): 19–27. doi:10.4161/cam.4082. PMC 2633676. PMID 19262088.
- ^ Ai Z, Jing W, Fang L (2015). "Cytokine-Like Protein 1(Cytl1): A Potential Molecular Mediator in Embryo Implantation". PLOS ONE. 11 (1): e0147424. doi:10.1371/journal.pone.0147424. PMC 4723121. PMID 26800213.
- ^ Murphy CR (august 2004). "Uterine receptivity and the plasma membrane transformation". Cell Research. 14 (4): 259–267. doi:10.1038/sj.cr.7290227. PMID 15353123. S2CID 24023502.
- ^ Murphy CR, Shaw TJ (decembar 1994). "Plasma membrane transformation: a common response of uterine epithelial cells during the peri-implantation period". Cell Biology International. 18 (12): 1115–1128. doi:10.1006/cbir.1994.1038. PMID 7703952. S2CID 22769575.
- ^ Yang Y, Zhu QY, Liu JL (novembar 2021). "Deciphering mouse uterine receptivity for embryo implantation at single-cell resolution". Cell Proliferation. 54 (11): e13128. doi:10.1111/cpr.13128. PMC 8560620 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 34558134 Provjerite vrijednost parametra|pmid=(pomoć). - ^ Teh WT, McBain J, Rogers P (novembar 2016). "What is the contribution of embryo-endometrial asynchrony to implantation failure?". Journal of Assisted Reproduction and Genetics. 33 (11): 1419–1430. doi:10.1007/s10815-016-0773-6. PMC 5125144. PMID 27480540.
- ^ Sternberg AK, Buck VU, Classen-Linke I, Leube RE (august 2021). "How Mechanical Forces Change the Human Endometrium during the Menstrual Cycle in Preparation for Embryo Implantation". Cells. 10 (8): 2008. doi:10.3390/cells10082008. PMC 8391722 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 34440776 Provjerite vrijednost parametra|pmid=(pomoć). - ^ Wu HM, Chen LH, Hsu LT, Lai CH (novembar 2022). "Immune Tolerance of Embryo Implantation and Pregnancy: The Role of Human Decidual Stromal Cell- and Embryonic-Derived Extracellular Vesicles". Int J Mol Sci. 23 (21): 13382. doi:10.3390/ijms232113382. PMC 9658721 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 36362169 Provjerite vrijednost parametra|pmid=(pomoć). - ^ Liang J, Wang S, Wang Z (novembar 2017). "Role of microRNAs in embryo implantation". Reprod Biol Endocrinol. 15 (1): 90. doi:10.1186/s12958-017-0309-7. PMC 5699189. PMID 29162091.
- ^ a b c d e Quinn KE, Matson BC, Wetendorf M, Caron KM (februar 2020). "Pinopodes: Recent advancements, current perspectives, and future directions". Molecular and Cellular Endocrinology. 501: 110644. doi:10.1016/j.mce.2019.110644. PMC 6962535. PMID 31738970.
- ^ Xiao Y, Sun X, Yang X, Zhang J, Xue Q, Cai B, Zhou Y (juni 2010). "Leukemia inhibitory factor is dysregulated in the endometrium and uterine flushing fluid of patients with adenomyosis during implantation window". Fertility and Sterility. 94 (1): 85–89. doi:10.1016/j.fertnstert.2009.03.012. PMID 19361790.
- ^ Ng SW, Norwitz GA, Pavlicev M, Tilburgs T, Simón C, Norwitz ER (juni 2020). "Endometrial Decidualization: The Primary Driver of Pregnancy Health". Int J Mol Sci. 21 (11): 4092. doi:10.3390/ijms21114092. PMC 7312091. PMID 32521725.
- ^ Crha I, Ventruba P, Žáková J, Ješeta M, Pilka R, Lousová E, Papíková Z (2019). "Uterine microbiome and endometrial receptivity". Ceska Gynekologie. 84 (1): 49–54. PMID 31213058.
- ^ Moreno I, Codoñer FM, Vilella F, Valbuena D, Martinez-Blanch JF, Jimenez-Almazán J, et al. (decembar 2016). "Evidence that the endometrial microbiota has an effect on implantation success or failure". American Journal of Obstetrics and Gynecology. 215 (6): 684–703. doi:10.1016/j.ajog.2016.09.075. PMID 27717732.
- ^ a b c Zhao Y, He D, Zeng H, Luo J, Yang S, Chen J, Abdullah RK, Liu N (septembar 2021). "Expression and significance of miR-30d-5p and SOCS1 in patients with recurrent implantation failure during implantation window". Reprod Biol Endocrinol. 19 (1): 138. doi:10.1186/s12958-021-00820-2. PMC 8425163 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 34496883 Provjerite vrijednost parametra|pmid=(pomoć). - ^ Ruan YC, Guo JH, Liu X, Zhang R, Tsang LL, Dong JD, et al. (juli 2012). "Activation of the epithelial Na+ channel triggers prostaglandin E₂ release and production required for embryo implantation". Nature Medicine. 18 (7): 1112–1117. doi:10.1038/nm.2771. PMID 22729284. S2CID 5116022.
- ^ a b Wang Y, Jiang X, Jia L, Wu X, Wu H, Wang Y, et al. (2022). "A Single-Cell Characterization of Human Post-implantation Embryos Cultured In Vitro Delineates Morphogenesis in Primary Syncytialization". Frontiers in Cell and Developmental Biology. 10: 835445. doi:10.3389/fcell.2022.835445. PMC 9240912 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 35784461 Provjerite vrijednost parametra|pmid=(pomoć). - ^ Melford SE, Taylor AH, Konje JC (2013). "Of mice and (wo)men: factors influencing successful implantation including endocannabinoids". Human Reproduction Update. 20 (3): 415–428. doi:10.1093/humupd/dmt060. PMID 24306146.
- ^ a b c Cakmak H, Taylor HS (2010). "Implantation failure: molecular mechanisms and clinical treatment". Human Reproduction Update. 17 (2): 242–253. doi:10.1093/humupd/dmq037. PMC 3039220. PMID 20729534.
- ^ Ahn J, Yoon MJ, Hong SH, Cha H, Lee D, Koo HS, et al. (septembar 2021). "Three-dimensional microengineered vascularised endometrium-on-a-chip". Human Reproduction. 36 (10): 2720–2731. doi:10.1093/humrep/deab186. PMC 8450871 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 34363466 Provjerite vrijednost parametra|pmid=(pomoć). - ^ Rawlings TM, Makwana K, Tryfonos M, Lucas ES (juli 2021). "Organoids to model the endometrium: implantation and beyond". Reprod Fertil. 2 (3): R85–R101. doi:10.1530/RAF-21-0023. PMC 8801025 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 35118399 Provjerite vrijednost parametra|pmid=(pomoć). - ^ Potdar N, Gelbaya TA, Konje JC, Nardo LG (2013). "Adjunct low-molecular-weight heparin to improve live birth rate after recurrent implantation failure: a systematic review and meta-analysis". Human Reproduction Update. 19 (6): 674–684. doi:10.1093/humupd/dmt032. PMID 23912476.
- ^ Farquhar C, Marjoribanks J (august 2018). "Assisted reproductive technology: an overview of Cochrane Reviews". The Cochrane Database of Systematic Reviews. 2018 (8): CD010537. doi:10.1002/14651858.CD010537.pub5. PMC 6953328. PMID 30117155.
- ^ Garner TB, Hester JM, Carothers A, Diaz FJ (maj 2021). "Role of zinc in female reproduction". Biology of Reproduction. 104 (5): 976–994. doi:10.1093/biolre/ioab023. PMC 8599883 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 33598687. - ^ "Implantation Bleeding vs A Period: How To Tell The Difference". ReUnite Rx (jezik: engleski). 9. 12. 2020. Pristupljeno 29. 7. 2021.
- ^ a b Sadler, T. W. (2010). Langman's medical embryology (11th izd.). Philadelphia: Lippincott William & Wilkins. str. 50–51. ISBN 9780781790697.
- ^ Sheiner E (2011). Bleeding during pregnancy a comprehensive guide. New York: Springer. str. 9. ISBN 978-1-441-99810-1.
- ^ Harville EW, Wilcox AJ, Baird DD, Weinberg CR (septembar 2003). "Vaginal bleeding in very early pregnancy". Human Reproduction. 18 (9): 1944–1947. doi:10.1093/humrep/deg379. PMID 12923154.
- ^ Heger, L. Demosthenes E (ured.). "What do implantation cramps feel like? How to tell the difference between implantation and menstrual cramping". Insider (jezik: engleski). Pristupljeno 29. 7. 2021.
- ^ Aggarwal K (2020). "Vaginal Bleeding in Early Pregnancy". u Sharma A (ured.). Labour Room Emergencies (jezik: engleski). Singapore: Springer. str. 155–161. doi:10.1007/978-981-10-4953-8_18. ISBN 978-981-10-4953-8. S2CID 212812977.
- ^ "How Do I Know if It's Implantation Bleeding?". MedicineNet (jezik: engleski). Pristupljeno 29. 7. 2021.
Knjige
[uredi | uredi izvor]- Boron W, Boulpaep E (2004). Medical Physiology: A Cellular And Molecular Approaoch. Oxford: Elsevier. ISBN 1-4160-2328-3. OCLC 61527528.
Dopunska literatura
[uredi | uredi izvor]Vanjski linkovi
[uredi | uredi izvor]