Cristal·lografia de raigs X

La difracció o cristal·lografia de raigs X és una tècnica per a determinar la disposició dels àtoms dins un cristall, en aquest mètode un feix de raigs X colpeja el cristall i causa que el feix de llum s'estengui en moltes direccions específiques. Dels angles i la intensitat d'aquest feixos difractats, un cristal·lògraf pot produir una imatge tridimensional de la densitat dels electrons dins el cristall. D'aquesta densitat d'electrons, es pot determinar les posicions mitjanes dels àtoms en el cristall, aplicant la llei de Bragg, i també els seus enllaços químics, el seu desordre i altres informacions.
És una de les tècniques que gaudeix de major prestigi entre la comunitat científica per a dilucidar estructures cristal·lines, a causa de la seva precisió i a l'experiència acumulada durant dècades, elements que la fan molt fiable. Les seves majors limitacions es deuen a la necessitat de treballar amb sistemes cristal·lins, pel que és difícilment aplicable a dissolucions, a sistemes biològics in vivo, i no és aplicable a sistemes amorfs o a gasos. És possible treballar amb monocristalls o amb pols microcristal·lina, aconseguint-se diferents dades en ambdós casos.
Per a la resolució dels paràmetres de la cel·la unitat pot ser suficient la difracció de raigs X en pols, mentre que per a una dilucidació precisa de les posicions atòmiques és convenient la difracció de raigs X en monocristall. La cristal·lografia de raigs X va ocupar un paper essencial en la descripció de la doble hèlix de la molècula d'ADN. Aquesta tècnica s'utilitza àmpliament en la determinació de les estructures de les proteïnes.
Com que molts materials poden formar cristalls—com les sals, metalls, minerals, semiconductors, com també diversos materials inorgànics, orgànics i molècules biològiques—la cristal·lografia de raigs X ha estat fonamental en els desenvolupament de molts camps científics. En les seves primeres èpoques d'usar-se aquest mètode ha determinat la mida dels àtoms, la llargada i tipus dels enllaços químics, i les diferències a escala atòmica aentre diversos materials, especialment minerals i aliatges. Aquest mètode també ha revelat l'estructura i funció de moltes molècules biològiques, incloent les vitamines, drogues, proteïnes i àcids nucleics com l'ADN. També serveix per conèixer l'estructura atòmica dels nous materials. També es fa servir en electrònica i enginyeria (deformació dels materials).
En el mesurament per difracció dels raigs X, es munta un cristall en un goniòmetre i gradualment se'l fa rotar mentre és bombardejat amb raigs X, que produeix un patró de difracció de zones regularment espaiades conegudes com a reflexions. Les dues imatges bidimensionals preses a rotacions diferents es converteixen en un model tridimensional de la densitat d'electrons dins el cristall fent servir el model matemàtic de les transformacions de Fourier, combinat amb les dades químiques conegudes de la mostra. Hi pot haver una resolució pobra (fuzziness) o fins i tot errors si el cristall és massa petit, o no uniforme internament.
Si el material que s'investiga només és disponible en forma de pols de nanocristalls o té una cristal·linitat pobra, es poden fer servir els mètodes de la cristal·lografia d'electrons per determinar-ne l'estructura atòmica.
Història
[modifica]
Fins al segle xvii no es van començar a investigar científicament l'estructura dels cristalls. Johannes Kepler va plantejar la hipòtesi en la seva obra Strena seu de Nive Sexangula (1611) que la simetria hexagonal dels cristalls dels flocs de neu era deguda a un empaquetametn regular de les esfèriques partícules d'aigua.[1]

Els raigs X varen ser descoberts per Wilhelm Conrad Röntgen l'any 1895, just quan havien acabat els estudis de la simetria dels cristalls.
Difracció de raigs X
[modifica]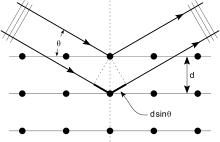
Els àtoms dels cristalls dispersen ones de raigs X, principalment a través dels electrons dels àtoms. Els raigs X que colpegen un electró produeixen ones esfèriques circulars secundàries que emanen dels electrons. Aquest fenomen es coneix com a dispersió elàstica, i l'electró es coneix com a dispersor (scatterer).
Cristal·lografia de macromolècules
[modifica]Les estructures dels cristalls de les proteïnes es van començar a resoldre a la dècada de 1950 començant amb la mioglobina de l'esperma de la balena per part de Max Perutz i de Sir John Cowdery Kendrew,.[2] Després s'han determinat milers d'estructures dels cristalls de molècules biològiques.[3] Tanmateix la membrana intrínseca de les proteïnes segueix sent un repte per cristal·litzar-la perquè requereixen detergents per solubilitzar-les i això interfereixen amb la cristal·lització.[4][5]
Vegeu també
[modifica]- Protein Data Bank (PDB)
Referències
[modifica]- ↑ Kepler J. Strena seu de Nive Sexangula. Frankfurt: G. Tampach, 1611. ISBN 3321000210.
- ↑ Kendrew J. C.; Bodo, G.; Dintzis, H. M.; Parrish, R. G.; Wyckoff, H.; Phillips, D. C.; 1 «A Three-Dimensional Model of the Myoglobin Molecule Obtained by X-Ray Analysis». Nature, 181, 4610, 08-03-1958, pàg. 662–6. Bibcode: 1958Natur.181..662K. DOI: 10.1038/181662a0. PMID: 13517261.
- ↑ «Table of entries in the PDB, arranged by experimental method». Arxivat de l'original el 2007-07-04. [Consulta: 26 abril 2012].
- ↑ Lundstrom K «Structural genomics for membrane proteins». Cell. Mol. Life Sci., 63, 22, 2006, pàg. 2597–607. DOI: 10.1007/s00018-006-6252-y. PMID: 17013556.
- ↑ Lundstrom K «Structural genomics on membrane proteins: mini review». Comb. Chem. High Throughput Screen., 7, 5, 2004, pàg. 431–9. PMID: 15320710.
Bibliografia
[modifica]- Theo Hahn. International Tables for Crystallography. Volume A, Space-group Symmetry. 5a edició. Dordrecht: Kluwer Academic Publishers, for the International Union of Crystallography, 2002. ISBN 0792365909.
- Michael G. Rossmann and Eddy Arnold. International Tables for Crystallography. Volume F, Crystallography of biological molecules. Dordrecht: Kluwer Academic Publishers, for the International Union of Crystallography, 2001. ISBN 0792368576.
- Theo Hahn. International Tables for Crystallography. Brief Teaching Edition of Volume A, Space-group Symmetry. 4a ed.. Dordrecht: Kluwer Academic Publishers, for the International Union of Crystallography, 1996. ISBN 0792342526.

