Talidomida
La talidomida és un fàrmac teratogènic (que provoca malformacions congènites), que va ser receptat entre els anys 1956 i 1963 com a sedant i com a calmant de les nàusees durant els tres primers mesos de l'embaràs. Com a sedant va tenir un gran èxit popular, ja que no causava gairebé cap efecte secundari i en cas d'ingestió massiva no era letal. Aquest medicament va provocar milers de naixements de nadons afectats de dysmelia (del grec dys, "falta", i melos, "membre"); és a dir, naixien sense braços o sense cames o, en els casos més extrems, sense els quatre membres.
La talidomida afectava els fetus de dues maneres: o bé quan la mare prenia el medicament directament com a sedant o calmant de nàusees o bé quan era el pare qui en prenia, ja que la talidomida afecta l'esperma i transmet els efectes nocius ja en el moment de la concepció. Quan es van comprovar els efectes teratogènics del medicament, aquest va ser retirat amb més o menys celeritat en els països on havia estat receptat sota diferents noms. Espanya va ser dels últims estats a retirar-lo l'any 1963.
La fórmula química de la talidomida és la següent: C13H10N₂O₄ (pes molecular: 258,23) La seva estructura química es mostra a la figura de la dreta.
La talidomida va ser receptada sota aquests noms (entre altres): Imidan, Varian, Contergan, Gluto Naftil, Softenon, Noctosediv, Entero-sediv, Entero-Sediv-Suspenso. A partir del moment en el qual va ser retirada, hi hagué un creixent interès clínic per la talidomida, i va ser introduïda com a agent immunomodulador emprat principalment en combinació amb dexametasona per tractar el mieloma múltiple. El fàrmac és un teratogen potent en els peixos zebra, pollastres,[1] conills i primats, fins i tot en els humans: es poden produir greus defectes de naixement si la talidomida es pren durant l'embaràs.[2]
La talidomida es va vendre en diversos països arreu del món des de l'any 1957 fins al 1961, any en què va ser retirada del mercat després d'haver estat considerada causant de defectes de naixement en allò que va ser anomenat “una de les majors tragèdies mèdiques dels temps moderns”.[3] No se sap exactament el nombre de víctimes del fàrmac que hi ha hagut arreu del món, encara que les estimacions van des d'unes 10.000 persones fins a unes 20.000.[4] Tot i això, la talidomida ha demostrat que és un tractament viable per diverses condicions mèdiques. Torna a ser receptada en un nombre determinat de països, encara que l'ús continua sent controvertit, incloent-hi la seva prova en les regions en vies de desenvolupament.[5][6] La tragèdia de la talidomida va donar lloc a un requeriment molt estricte a l'hora de provar els fàrmacs i plaguicides abans que poguessin ser objecte d'autorització.[7]
L'impacte social de la talidomida
[modifica]El fàrmac va provocar el que s'anomena la "Catàstrofe de la Talidomida", ja que milers de nadons van néixer arreu del món amb severes malformacions irreversibles. Molts d'aquests nadons en créixer van tenir (i tenen) dificultats per integrar-se a la societat a causa de la seva minusvalidesa.
A més, l'alarma social que va provocar els severs efectes secundaris va fer que els responsables de Sanitat de molts països comencessin a fer un control estricte dels medicaments abans d'aprovar-ne la comercialització. Per exemple, a Alemanya, un dels països més afectats per la talidomida (sota el nom de Contergan), abans de la catàstrofe no existia cap llei ni comissió de control de medicaments. En efecte, després de la catàstrofe, molts països progressivament van començar a promulgar lleis de control dels medicaments i també l'exigència que aquests siguin sotmesos a assaigs farmacològics i provats en animals, a més d'assajos clínics en persones abans de comercialitzar-los.
Història
[modifica]Desenvolupament
[modifica]La talidomida va ser desenvolupada per la companyia farmacèutica alemanya Grünenthal a Stolberg (Renània) prop d'Aquisgrà, tot i que hi ha qui qüestiona aquesta afirmació.[es necessita una citació] Un article publicat per Martin W. Johnson, director de la Thalidomide Trust al Regne Unit, va esmentar proves trobades per l'autor argentí Carlos De Napoli que suggerien que el medicament havia estat creat, en un principi, com un possible antídot a les toxines nervioses, com ara el sarin, creat per Otto Ambros, un científic nazi que es va incorporar a Grünenthal després de la guerra. La correspondència entre diverses companyies farmacèutiques –la firma francesa Rhône-Poulenc, la qual va estar sota el control nazi al llarg de la guerra; Astra AB, que tenia l'autorització sueca per a la distribució de talidomida; i IG Farben, la firma farmacèutica alemanya– sembla que confirma l'existència del producte anys abans que Grünenthal n'obtingués la patent el 1954. A més, s'ha mencionat que podria haver-hi alguna relació entre la realització de les proves de la talidomida i els camps d'extermini nazis. Grünenthal ha respost a aquestes acusacions afirmant: “fins on coneixem, no hi havia col·laboració entre Grünenthal i Rhône-Pulenc per al desenvolupament de Contergan/talidomida. Tres empleats de Grünenthal van descobrir la talidomida i Grünenthal és l'inventor de la patent”. Segons explica Grünenthal, el Dr. Heinrich Mückter va ser un dels responsables de la invenció de la talidomida. Altres fonts classifiquen el Dr. Mückter com un incipient farmacèutic que va dur a terme experiments en els temps de guerra sobre presoners polonesos amb l'objectiu de trobar una cura per al tifus, i va causar la mort de molts d'ells en el procés experimental.[8]
De Napoli va suggerir, en una altra ocasió, que la talidomida podria haver estat sintetitzada per primera vegada per científics britànics a la Universitat de Nottingham l'any 1949.[9]
La talidomida, llançada per Grünenthal l'1 d'octubre de 1957,[10] va esdevenir un tranquil·litzant i analgèsic eficaç, i va ser proclamada una “droga miraculosa” per combatre l'insomni, la tos, els refredats i el mal de cap. També es va veure que era un efectiu antiemètic amb un efecte inhibidor de les nàusees matinals, per la qual cosa milers de dones embarassades la van prendre per tal d'alleujar-ne els símptomes.[4] Quan la talidomida s'estava desenvolupant, els científics no creien que cap medicament subministrat a una dona embarassada pogués passar a través de la barrera placental i danyar el fetus en creixement.[7] L'Administració d'Aliments i Fàrmacs (FDA) dels Estats Units no va autoritzar mai la talidomida per a l'ús general; segons el Time Magazine, “En la mitja dotzena dels casos informats als EUA de malformacions en el naixement a conseqüència de la talidomida, el medicament s'havia obtingut a l'estranger”.[11] No obstant això, s'havien distribuït mostres a un nombre de metges com a part d'un assaig clínic, en el qual 20.000 pacients als EUA van rebre talidomida.[12]
Malformacions de naixement
[modifica]A finals dels anys 50 i principis dels 60, més de 10.000 nens i nenes de 46 països van néixer amb malformacions com ara la focomèlia, conseqüència de l'ús de talidomida.[13] L'obstetre australià William McBride i el pediatre alemany Widukind Lenz van sospitar una possible relació entre els defectes de naixement i la droga, teoria que Lenz provà el 1961.[14][15] Més tard, McBride va rebre una sèrie d'honors, entre els quals una medalla i un premi en metàl·lic pel prestigiós L'Institut de la Vie a París.[16]
Al Regne Unit el medicament va ser autoritzat el 1958. Dels aproximadament 2.000 nadons que van néixer amb defectes, 466 van sobreviure.[17] La droga fou retirada el 1961. El 1968, després d'una llarga campanya del diari The Sunday Times, es va arribar a un acord de compensació per a les víctimes del Regne Unit amb la Distillers Company (ara part de Diageo).[18][19] Aquesta recompensa, la qual és distribuïda per la Thalidomide Trust al Regne Unit, es va augmentar substancialment per Diageo el 2005.[20] El Govern del Regne Unit va donar als supervivents una concessió de 20 milions de lliures esterlines per ser distribuïdes a través de la Thalidomide Trust, el desembre de 2009.[21] A Alemanya van néixer aproximadament 2.500 bebès talidomida.[15]

Als Estats Units, la farmacòloga i doctora en medicina Frances Oldham Kelsey va refusar l'aprovació per part de la Food and Drug Administration (FDA) de la sol·licitud de Richardson Merrel Company de treure la talidomida al mercat, adduint que calien més estudis, la qual cosa va reduir l'impacte de la talidomida en pacients dels Estats Units. Encara que la venda de talidomida mai no va ser aprovada als EUA, s'havien distribuït grans quantitats de talidomida als metges durant un programa de proves clíniques. En aquell moment ja era impossible saber quantes dones embarassades havien pres talidomida per a combatre les nàusees o com a sedant.[22] El Canadà va ser el darrer país en aturar les vendes de la droga, a principis de l'any 1962.[23] El 1962, es van aprovar una sèrie de lleis al Congrés dels Estats Units que exigien que, per tal que un medicament fos aprovat i posat a la venda, aquest hauria d'haver passat una sèrie de proves de seguretat en dones embarassades.[24] Altres països van aprovar lleis similars i la talidomida no va ser receptada ni venuda durant dècades. Kelsey va rebre, el 1962, el Premi del President per al Distingit Servei Civil Federal, gràcies al fet que va denegar correctament la sol·licitud, malgrat la pressió rebuda per part de Richardson-Merrell. Aquest premi li va ser atorgat en una cerimònia amb el president John F. Kennedy.[25] El setembre de 2010, com es pot veure en un article titulat The Public's Quiet Savior From Harmful Medicine, la FDA va reconèixer el doctor Kelsey amb el primer ‘premi Kelsey'. El premi, concedit anualment a un membre del personal de la FDA, va arribar 50 anys després que el Dr. Kelsey –que aleshores era un nou metge a l'agència¬– examinés per primer cop l'aplicació de la companyia de William S. Merrell de Cincinnati.[26]
Mecanisme teratogènic
[modifica]Els investigadors aviat van descobrir que només un dels isòmers òptics de la talidomida era el causant del comportament teratogènic. El parell d'enantiòmers, que són imatges especulars l'un de l'altre, tenen efectes diferents,[27] encara que se sap que l'isòmer que en principi es considera ‘segur' pot convertir-se en un isòmer teratogènic un cop introduït en el cos humà.[15][28]
Interès ressorgit
[modifica]El 1964, Jacob Sheskin, professor de la Universitat Hebrea de Jerusalem a l'Hospital Universitari de Hadassah i el cap de personal i gerent del Hansen Leper Hospital de Jerusalem, van administrar talidomida a un pacient en estat crític amb un eritema nuós leprós (ENL) –una complicació dolorosa de la lepra–per tal de calmar el seu mal, encara que sabien que administrar-li talidomida estava prohibit. El pacient va dormir durant hores i va ser capaç de llevar-se del llit sense ajuda just després d'haver-se despertat. El resultat de l'administració de talidomida va anar seguit de més resultats favorables i d'un assaig clínic.[29] Sheskin va concloure que els pacients que presentaven un ENL experimentaven un alleujament del dolor després de prendre talidomida.
A més, el treball realitzat el 1991 pel doctor Gilla Kaplan de la Universitat de Rockefeller de Nova York va mostrar que la talidomida funciona aplicada a casos de lepra inhibint el factor alfa de la necrosi tumoral. Kaplan també creia que la talidomida podria ser un tractament eficaç contra la SIDA. El doctor es va associar amb Celgene per desenvolupar el potencial de la talidomida en la SIDA i la tuberculosi. Tot i així, els resultats dels assajos clínics per a la SIDA van ser del tot decebedors.
El 1994, el doctor Robert D'Amato, de la Harvard Medical School, va descobrir que la talidomida era un potent inhibidor del creixement de nous vasos sanguinis (afecta l'angiogènesi). Arran d'aquesta descoberta, es van fer nombrosos assajos clínics sobre el possible efecte de la talidomida contra el càncer. El 1997, el doctor Bart Barlogie va informar de l'eficàcia inicial de la talidomida contra el mieloma múltiple. Aquest fet va causar que, més tard, la talidomida fos aprovada als Estats Units per al seu ús en aquest tipus de càncer. La FDA també ha aprovat l'ús del medicament en el tractament de l'END. Actualment, hi ha estudis en curs per a determinar els efectes de la droga en l'aracnoïditis i alguns tipus de càncer. Això no obstant, els metges i els pacients han de passar per un procés especial, conegut com a STEPS, per a prescriure i rebre, respectivament, un tractament de talidomida i així evitar que neixin més nens amb malformacions congènites que siguin atribuïbles al medicament. Celgene ha desenvolupat anàlegs de la talidomida, com la lenalidomida, que són molt més potents i tenen menys efectes secundaris –exceptuant una major mielosupressió.[30] La lenalidomida és més comuna que la talidomida per a tractar el mieloma. Més recentment, l'Organització Mundial de la Salut (OMS) ha declarat que:
‘L'OMS no recomana l'ús de la talidomida en la lepra, ja que l'experiència ha demostrat que és pràcticament impossible desenvolupar i implementar un mecanisme de vigilància per a combatre l'abús de la droga. El medicament clofazímia és, ara, un component de la Teràpia Multidroga (MTD), introduït per l'OMS el 1981 com a tractament estàndard per a la lepra i que se subministra de franc a tots els pacients del món.'[31]
Estats Units
[modifica]El 16 de juliol de 1998, la FDA va aprovar l'ús de la talidomida per al tractament de lesions associades a l'ENL. A causa del potencial de la talidomida per a causar defectes de naixement, la droga pot ser distribuïda únicament sota condicions estrictament controlades. La FDA va exigir que Celgene Corporatin, que comercialitzava la talidomida al mercat sota la marca Thalidomid, establís un Sistema per a l'Educació i Prescripció Segura de la Talidomida (STEPS) per supervisar el programa. Les condicions requerides pel programa inclouen la limitació de la prescripció i dispensació dels drets només als prescriptors autoritzats i farmàcies, mantenint un registre de tots els pacients amb prescripció de talidomida; l'educació completa dels pacients sobre els riscs associats amb la droga; i oferir les proves periòdiques d'embaràs per a les dones que prenen la droga.[32]
El 26 de maig de 2006, la Food and Drug Administration (FDA) va obtenir l'aprovació per a l'ús de la talidomida en combinació amb dexametasona per al tractament de pacients amb nous diagnòstics de mieloma múltiple (MM).[33] Aquesta aprovació va ser rebuda set anys després que es publiquessin els primers informes mèdics[34] sobre l'eficàcia del tractament, i Celgene es va aprofitar de les oportunitats de mercadejar amb el fàrmac abans que la FDA tingués l'aprovació per al tractament del mieloma. La talidomida, com a droga, es coneix comercialment com a Thalomid i se'n venen més de 300 milions de dòlars l'any, encara que únicament estigui aprovada per al tractament de la lepra.[35]
Regne Unit
[modifica]La talidomida està disponible només per a un petit nombre de pacients al Regne Unit, generalment en centres de tractament especial de càncer on tenen lloc els assajos de recerca i on treballen metges especialitzats i amb experiència en el seu ús.[36]
Brasil
[modifica]Brasil té la segona taxa més gran de prevalença de lepra al món [necessita cita], i la talidomida ha estat utilitzada pels metges brasilers com la droga escollida per al tractament de l'ENL greu des de 1965. Un estudi publicat el 1996 va informar sobre 33 persones nascudes al Brasil després de 1965 amb l'embriopatia de la talidomida.[37] Des de 1994, la producció, distribució i prescripció de la talidomida ha estat estrictament controlada, però els casos d'embriopaties de talidomida continuen.[38][39]
Espanya
[modifica]A l'estat espanyol un laboratori va vendre productes afectats entre 1957 i 1962. Es calcula que hi ha unes 3.000 persones afectades. El 2013 un jutge de Madrid va reconèixer la seva lluita, però el setembre de 2015 el Tribunal Suprem va descartar indemnitzar-les per prescripció.[40]
Possibles indicacions
[modifica]Serioses infeccions, incloent-hi la sèpsia i la tuberculosi, provoquen que el nivell del Factor de Necrosi Tumoral alfa (TNFα) augmenti. El TNFα és un mediador químic del cos, i pot augmentar el procés de desgast dels pacients de càncer. La talidomida pot reduir els nivells de TNFα, i és possible que l'efecte del fàrmac sobre l'ENL sigui causat per aquest mecanisme.[24] La talidomida, a més, té potents efectes antiinflamatoris que podrien ajudar els pacients d'ENL. El juliol de 1998, la FDA va aprovar l'aplicació de Celgene per distribuir talidomida amb el nom “Talidomida per al tractament d'ENL”. Pharmion Corporation, que va adquirir els drets per distribuir la talidomida a Europa, Austràlia i altres territoris de Celgene, va rebre l'aprovació per al seu ús contra el mieloma múltiple a Austràlia i Nova Zelanda el 2003.[41] La talidomida, juntament amb la dexametasona, és ara la teràpia estàndard contra el mieloma múltiple. La talidomida també és prescrita pels seus efectes antiinflamatoris sobre el prurigen actínic, una malaltia autoimmunitària de la pell. La talidomida s'ha utilitzat en la dermatosi crònica, amb butllofes, en la infància (CBDR) amb resultats encoratjadors.[42] La neuritis perifèrica pot ser, però, un factor limitant per a l'ús a llarg termini de la talidomida. La talidomida també inhibeix el creixement de nous vasos sanguinis (angiogènesi), fet que indica que aquesta pot ser útil per al tractament de la degeneració muscular i altres malalties. Aquest efecte ajuda a pacients de SIDA amb sarcoma de Kaposi, encara que hi ha fàrmacs millors i més barats per tractar-lo. La talidomida pot ser capaç de lluitar contra doloroses i debilitants lesions aftoses de la boca i l'esòfag de pacients amb SIDA, les quals els impedeixen menjar. La FDA va formar un Grup de Treball de la Talidomida el 1994 per aportar coherència entre les seves divisions, amb particular èmfasi en el control de la seguretat. L'agència també va imposar severes restriccions en la distribució de la talidomida a través del programa del Sistema per a l'Educació i Prescripció Segura de la Talidomida (STEPS).[24] La talidomida també està sent investigada per al tractament dels símptomes del càncer de pròstata, del glioblastoma, el limfoma, l'aracnoïditis, la malaltia de Behçet i la de Crohn. En un petit assaig, els investigadors australians van trobar que la talidomida causava un doblatge del nombre de cèl·lules T en els pacients, la qual cosa permet al seu propi sistema immunitari atacar les cèl·lules canceroses.[43]
Estudis duts a terme amb models animals han suggerit que l'ús d'una teràpia combinada de talidomida i Glucantime podria tenir un benefici terapèutic en el tractament de la Leshmaniasi visceral.[44]
Un estudi publicat l'abril de 2010 analitza la capacitat de la talidomida per induir la maduració dels vasos, que pot ser útil com a estratègia terapèutica per al tractament de malformacions vasculars. La investigació concloïa amb un model experimental de la malaltia genètica de la telangièctasi hemorràgica hereditària.[45]
Talidomida i mieloma múltiple
[modifica]La talidomida fou provada per primera vegada en humans com a agent únic per al tractament del mieloma múltiple, el 1996, a causa de la seva activitat antiangiogènica. The New England Journal of Medicine en va publicar un estudi complet el 1999.[46] Des d'aleshores, molts estudis han mostrat que la talidomida, en combinació amb dexametasona, ha incrementat la supervivència de pacients amb mieloma múltiple. La combinació de talidomida i dexametasona, i alguns cops també amb melfalan, és ara un dels més comuns règims per a pacients amb nou diagnòstic de mieloma múltiple, amb una millor taxa de resposta de 60-70%.[47][48] La talidomida també pot causar efectes secundaris com polineuropatia, fatiga, erupcions a la pell i tromboembolisme venós (VTE), o coàguls de sang, els quals podrien donar lloc a un vessament o un infart de miocardi.[49] Bennet et al. han fet una investigació sistemàtica sobre VTE associada amb la talidomida en pacients amb mieloma múltiple.[50] Van trobar que quan la talidomida era administrada sense profilaxi, les taxes de VTE assolien un nivell del 26%. A causa d'aquestes altes taxes de VTE, associades amb la talidomida en combinació amb dexametasona o doxorubicin, el 2006 es va afegir una advertència de requadre negre al prospecte de la talidomida als EUA, tot indicant que els pacients amb mieloma múltiple que reben talidomida-dexametasona es poden beneficiar simultàniament de la profilaxi de tromboembolisme o aspirina. A més, a causa d'aquests efectes secundaris, nous fàrmacs, tals com la bortezomib (comercialitzada com Velcade) i un derivat de la talidomida, la lenalidomida (comercialitzada com Revlimid), han augmentat la seva popularitat. [necessita cita]
El mecanisme teratogènic
[modifica]La talidomida és racèmica, ja que els seus dos isòmers es troben en les mateixes proporcions. Entre les dues formes hi ha diferències notòries. Mentre l'enantiòmer R resulta eficaç com a sedant contra les nàusees matinals característiques de l'embaràs, la forma S és teratogènica.
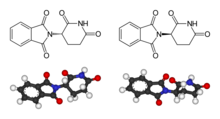
(S)-talidomida
Dreta: (R)-talidomida


Aquests dos enantiòmers poden intercanviar les seves formes in vivo,[51] poden passar de ser R a S, i viceversa. Així doncs, si se li subministra a una persona R-talidomida o S-talidomida, al cap de cert temps, podem trobar tots dos isòmers al mateix sèrum. És per això que encara que només s'administri un tipus d'isòmer, no es pot prevenir l'efecte teratogènic. El mecanisme teratogènic de la talidomida ha donat lloc a més de 2.000 investigacions i a unes quinze o setze hipòtesis de possibles mecanismes d'acció.[52] Una teoria de l'any 2000[52] suggeria que la talidomida s'intercala (s'insereix ella mateixa) al DNA, concretament en regions on predomina la presència de guanina (G) i citosina (C).[53][54] Degut a la seva part glutarimida, la S-talidomida encaixa perfectament al solc del DNA al lloc de les purines.[52] Cada intercalació afecta sobre les regions promotores dels gens que controlen el desenvolupament de les extremitats, les orelles o els ulls com els IGF-I i FGF-2.
Aquests gens, en estat normal, activen la producció de la integrina αvβ3, que es fixa a la superfície cel·lular amb el consegüent dímer d'integrina αvβ3, que estimula l'angiogènesi a les extremitats en formació. Això posteriorment promou el creixement de l'extremitat (IGF-I i FGF-2 són coneguts com a estimuladors de l'angiogènesi). Per tant, amb la inhibició d'aquest seguit de passos, la talidomida impedeix el desenvolupament de les extremitats. L'any 2009 aquesta teoria[52] va rebre un gran suport. Els experiments demostren “de manera concloent que la pèrdua dels vasos sanguinis de nova formació és la causa principal de la teratogènesi que provoca la talidomida, i que les extremitats en desenvolupament són particularment susceptibles perquè, precisament, es troben en ple procés d'angiogènesi (formació dels vasos sanguinis).[55]
Inactivació de la proteïna cereblon
[modifica]La talidomida s'uneix i inactiva una proteïna anomenada cereblon, que és important per a la formació de les extremitats.[56] La inhibició de l'activitat enzimàtica del cereblon provoca els efectes teratogènics al desenvolupament fetal. Aquest fet va ser confirmat quan els científics, utilitzant tècniques genètiques, van reduir la producció de cereblon en embrions en formació de pollastre i de peixos zebra. Es va observar que aquests embrions tenien malformacions semblants a aquells que havien estat tractats amb talidomida. Mentre el mecanisme que causa la teratogènesi ha estat establert, el mecanisme d'altres efectes terapèutics continua sense conèixer-se.[57]
El mecanisme en el mieloma múltiple
[modifica]La talidomida apareix per inhibir la progressió de la malaltia en el mieloma múltiple per diversos mecanismes, com s'ha observat en experiments en cèl·lules amb mieloma:
- Inhibició de la producció d'interleucina-6 (IL-6), que és un factor de creixement per a la proliferació de les cèl·lules amb mieloma.[58]
- Activació de les vies d'apoptosi de la cèl·lula mitjançant caspasa-8.[58]
- A nivell mitocondrial, la talidomida indueix la cinasa terminal c-jun (JNK) – alliberament dependent del citocrom c i Smac al citosol de les cèl·lules, afectant l'apoptosi.[58]
- Activació de les cèl·lules o limfòcits T perquè produeixin IL-2, i així alteren la quantitat i les funcions de les cèl·lules assassines naturals (o cèl·lula NK, de l'anglès natural killer), fet que augmenta l'activitat de les cèl·lules citotòxiques.[58]
Anàlegs de la talidomida
[modifica]L'observació de les activitats antiangiogènica i immunomodulatòria de la talidomida ha donat lloc a l'estudi i la creació d'anàlegs d'aquesta. L'any 2005, Celgene va rebre l'aprovació de la FDA per la lenalidomida (Revlimid) com el primer derivat comercial útil. Revlimid és l'únic autoritzat per a ser subministrat sota control durant l'embaràs. Actualment, s'estan fent estudis paral·lels per trobar components més segurs amb unes característiques i qualitats aprofitables. Un altre anàleg a la talidomida és la pomalidomida, que encara es troba en la fase clínica del procediment de recerca del medicament.[59] Aquests anàlegs a la talidomida poden utilitzar-se per tractar diferents malalties.[60]
Persones relacionades amb la malaltia
[modifica]- Rock Brynner, fill de Yul Brynner, autor de Dark Remedy,[61] que d'adult va prendre talidomida per una alteració immunològica.
- Mat Fraser, músic, actor i artista nascut amb focomèlia a tots dos braços.
- Alvin Law, retransmissor de ràdio, nascut sense braços.
- Louise Medus Mansell, filla de David Mason, que va fer campanyes per incrementar les compensacions per nens afectats per la talidomida, nascuts sense braços o cames.[62]
- Tony Meléndez, cantant i guitarrista premiat que tocava amb els seus peus, conegut internacionalment pel reconeixement rebut del Papa Joan Pau II i el president Ronald Reagan.
- Thomas Quasthoff, baix-baríton conegut internacionalment que s'autodescrivia com un home de “1.34 metres d'alçada, braços curts, set dits (quatre a la dreta i tres a l'esquerra), un cap relativament ben format, ulls marrons, llavis distingits i de professió: cantant.”[63]
- Niko von Glasow, que va produir un documental el 2008 anomenat Nobody's perfect, basat en les vides de dotze persones afectades pel medicament.[64][65]
- Terry Wiles, nascut amb focomèlia a tots dos braços i a ambdues cames, que ha estat reconegut internacionalment pel programa de televisió On Giant's Shoulders i el llibre amb el mateix nom.
- Un llibre de ficció, Thalidomide Kid, de l'autora Kate Rigby. Descriu una història sobre un noi nascut sense braços que afronta el dolor i els prejudicis durant la dècada dels 70.[66]
La talidomida avui dia
[modifica]En l'actualitat, la talidomida es torna a receptar, amb permís de l'OMS, en alguns països, perquè s'ha comprovat la seva eficàcia contra malalties com la lepra i certs tipus de càncer. També es pot trobar a la venda a Internet, però aquest tipus de venda és totalment fraudulenta. El que no es pot evitar, encara, són els nocius efectes secundaris en els fetus que té aquest medicament i que continua provocant naixements de nens amb greus malformacions. Es coneixen casos de naixements de nens amb dismèlia a Etiòpia i al Brasil, fills de pares tractats amb talidomida.
Referències
[modifica]- ↑ Ito, T; Ando, H; Suzuki, T [et al]. «Identification of a primary target of thalidomide teratogenicity». Science, 327, 5971, març 2010, pàg. 1345–50. DOI: 10.1126/science.1177319. PMID: 20223979.
- ↑ «Thalidomide: Drug safety during pregnancy and breastfeeding / DRUGSAFETYSITE.COM». Arxivat de l'original el 2013-12-05. [Consulta: 15 novembre 2011].
- ↑ Anon. «Thalidomide — A Second Chance? — programme summary». BBC. [Consulta: 1r maig 2009].
- ↑ 4,0 4,1 Anon. «Born Freak». Happy Birthday Thalidomide. Channel 4. [Consulta: 1r maig 2009].
- ↑ Washington, Harriet A.. «Prudence and the Pill: Testing Thalidomide in the Global South», 14-01-2011. Arxivat de l'original el 5 de novembre 2011. [Consulta: 15 novembre 2011].
- ↑ Bowditch, Gillian «Can thalidomide ever be trusted?». The Sunday Times. News International Limited [Londres], 26-03-2006 [Consulta: 1r maig 2009].[Enllaç no actiu]
- ↑ 7,0 7,1 Heaton, C. A.. The Chemical Industry. Springer, 1994, p. 40. ISBN 0751400181.
- ↑ Foggo, Daniel «Thalidomide 'was created by the Nazis'». The Times [Londres], 08-02-2009 [Consulta: 18 juny 2009]. Arxivat 2011-06-29 at Archive.is
- ↑ Foggo, Daniel «Thalidomide victim Gary Syner to go on hunger strike». The Sunday Times. Times Newspapers Ltd. [Londres], 13-09-2009 [Consulta: 28 setembre 2009].[Enllaç no actiu]
- ↑ Moghe, Vijay V; Ujjwala Kulkarni, Urvashi I Parmar «Thalidomide» (PDF). Bombay Hospital Journal. Bombay Hospital [Bombai], 50, 3, 2008, pàg. 446. Arxivat de l'original el 22 de juliol 2011 [Consulta: 25 octubre 2009]. Arxivat 22 de juliol 2011 a Wayback Machine.
- ↑ «Medicine: The Thalidomide Disaster». Time, 10-08-1962 [Consulta: 15 abril 2011]. Arxivat 28 de setembre 2010 a Wayback Machine. «Còpia arxivada». Arxivat de l'original el 2010-09-28. [Consulta: 15 novembre 2011].
- ↑ Mekdeci, Betty. «How a Commonly Used Drug Caused Birth Defects». Arxivat de l'original el 2013-12-18. [Consulta: 15 novembre 2011].
- ↑ Bren, Linda «Frances Oldham Kelsey: FDA Medical Reviewer Leaves Her Mark on History». FDA Consumer. US Food and Drug Administration, 28-02-2001 [Consulta: 23 desembre 2009].
- ↑ Anon. «Widukind Lenz». who name it?. Ole Daniel Enersen. [Consulta: 1r maig 2009].
- ↑ 15,0 15,1 15,2 Anon «Thalidomide:40 years on». BBC news. BBC, 07-06-2002 [Consulta: 1r maig 2009].
- ↑ Report of Thalidomide at University of New South Wales. See also main William McBride article.
- ↑ «Apology for thalidomide survivors». BBC News:Health. BBC News, 14-01-2010 [Consulta: 14 gener 2010].
- ↑ Ryan, Caroline «They just didn't know what it would do». BBC News:Health. BBC news, 01-04-2004 [Consulta: 1r maig 2009].
- ↑ Flintoff, John-Paul «Thalidomide: the battle for compensation goes on». The Sunday Times. Times Newspapers Ltd. [Londres], 23-03-2008 [Consulta: 1r maig 2009]. Arxivat 2008-05-13 a Wayback Machine.
- ↑ «Compensation offer on Thalidomide». BBC News, 07-07-2005 [Consulta: 26 juliol 2011].
- ↑ «Thalidomide survivors to get £20m». BBC News, 23-12-2009 [Consulta: 26 juliol 2011].
- ↑ Mekdeci, Betty. «How a Commonly Used Drug Caused Birth Defects». Arxivat de l'original el 2013-12-18. [Consulta: 15 novembre 2011].
- ↑ «Turning Points of History — Prescription for Disaster». History Television. Arxivat de l'original el 29 de setembre 2011. [Consulta: 24 febrer 2010].
- ↑ 24,0 24,1 24,2 Burkholz, Herbert «Giving Thalidomide a Second Chance». FDA Consumer. US Food and Drug Administration, 01-09-1997 [Consulta: 21 setembre 2006].
- ↑ «Thalidomide - medic8.com - Retrieved August 25, 2008». Arxivat de l'original el de desembre 20, 2009. [Consulta: de novembre 15, 2011].
- ↑ «The Public's Quiet Savior From Harmful Medicines». The New York Times, 13-09-2010.
- ↑ Eccles H; Ratcliff B. Chemistry 2. Cambridge University Press, 2001, p. 170. ISBN 978-0-521-79882-2.
- ↑ Ligham, Alex. «Optical Isomerism In Thalidomide». Thalidomide, abril 2000. [Consulta: 2 maig 2009].
- ↑ Silverman, William «The Schizophrenic Career of a "Monster Drug"». Pediatrics, 110, 2, 22-04-2002, pàg. 404–6. Arxivat de l'original el 2007-02-02. DOI: 10.1542/peds.110.2.404. PMID: 12165600 [Consulta: 15 novembre 2011].
- ↑ Rao KV «Lenalidomide in the treatment of multiple myeloma». American Journal of Health-system Pharmacy : AJHP : Official Journal of the American Society of Health-System Pharmacists, 64, 17, September 2007, pàg. 1799–807. DOI: 10.2146/ajhp070029. PMID: 17724360 [Consulta: 18 juny 2009].
- ↑ Anon. «Use of thalidomide in leprosy». WHO:leprosy elimination. WHO. Arxivat de l'original el 29 de setembre 2010. [Consulta: 22 abril 2010].
- ↑ FDA, Center for Drug Evaluation and Research, July 16, 1998
- ↑ FDA Approves Thalomid (thalidomide) to Treat Multiple Myeloma
- ↑ Desikan, R.; Munsi, N.; Zeldis, J. [et al]. «Activity of thalidomide (THAL) in multiple myeloma (MM) confirmed in 180 patients with advanced disease». Blood, 94, Suppl. 1, 1999, pàg. 603a–603a.
- ↑ Ismail, MA. «FDA: A Shell of its Former Self». Pushing Prescriptions. The Centre for Public Integrity, 07-07-2005. Arxivat de l'original el 2011-10-12. [Consulta: 15 novembre 2011].
- ↑ Anon. «Thalidomide». Cancer treatments. Cancerbackup. [Consulta: 1r maig 2009].
- ↑ Castilla, E.E. [et al]. «Thalidomide, a current teratogen in South America». Teratology. Wiley-Liss, 54, 6, 1996, pàg. 273–7. Arxivat de l'original el 2012-03-24. DOI: 10.1002/(SICI)1096-9926(199612)54:6<273::AID-TERA1>3.0.CO;2-#. PMID: 9098920 [Consulta: 15 novembre 2011]. Arxivat 2012-03-24 a Wayback Machine.
- ↑ Paumgartten, J.R.; Chahoud, Ibrahim «Thalidomide embryopathy cases in Brazil after 1965». Reproductive Toxicology, 22, 1, 2006, p. 1-2. DOI: 10.1016/j.reprotox.2005.11.007.
- ↑ Correio Braziliense «Talidomida volta a assustar». , 2006. Arxivat de l'original el 2012-03-13 [Consulta: 15 novembre 2011].
- ↑ Ferrer i Fornells, Mariona «Sense justícia a l'Estat per a les víctimes de la talidomida». Diari Ara, 24-09-2015, pàg. 19.
- ↑ Rouhi, Maureen. «Thalidomide». Chemical & Engineering News. Societat Química Americana. [Consulta: 21 setembre 2006].
- ↑ Madnani NA, Khan KJ «Linear IgA bullous dermatosis of childhood: Response to thalidomide». Indian Journal of Dermatology, Venereology, and Leprology, 76, 4, 2010, pàg. 427. DOI: 10.4103/0378-6323.66601. PMID: 20657136.[Enllaç no actiu]
- ↑ Brown, RD; Spencer A, Ho PJ, Kennedy N, Kabani K, Yang S, Sze DM, Aklilu E, Gibson J, Joshua DE «Prognostically significant cytotoxic T cell clones are stimulated after thalidomide therapy in patients with multiple myeloma». Leukemia & Lymphoma, 50, 11, 2009 Nov, pàg. 1860–4. DOI: 10.3109/10428190903216804. PMID: 19883313 [Consulta: 4 juny 2011].
- ↑ Ghassem, Solgi; Kariminia A., Abdi K, Darabi M, Ghareghozloo B. «Effects of combined therapy with thalidomide and glucantime on leishmaniasis induced by Leishmania major in BALB/c mice» (PDF). Korean Journal of Parasitology, 44, 1, març 2006, pàg. 55–61. Arxivat de l'original el 2012-05-03. DOI: 10.3347/kjp.2006.44.1.55. PMC: 2532651. PMID: 16514283 [Consulta: 15 novembre 2011]. Arxivat 2012-05-03 a Wayback Machine.
- ↑ Lebrin, Franck; Srun S., Raymond2 K, Martin S., van den Brink S, Freitas C., Bréant C., Mathivet T., Larrivée B., Thomas J., Arthur H., Westermann C., Disch F., Mager J., Snijder R., Eichmann A., Mummery C. «Thalidomide stimulates vessel maturation and reduces epistaxis in individuals with hereditary hemorrhagic telangiectasia». Nature Medicine, 16, 4, abril 2010, pàg. 420–8. DOI: 10.1038/nm.2131. PMID: 20364125.
- ↑ Singhal S, Mehta J, Desikan R, et al. «Antitumor activity of thalidomide in refractory multiple myeloma». The New England Journal of Medicine, 341, 21, November 1999, pàg. 1565–71. DOI: 10.1056/NEJM199911183412102. PMID: 10564685 [Consulta: 18 juny 2009].
- ↑ Gieseler F «Pathophysiological considerations to thrombophilia in the treatment of multiple myeloma with thalidomide and derivates». Thrombosis and Haemostasis, 99, 6, June 2008, pàg. 1001–7. DOI: 10.1160/TH08-01-0009. PMID: 18521500 [Consulta: 18 juny 2009].
- ↑ Denz U, Haas PS, Wäsch R, Einsele H, Engelhardt M «State of the art therapy in multiple myeloma and future perspectives». European Journal of Cancer (Oxford, England : 1990), 42, 11, July 2006, pàg. 1591–600. DOI: 10.1016/j.ejca.2005.11.040. PMID: 16815703 [Consulta: 18 juny 2009].
- ↑ Haas PS, Denz U, Ihorst G, Engelhardt M «Thalidomide in consecutive multiple myeloma patients: single-center analysis on practical aspects, efficacy, side effects and prognostic factors with lower thalidomide doses». Eur. J. Haematol., 80, 4, abril 2008, pàg. 303–9. DOI: 10.1111/j.1600-0609.2007.01022.x. PMID: 18182082.
- ↑ Bennett CL, Angelotta C, Yarnold PR, et al. «Thalidomide- and lenalidomide-associated thromboembolism among patients with cancer». JAMA, 296, 21, December 2006, pàg. 2558–60. DOI: 10.1001/jama.296.21.2558-c. PMID: 17148721.
- ↑ Teo SK, Colburn WA, Tracewell WG, Kook KA, Stirling DI, Jaworsky MS, Scheffler MA, Thomas SD, Laskin OL «Clinical pharmacokinetics of thalidomide». Clin Pharmacokinet., 43, 5, 2004, pàg. 311–327. DOI: 10.2165/00003088-200443050-00004. PMID: 15080764.
- ↑ 52,0 52,1 52,2 52,3 Stephens TD, Bunde CJ, Fillmore BJ «Mechanism of action in thalidomide teratogenesis». Biochemical Pharmacology, 59, 12, June 2000, pàg. 1489–99. DOI: 10.1016/S0006-2952(99)00388-3. PMID: 10799645.
- ↑ Koch HP, Czejka MJ «Evidence for the intercalation of thalidomide into DNA: clue to the molecular mechanism of thalidomide teratogenicity?». Z. Naturforsch., C, J. Biosci., 41, 11–12, 1986, pàg. 1057–61. PMID: 2953123.
- ↑ Huang PH, McBride WG «Interaction of [glutarimide-2-14C]-thalidomide with rat embryonic DNA in vivo». Teratogenesis, Carcinogenesis, and Mutagenesis, 17, 1, 1997, pàg. 1–5. DOI: 10.1002/(SICI)1520-6866(1997)17:1<1::AID-TCM2>3.0.CO;2-L. PMID: 9249925.
- ↑ Therapontos C, Erskine L, Gardner ER, Figg WD, Vargesson N «Thalidomide induces limb defects by preventing angiogenic outgrowth during early limb formation». Proceedings of the National Academy of Sciences of the United States of America, 106, 21, May 2009, pàg. 8573–8. DOI: 10.1073/pnas.0901505106. PMC: 2688998. PMID: 19433787 [Consulta: 18 juny 2009].
- ↑ Carl Zimmer «Answers Begin to Emerge on How Thalidomide Caused Defects». New York Times, 15-03-2010 [Consulta: 21 març 2010]. «As they report in the current issue of Science, a protein known as cereblon latched on tightly to the thalidomide.»
- ↑ Ito T, Ando H, Suzuki T, Ogura T, Hotta K, Imamura Y, Yamaguchi Y, Handa H «Identification of a primary target of thalidomide teratogenicity». Science, 327, 5971, 2010, pàg. 1345–1350. DOI: 10.1126/science.1177319. PMID: 20223979.
- ↑ 58,0 58,1 58,2 58,3 Anderson, KC «Lenalidomide and thalidomide: mechanisms of action--similarities and differences». Semin Hematol., Vol. 42, num. 4 Suppl 4, 2005, pàg. S3-8. DOI: http://dx.doi.org/10.1053/j.seminhematol.2005.10.001. PMID: 16344099.
- ↑ Search of: pomalidomide — ClinicalTrials.gov
- ↑ Raghupathy R, Billett HH «Promising therapies in sickle cell disease». Cardiovasc Hematol Disord Drug Targets, 9, 1, març 2009, pàg. 1–8. Arxivat de l'original el 2013-05-11. DOI: 10.2174/187152909787581354. PMID: 19275572 [Consulta: 27 juny 2021]. Arxivat 2013-05-11 a Wayback Machine.
- ↑ Dreifus «A Conversation with Rock Brynner — A 'Dark Remedy' Is Now Generating Light». The New York Times, 31-07-2001 [Consulta: 11 octubre 2010].
- ↑ Courtenay-Smith «A truly special love story: Two married thalidomide survivors living happily 50 years after drug's launch». The Daily Mail [Londres], 23-04-2008 [Consulta: 18 juny 2009].
- ↑ Orpheus lives: A small good thing in Quastoff Retrieved on 2008-10-22
- ↑ Nobody's Perfect Release Dates
- ↑ Movie Review of Nobody's Perfect
- ↑ «(Interview) Kate Rigby, author of ‘Thalidomide Kid'». Leicester Review of Books, 19-11-2007 [Consulta: 29 setembre 2011]. «My latest book is about a boy called Daryl affected by the Thalidomide tragedy (he has no arms) and the way he copes with his disability through humor (he calls himself ‘Thalidomide Kid'). At the heart of the story is the burgeoning romance between Daryl and the deputy head's daughter, Celia, and the pains and prejudice they face in a 70s school setting.»
