Kolagen


Kolagen je skleroprotein, extracelulární, ve vodě nerozpustná bílkovina, která je základní stavební hmotou pojivových tkání. Tvoří 25–30 % všech proteinů v těle savců, ve formě kolagenních vláken je složkou mezibuněčné hmoty. V současnosti je známo nejméně 27 rozdílných typů kolagenů.
Kolagenové choroby, tj. choroby charakteristické patologickými či degradačními formami kolagenu, postihují např. srdce, cévy, svaly a kůži. Samotný kolagen hraje důležitou roli i při stárnutí organismu.
Struktura
[editovat | editovat zdroj]Aminokyselinové složení
[editovat | editovat zdroj]Molekula kolagenu je tvořena hlavně aminokyselinami glycinem, prolinem, hydroxyprolinem a hydroxylysinem. Poslední dva vznikají posttranslační modifikací prolinu a lysinu za účasti kyseliny askorbové – vitaminu C.
Kolagen se skládá z řetězců alfa 1 a alfa 2, které se jen málo liší pořadím aminokyselin. Řetězce tvoří trojitou spirálu, která se označuje jako tropokolagen. Je to základní jednotka kolagenu, dlouhá přibližně 256 nm.
Sekundární struktura
[editovat | editovat zdroj]Levotočivá šroubovice protáhlého typu,[1] kde závity mají stoupání 0,95 nm a jednotlivé peptidy jsou vzdálené o 0,286 nm.
Terciární struktura
[editovat | editovat zdroj]Terciární strukturu kolagenu tvoří 3 řetězce, které se vzájemně ovíjejí za vzniku pravotočivé trojšroubovice se společnou osou. Výsledné tyčinkovité uspořádání je dlouhé cca 290 nm o průměru 1,4 nm a nazývá se tropokolagen.[1]
Kvarterní struktura (vlákno)
[editovat | editovat zdroj]Kolagenní vlákna jsou komplexní vláknitou strukturou. Vyskytují se ve všech typech pojivových tkání. Jsou měkká, ohebná, nepružná a vysoce pevná v tahu. Uvádí se, že 1 mm2 kolagenních vláken udrží 50 kg. Ve svazcích mají bílou barvu. Ve tkáních mohou být uspořádány do řídkých sítí nebo uspořádaných svazků (šlachy). Tloušťka kolagenního vlákna se pohybuje mezi 1–20 μm, délka může být různá. Při větším zvětšení se přestanou jevit jako homogenní struktura a lze vidět podélné pruhování.
Nejtenčí struktura ještě rozlišitelná světelným mikroskopem se nazývá fibrila. Je tlustá 0,3–0,5 μm. Ovšem i fibrily samotné se skládají z menších jednotek, mikrofibril, které jsou pozorovatelné pouze pod elektronovým mikroskopem případně v AFM. Průměr mikrofibril se pohybuje mezi 20–100 nm, v průměru asi 75 nm. Nově vytvořené mikrofibrily měří cca 20 nm, s přibývajícím věkem se jejich tloušťka zvětšuje. Pro mikrofibrily je charakteristické příčné pruhování v intervalu 64 nm. Molekuly tropokolagenu, uspořádané v mikrofibrile v paralelních řadách, se totiž přesahují o 1/4 své délky. Místo přesahu se tak v elektronovém mikroskopu jeví tmavší.
Typy kolagenu
[editovat | editovat zdroj]Existuje celá řada typů, nejdůležitější je kolagen typu I, II, III, IV, a V. Nejrozšířenější je typ I, představuje 90 % kolagenu v organismech, je přítomen v pokožce, šlachách, kostech a zubech. Typ II se vyskytuje v chrupavkách. Typ III je kolagen embryonálního vývoje, později je nahrazen typem I. Typ IV se vyskytuje v bazální membráně epitelů. Kolagen typu V je charakteristický pro stěnu krevních cév.
Kolageny tvořící vlákna
[editovat | editovat zdroj]Mezi tyto typy patří široce rozšířené kolageny typu I, II, III, V, XI, nově objevené XXIV a XXVII. Všech 12 vlákna-tvořících α-řetězců sdílí dlouhou nepřerušovanou kolagenní doménu ukončenou N- a C- terminálními propeptidy[2]. α-řetězce vytváří nejméně 12 specifických protomerů charakterizovaných jako homo- a heterotrimery. Terminální propeptidy jsou později v procesu oligomerizace a tvoření fibril odstraněny specifickými proteázami.
Kolageny tvořící sítě
[editovat | editovat zdroj]Do této skupiny náleží typy IV, VIII a X[2]. Na rozdíl od předchozích je C-NC doména součástí suprastruktur. Krystalová struktura C-NC domén je známa, což poskytuje informaci pro pochopení mechanismu výběru řetězce.
FACIT
[editovat | editovat zdroj]FACIT (z angl. Fibril-associated collagens with interrupted triple helix, volně přeloženo jako s vláknem asociované kolageny s přerušenou trojitou šroubovicí) [2] tvoří rodinu obsahující typ IX, XII, XIV, XVI, XIX, XX, XXI a XXII. Kolagen IX je tvořen 3 α-řetězci a všechny ostatní jedním α-řetězcem. Charakteristikou je krátká kolagenní doména přerušovaná několika NC doménami. Protomer kolagenu IX je heterotrimer, zatímco ostatní jsou homotrimery. Na rozdíl od kolagenů tvořících vlákna FACITy mají významně kratší C-NC domény: 75 reziduí u kolagenu XII a méně než 30 reziduí u kolagenu IX, zatímco kolageny tvořící vlákna mají cca 260 reziduí.
Transmembránové kolageny
[editovat | editovat zdroj]Transmembránové kolageny obsahují typy XIII, XVII, XXIII, XXV a další kolagenu-podobné proteiny jako např. makrofágový receptor MARCO. Jejích funkcí je podíl na buněčných povrchových receptorech a v matrixu[2]. α-řetězec každého typu obsahuje N-terminální NC doménu, která zahrnuje
- tři subdomény – intracelulární, transmembránovou a extracelulární juxtamembránovou spojovací subdoménu
- velkou extracelulární doménu sestávající z několika kolagenních domén přerušených NC doménami.
Protomer každého α-řetězce je homotrimer. Extracelulární spojovací doména obsahuje α-helikální coiled coil strukturu.
Ostatní kolageny
[editovat | editovat zdroj]Jen velmi málo je známo o kolagenu XV, XVIII a nově objeveném XXVI a XXVIII. Každý typ sestává z jediného α-řetězce, který obsahuje kolagenní doménu obklopenou N-CN a C-NC doménami.
Přehled
[editovat | editovat zdroj]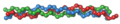
| Typ | Poznámky | Gen resp. geny | Poruchy |
| I | Tento typ je nejdůležitějším a nejrozšířenějším typem kolagenu, který má i široké průmyslové využití. Je základem např. hemostatické plsti, chirurgických nití, kolagenových membrán, dále pak je součástí řady potravinových doplňků či kosmetických přípravků proti stárnutí pleti.
Kolagen typ I tvoří typická 1–20 µm dlouhá kolagenní vlákna. Hlavní výskyt v lidském těle[3]: arachnoidea, Bowmannova membrána rohovky, bubínek, choroidea, kost, kůra vaječníku, pleura, perineurium, subserosa žlučníku, tuková tkáň, tunica adventitia cév (i kapilár), vazivová chrupavka, závěsný aparát zubu. |
COL1A1COL1A2 | osteogenesis imperfecta, Ehlers-Danlosův syndrom |
| II | Jsou 20 nm dlouhé fibrily (neagregují ve vlákna).
Hlavní výskyt v lidském těle: arachnoidea, bazální membrána lamina reticularis, papilaris, endoneurium, hyalinní a elastická chrupavka (i vazivová), kůra vaječníku, lamina propria endometria, mezenchymové vazivo, okolo hladkých svalových buněk, opora sacculi alveolares a alveolů, pars distalis adenohypofýzy, perineurium (s kolagenem I), pouzdro Langerhansových ostrůvků, retikulární vazivo, rosolovité vazivo (Warthonův rosol – pupečník), stroma kostní dřeně (s retikulárním vazivem), stroma glandulae parathyreoideales, stroma jater, stroma lymfatického uzlíku, stroma lymfatických uzlin, stroma nadledvin, stroma periferních lymfatických orgánů, stroma sleziny, stroma štítné žlázy, stroma tonzily, tuková tkáň (s kolagenem I), tunica media (okolo hladkých svalových buněk) |
COL2A1 | - |
| III | Výskyt podobný jako typ I. Dříve se nazýval retikulín. | COL3A1 | Ehlers-Danlosův syndrom |
| IV | Jde o nepolymerizovaný tropokolagen.
Hlavní výskyt v lidském těle: bazální lamina, capsula lentis. |
COL4A1COL4A2COL4A3COL4A4COL4A5COL4A6 | Alportův syndrom |
| V | Hlavní výskyt v lidském těle: zevní laminy svalových elementů, glií, adipocytů. | COL5A1COL5A2COL5A3 | - |
| VI | Je příbuzný kolagenu IV.
Výskyt:V intersiciální tkáni. |
COL6A1COL6A2COL6A3 | kongenitální myopatie[4] |
| VII | V tkáních epitelu. | COL7A1 | epidermolysis bullosa |
| VIII | Výskyt: V některých buňkách endotelu. | COL8A1COL8A2 | - |
| IX | FACIT.
Výskyt: V chrupavkách společně s typem II. |
COL9A1COL9A2COL9A3 | - |
| X | Výskyt:Je součástí hypetrofických a mineralizujících chrupavek. | COL10A1 | - |
| XI | Výskyt: V chrupavce. | COL11A1COL11A2 | - |
| XII | FACIT.
Výskyt:Vyskytuje se společně s typy I a II. |
COL12A1 | - |
| XIII | transmembránový kolagen | COL13A1 | - |
| XIV | FACIT | COL14A1 | - |
| XV | - | COL15A1 | - |
| XVI | FACIT | COL16A1 | - |
| XVII | transmembranový kolagen | COL17A1 | bulózní pemfigoitida a jisté formy epidermolysis bullosa |
| XVIII | COL18A1 | - | |
| XIX | FACIT | COL19A1 | - |
| XX | FACIT | COL20A1 | - |
| XXI | FACIT | COL21A1 | - |
| XXII | FACIT | COL22A1 | - |
| XXIII | transmembránový kolagen | COL23A1 | - |
| XXIV | - | COL24A1 | - |
| XXV | transmembránový kolagen | COL25A1 | - |
| XXVII | - | COL27A1 | - |
| XXVIII | - | COL28A1 | - |
Metabolismus kolagenu
[editovat | editovat zdroj]
Syntéza
[editovat | editovat zdroj]Kolagen je produkován především vazivovými buňkami (fibroblasty), buňkami chrupavky (chondroblasty), kostí (osteoblasty), ale i epitelovými buňkami. Syntéza zčásti probíhá uvnitř buňky, částečně extracelulárně. Polypeptidové řetězce jsou syntetizovány na hrubém endoplazmatickém retikulu buňky. Vzniklý prokolagen je vyloučen do extracelulárního prostoru, kde z něj enzym prokolagenpeptidáza odštěpí tropokolagen. Ten reaguje s ostatními molekulami tropokolagenu a za přítomnosti katalyzátoru, kterým je enzym lysyloxidáza, vytváří mikrofibrily.
Následně po syntéze procházejí molekuly kolagenu posttranslační modifikaci, která bílkovině zajistí plnou funkčnost. Mezi tyto modifikace patří i hydroxylace, kdy se hydroxylová skupina váže s četností jedna ku tisíci aminokyselinových molekul kolagenu. Přesto je hydroxylace pro správnou funkci kolagenu nenahraditelná, jak dokazuje výzkum choroby osteogenesis imperfecta neboli nemoci „křehkých kostí“.[5]
Rozklad
[editovat | editovat zdroj]Rozklad kolagenu v mezibuněčných prostorách umožňují zejména tzv. kolagenázy.
Využití
[editovat | editovat zdroj]Kolagen se používá k výrobě želatiny, klihu, jako materiál pro výrobu chirurgických vláken, na úpravu cévních protéz a na obaly uzenin (střívka). Své využití našel také v plastické chirurgii, orgánovém inženýrství[6] a v kosmetice.
Stanovení obsahu kolagenu v mase
[editovat | editovat zdroj]Obsahem kolagenu se rozumí obsah hydroxyprolinu vynásobený koeficientem 8[7]. Obsah hydroxyprolinu je nutno stanovit metodou ISO 3496-1978.
Pravěký kolagen
[editovat | editovat zdroj]Od roku 2005 se objevují zprávy o izolování původních proteinů (včetně kolagenu) z výborně dochovaných fosilií druhohorních dinosaurů (např. rodů Tyrannosaurus nebo Brachylophosaurus). Tímto výzkumem se dlouhodobě zabývá například molekulární paleontoložka Mary Higby Schweitzerová ze Státní univerzity v Severní Karolíně.[8][9] V roce 2017 bylo novými metodami zjištěno, že původní peptidy a proteiny se za určitých podmínek skutečně mohou zachovat i ve fosiliích starých desítky milionů let.[10][11]
V roce 2019 byla publikována studie týmu vědců, kteří údajně přímo prokázali přítomnost kolagenu typu I ve vzorcích tyranosaura zvaného „Wankel-Rex“ (MOR 555, později USNM 555000), objeveného roku 1988 ve východní Montaně.[12]
Podle některých vědců může za dochování struktury kolagenu ve fosiliích starých až 200 milionů let Pauliho vylučovací princip.[13]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]- ↑ a b SHOULDERS, Matthew D.; RAINES, Ronald T. Collagen Structure and Stability. Annu. Rev. Biochem.. Čís. 78, s. 929–958. DOI 10.1146/annurev.biochem.77.032207.120833.
- ↑ a b c d [1] Archivováno 29. 9. 2007 na Wayback Machine. J. Biol. Chem., Vol. 281, Issue 50, 38117-38121, December 15, 2006, Molecular Recognition in the Assembly of Collagens: Terminal Noncollagenous Domains Are Key Recognition Modules in the Formation of Triple Helical Protomers, Jamshid Khoshnoodi{ddagger}1, Jean-Philippe Cartailler§1, Keith Alvares¶, Arthur Veis¶, and Billy G. Hudson
- ↑ histologická wiki. wiki.medik.cz [online]. [cit. 2007-04-24]. Dostupné v archivu pořízeném z originálu dne 2007-05-07.
- ↑ BETHLEM MYOPATHY, MYOPATHY, BENIGN CONGENITAL, WITH CONTRACTURES MUSCULAR DYSTROPHY, BENIGN CONGENITAL
- ↑ http://www.osel.cz/index.php?clanek=2203
- ↑ Umělá mízní uzlina – základním stavebním kamenem je kolagen
- ↑ Nařízení Komise (ES) č. 2331/97 o zvláštních podmínkách pro poskytování vývozních náhrad pro některé výrobky z vepřového masa
- ↑ Paul V. Ullmann, Kyle Macauley, Richard D. Ash, Ben Shoup and John B. Scannella (2021). Taphonomic and Diagenetic Pathways to Protein Preservation, Part I: The Case of Tyrannosaurus rex Specimen MOR 1125. Biology. 10 (11): 1193. doi: https://doi.org/10.3390/biology10111193
- ↑ SOCHA, Vladimír. Příběh gravidní tyranosauřice pokračuje. OSEL.cz [online]. 23. prosince 2021. Dostupné online. (česky)
- ↑ http://dinosaurusblog.com/2011/06/21/896562-zachovani-dinosaurich-proteinu/
- ↑ http://dinosaurusblog.com/2017/01/30/kolagen-stary-78-milionu-let/
- ↑ http://www.osel.cz/10891-co-je-noveho-u-dinosaurich-mekkych-tkani.html
- ↑ Jinyi Yang, Volga Kojasoy, Gerard J. Porter & Ronald T. Raines (2024). Pauli Exclusion by n→π* Interactions: Implications for Paleobiology. ACS Central Science (advance online publication). doi: https://doi.org/10.1021/acscentsci.4c00971
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu kolagen na Wikimedia Commons
Obrázky, zvuky či videa k tématu kolagen na Wikimedia Commons  Slovníkové heslo kolagen ve Wikislovníku
Slovníkové heslo kolagen ve Wikislovníku