Pyrimidin
| Pyrimidin | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | 1,3-diazin |
| Sumární vzorec | C4H4N2 |
| Identifikace | |
| Registrační číslo CAS | 289-95-2 |
| Vlastnosti | |
| Molární hmotnost | 80,08 g/mol |
| Teplota tání | 20 až 22 °C |
| Teplota varu | 123 až 124 °C |
| Hustota | 1,016 g.cm−3 |
| Rozpustnost ve vodě | mísitelný |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
Pyrimidin je šestičlenná heterocyklická aromatická organická sloučenina podobná benzenu a pyridinu. Obsahuje dva atomy dusíku na pozicích 1 a 3 v šestičlenném kruhu. Název je odvozen od řeckého pyr (teplo, oheň) a sloučenin skupiny amidů. Podle systematického názvosloví je také nazýván 1,3-diazin.
Pyrimidin je izomerický se dvěma formami diazinu. Jsou to pyrazin (atomy dusíku na 1 a 4 pozici) a pyridazin (atomy dusíku na 1 a 2 pozici).
Deriváty pyrimidinu jsou tři nukleové báze, které se nacházející v nukleotidech nukleových kyselin. Jsou to cytosin (C), thymin (T) a uracil (U). Jsou to životně důležité látky, které se nalézají ve všech živých organismech a jsou nositeli jejich dědičných vlastností.
Vzorec pyrimidinu
[editovat | editovat zdroj]
Deriváty pyrimidinu
[editovat | editovat zdroj]| Vzorec | Jméno | C2 | C4 | C5 | C6 |
|---|---|---|---|---|---|
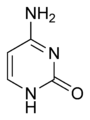
| C4H5N3O | cytosin | =O | –NH2 | –H | –H |
| C4H4N2O2 | uracil | =O | =O | –H | –H |
| C4H3FN2O2 | fluorouracil | =O | =O | –F | –H |
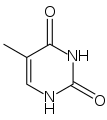
| C5H6N2O2 | thymin | =O | =O | –CH3 | –H |
| C4H4N2O3 | kyselina barbiturová | =O | =O | –H | =O |
| C5H4N2O4 | kyselina orotová | =O | =O | –H | -COOH |
Nukleové báze
[editovat | editovat zdroj]Nejdůležitějšími deriváty pyrimidinu jsou nukleové báze – cytosin, uracil, thymin. Dalšími nukleovými bázemi jsou deriváty odvozené z purinu – adenin, guanin.
-
Cytosin (C)
-
Thymin (T)
-
Uracil (U)
Nukleové báze odvozené z pyrimidinu a purinu se v nukleových kyselinách obvykle vážou na ribózu (ribonukleová kyselina RNA) nebo na deoxyribózu (deoxyribonukleová kyselina DNA):
- v RNA se vyskytují čtyři báze: adenin (A), guanin (G), cytosin (C) a uracil (U)
- v DNA se vyskytují čtyři báze: adenin (A), guanin (G), cytosin (C) a thymin (T)
V nukleových kyselinách vytvářejí nukleové báze doplňkové dvojice (komplementární páry), v nichž se vždy jedna purinová a jedna pyrimidinová báze vzájemně vážou vodíkovými vazbami. Guanin se váže s cytosinem a adenin s thyminem nebo s uracilem. Tyto vazby tvoří kód k zápisu genetické informace v živých organismech. Komplementární párování pak umožňuje tuto informaci realizovat při procesech replikace, transkripce a translace.
Chemické vlastnosti
[editovat | editovat zdroj]Chemické vlastnosti pyrimidinu se v mnohém shodují s pyridinem a benzenem. Jeho aromatický charakter způsobuje, že se snadno zúčastňuje elektrofilních a nukleofilních aromatických substitucí. Tedy reakcí, kdy elektrofil nebo nukleofil nahrazuje jinou skupinu navázanou na aromatické jádro. S narůstajícím počtem atomů dusíku v cyklu klesá energie π elektronů a elektrofilní aromatická substituce se stává mnohem obtížnější, zatímco nukleofilní aromatická substituce se stává snadnější.
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byly použity překlady textů z článků Pyrimidin na německé Wikipedii a Pyrimidine na anglické Wikipedii.
- ↑ a b Pyrimidine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Pyrimidin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Pyrimidin na Wikimedia Commons