Tebbeovo činidlo
| Tebbeovo činidlo | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | μ-chlor[di(cyklopenta-2,4-dien-1-yl)]dimethyl(μ-methylen)titan-hliník |
| Sumární vzorec | C13H18AlClTi |
| Identifikace | |
| Registrační číslo CAS | 67719-69-1 |
| PubChem | 53384502 |
| SMILES | C[Al-]1(C[Ti+2][Cl+]1)C.[cH-]1cccc1.[cH-]1cccc1 |
| InChI | InChI=1S/2C5H5.2CH3.CH2.Al.Cl.Ti/c2*1-2-4-5-3-1;;;;;;/h2*1-5H;2*1H3;1H2;;;/q2*-1;;;;-1;+1;+2 |
| Vlastnosti | |
| Molární hmotnost | 284,58 g/mol |
| Rozpustnost v polárních rozpouštědlech | za nízkých teplot rozpustný v tetrahydrofuranu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu, dichlormethanu a toluenu |
Některá data mohou pocházet z datové položky. | |
Tebbeovo činidlo je organokovová sloučenina se vzorcem (C5H5)2TiCH2ClAl(CH3)2. Používá se k methylenacím karbonylových sloučenin, kdy přeměňuje R2C=O skupiny na R2C=CH2.[1]
Jedná se o červeně zbarvenou pevnou látku, na vzduchu samozápalnou, se kterou se musí pracovat v anaerobním, bezvodém prostředí. Objevil ji Fred Tebbe.
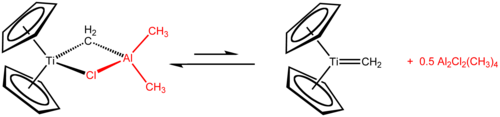
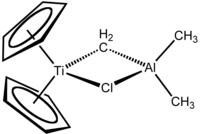
Tebbeovo činidlo obsahuje dvě tetraedrická kovová centra spojená dvojicí můstkových ligandů. Na atom titanu jsou navázány dva cyklopentadienyly (C5H -
5 , Cp) a na atom hliníku dvě methylové skupiny. Atomy titanu a hliníku jsou navzájem propojeny jak methylenovým můstkem (-CH2-), tak i chloridovým můstkem a geometrie Ti–CH2–Al–Cl je téměř čtvercově rovinná.[2]
Tebbeovo činidlo bylo první popsanou sloučeninou s methylenovým můstkem spojujícím přechodný kov (titan) a kov hlavní skupiny (hliník).[3]
Příprava
[editovat | editovat zdroj]Tebbeovo činidlo se připravuje reakcí titanocendichloridu s trimethylhliníkem v toluenu.[3][4]
- Cp2TiCl2 + 2 Al(CH3)3 → CH4 + Cp2TiCH2AlCl(CH3)2 + Al(CH3)2Cl
Po přibližně 3 dnech se získá produkt rekrystalizací, která odstraní Al(CH3)2Cl.[3] Přestože syntézy využívající izolované Tebbeovo činidlo vedou k čistějším produktům, tak byly dosaženy dobré výsledky i při použití činidla in situ.[5][6] Místo izolace Tebbeova činidla se roztok před přidáním výchozích látek ochladí ledem.
Jiným způsobem je použití dimethyltitanocenu:[7]
- Cp2Ti(CH3)2 + Al(CH3)2Cl → Cp2TiCH2AlCl(CH3)2 + CH4
Nevýhodou tohoto postupu je, kromě potřeby Cp2Ti(CH3)2, obtížné oddělování produktu od nezreagovaných výchozích látek.
Mechanismus reakcí
[editovat | editovat zdroj]Samo Tebbeovo činidlo s karbonylovými sloučeninami nereaguje, nejprve musí být vystaveno Lewisově zásadě, například pyridinu, čímž vznikne aktivní Schrockův karben.
Podobně jako u Wittigových činidel reaktivitu řídí vysoká oxofilita titaničitých sloučenin. Schrockův karben (1) reaguje s karbonylovou sloučeninou (2) za tvorby oxatitanacyklobutanového meziproduktu (3). Tento cyklický meziprodukt nebyl nikdy izolován, pravděpodobně kvůli rychlému rozpadu na výsledný alken (5).
Možnosti
[editovat | editovat zdroj]Tebbeovo činidlo slouží k methylenacím karbonylových sloučenin,[8][8][9][10] tuto přeměnu lze také provést pomocí Wittigovy reakce; i když je Tebbeovo činidlo účinnější, obzvláště u stericky zatížených karbonylových sloučenin. Tebbeovo činidlo je méně zásadité než Wittigova činidla a nezpůsobuje β-eliminace.
Methylenace probíhají i u esterů, laktonů a karboxamidů. Tebbeovo činidlo přeměňuje estery a laktony na enolethery a karboxamidy na enaminy. Pokud sloučenina obsahuje ketonové i esterové skupiny, tak keton za přítomnosti jednoho ekvivalentu činidla reaguje selektivně.
Tebbeovo činidlo methylenuje karbonylové sloučeniny, aniž by docházelo k racemizaci chirálních α uhlíků. Díky tomu má využití v reakcích cukrů, kde je třeba zachovat stereoizomerii.[11]
Tebbeovo činidlo reaguje s acylchloridy za tvorby titaničitých enolátů nahrazením Cl−.
Obměny
[editovat | editovat zdroj]Tebbeovo činidlo lze obměňovat použitím různých ligandů., čímž se může měnit reaktivita komplexu, jež umožní provádění širšího rozsahu reakcí; například s chlorovanou obdobou lze dosáhnout cyklopropanací.[12]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Tebbe's reagent na anglické Wikipedii.
- ↑ F. N. Tebbe; G. W. Parshall; G. S. Reddy. Olefin homologation with titanium methylene compounds. Journal of the American Chemical Society. 1978, s. 3611–3613. DOI 10.1021/ja00479a061.
- ↑ Rick Thompson; Eiko Nakamaru-Ogiso; Chun-Hsing Chen; Maren Pink; Daniel J. Mindiola. Structural Elucidation of the Illustrious Tebbe Reagent. Organometallics. 2014, s. 429–432. DOI 10.1021/om401108b.
- ↑ a b c Herrmann, W. A., "The Methylene Bridge" Advances in Organometallic Chemistry 1982, 20, 195–197
- ↑ Straus, D. A., "μ-Chlorobis(cyclopentadienyl)(dimethylaluminium)-μ-methylenetitanium": Encyclopedia of Reagents for Organic Synthesis. John Wiley, London, 2000
- ↑ S. H. Pine; V. Kim; V. Lee. Enol ethers by methylenation of esters: 1-Phenoxy-1-phenylethene and 3,4-dihydro-2-methylene-2H-1-benzopyran. Organic Syntheses. 1990, s. 72. DOI 10.15227/orgsyn.069.0072.
- ↑ L. F. Cannizzo; R. H. Grubbs. In situ preparation of (μ-chloro)(μ-methylene)bis(cyclopentadienyl)(dimethylaluminum)titanium (Tebbe's reagent). The Journal of Organic Chemistry. 1985, s. 2386–2387. DOI 10.1021/jo00213a040.
- ↑ PAYACK, J. F.; HUGHES, D. L.; CAI, D.; COTTRELL, I. F.; VERHOEVEN, T. R. Dimethyltitanocene. Org. Synth.. 2004. Dostupné online.; Coll. Vol.. S. 355.
- ↑ a b Richard C. Hartley; Jianfeng Li; Calver A. Main; Gordon J. McKiernan. Titanium carbenoid reagents for converting carbonyl groups into alkenes. Tetrahedron. 2007, s. 4825–4864. DOI 10.1016/j.tet.2007.03.015.
- ↑ Pine, S. H. Organic Reactions 1993, 43, 1
- ↑ Beadham, I.; Micklefield, J. Current Organic Synthesis 2005, 2, 231–250
- ↑ A. Marra; J. Esnault; A. Veyrieres; P. Sinay. Isopropenyl glycosides and congeners as novel classes of glycosyl donors: theme and variations. Journal of the American Chemical Society. 1992, s. 6354–6360. DOI 10.1021/ja00042a010.
- ↑ Unusual Ambiphilic Carbenoid Equivalent in Amide Cyclopropanation Kuo-Wei Lin, Shiuan Yan, I-Lin Hsieh, and Tu-Hsin Yan Organic Letters; 2006; 8(11) pp 2265 – 2267; [1]
Související články
[editovat | editovat zdroj]- Kulinkovičoca reakce
- Petasisovo činidlo
- McMurryova reakce
- Nystedovo činidlo
- Petersonova olefinace
- Wittigova reakce
- Kauffmannova olefinace
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Tebbeovo činidlo na Wikimedia Commons
Obrázky, zvuky či videa k tématu Tebbeovo činidlo na Wikimedia Commons