Candesartan
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Candesartan[1] | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Candesartan ist ein Arzneistoff, der als Antihypertonikum bei der essentiellen arteriellen Hypertonie sowie zur Behandlung von Patienten mit Herzinsuffizienz zugelassen ist. Es gehört zur Gruppe der AT1-Antagonisten. Das Molekül enthält als charakteristische Strukturelemente einen Benzimidazol-Ring, welcher mit einer Carboxylgruppe und einer Ethoxygruppe verknüpft ist, sowie einen Tetrazol-Ring.
Candesartan wurde 1990 von Takeda Pharmaceutical in Japan patentiert und wurde dann auch durch US-Patent und Europäisches Patent geschützt.[5][6] Candesartan kam 1997 in Deutschland auf den Markt.[7] Pharmazeutisch eingesetzt wird es in Form des Prodrugs Candesartancilexetil.
Geschichte und Herstellung
[Bearbeiten | Quelltext bearbeiten]Über die Herstellung und die Eigenschaften der chemischen Verbindung wurde 1993 im Journal of Medicinal Chemistry berichtet.[8] Vorbild für die Entwicklung von Candesartan war der AT1-Antagonist Losartan, ein Imidazol-Derivat. Dieses enthält – abgesehen von den Substituenten am Imidazol-Ring – ebenfalls einen mit einer Biphenyl(methyl)-Gruppe verknüpften Tetrazol-Ring.

|

|

|
| Losartan (Vorbild) | Candesartan | Candesartancilexetil (Prodrug) |
Als Ausgangsstoffe für die mehrstufige chemische Synthese dienten der Ethylester der 2-Methoxybenzoesäure – ein Derivat der Salicylsäure – sowie 3-Nitrophthalsäure (Formelschema).[9][10][11]
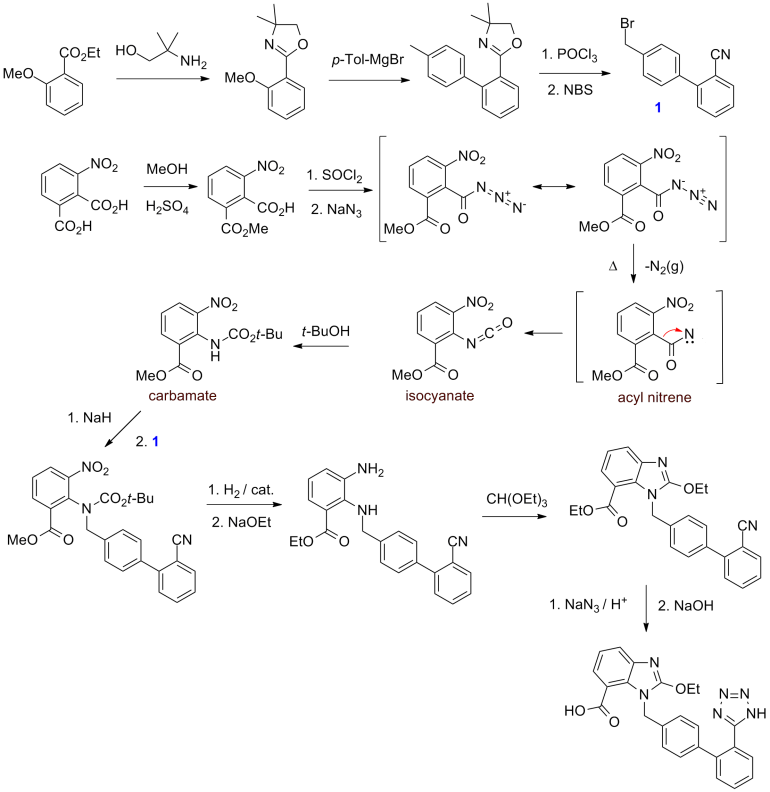
Der Biphenyl-Baustein (1) wurde durch Umsetzung der Grignard-Verbindung aus 4-Methylbrombenzol (p-Tolylmagnesiumbromid, „p-Tol-MgBr“) mit einem Derivat der 2-Methoxybenzoesäure gewonnen. Ein zweiter molekularer Baustein, das Carbamat, wurde aus 3-Nitrophthalsäure synthetisiert. Das mittels Natriumhydrid erzeugte Carbamat-Anion wurde mit dem Biphenyl-Baustein durch eine nukleophile Substitutionsreaktion verknüpft. Entscheidend für die Realisierung dieser Synthese war die Verwendung von Schutzgruppen. In der letzten Stufe der Synthese wurde aus dem Nitril mit Stickstoffwasserstoffsäure der Tetrazol-Ring erzeugt und schließlich die Carbonsäure durch Verseifung und Ansäuern gewonnen.
Pharmazeutisch verwendet wird der Carbonsäureester Candesartancilexetil (synonym: Candesartanhexetil). Zur Synthese dieses Esters im Labormaßstab wurde geschütztes (Trityl-Schutzgruppe) Candesartan mit Cyclohexyl-1-iodoethylcarbonat – ein Racemat – umgesetzt. Folglich erhielt man Candesartancilexetil ebenfalls als Racemat. Die kristalline Substanz tritt in verschiedenen Kristallformen auf (Polymorphie).[12][13]
Eine neuere Synthese erzwingt den Ringschluss zum Benzimidazol durch eine intramolekulare Arylierung. In der Mitteilung darüber diskutieren die Autoren weitere Methoden zur Synthese von Candesartancilexetil.[14]
Candesartancilexetil
[Bearbeiten | Quelltext bearbeiten]
Pharmazeutisch eingesetzt wird Candesartan in Form eines sogenannten Resorptionsesters, dem Candesartancilexetil (systematischer Name: (±)-1-Hydroxyethyl-2-ethoxy-1-[p-(o-1H-tetrazol-5-ylphenyl)benzyl]-7-benzimidazolcarboxylat). Es fungiert als Prodrug, das im Körper beim Durchtritt durch die Schleimhaut des Dünndarms durch Carboxyesterasen gespalten wird. Anschließend kommt es zu einem spontanen Kohlendioxidverlust und unter Freisetzung von Acetaldehyd zur Bildung der freien Säure Candesartan.[15][16] Es wird angenommen, dass das Spaltprodukt Cyclohexanol weiter zu 1,2-Cyclohexandiol-Isomeren verstoffwechselt wird, unter denen trans-1,2-Cyclohexandiol als der wichtigste Metabolit beim Menschen gilt.[17] Acetaldehyd wird in der Leber mittels Acetaldehyddehydrogenase in Essigsäure umgewandelt.[16]
Candesartancilexetil ist ein weißes bis fast weißes Pulver.[18] Die Substanz ist praktisch unlöslich in Wasser und wenig löslich in Methanol.[2] Der Schmelzpunkt beträgt 163 °C.[2]
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]Die Wirkung von Candesartan beruht auf einer nicht-kompetitiven Hemmung des AT1-Rezeptors.
Die Bioverfügbarkeit beträgt 14 % (nach Gabe von Candesartancilexetil-Tabletten) bis 40 % (nach oraler Gabe einer Candesartancilexetil-Lösung) und die Plasmahalbwertszeit ca. 9 Stunden. Candesartan wird biliär zu 67 % sowie renal zu 33 % ausgeschieden. Die Ausscheidung erfolgt überwiegend unverändert. Zudem wird es in geringerem Umfang in der Leber durch das Enzym CYP2C9 metabolisiert.
Klinische Angaben
[Bearbeiten | Quelltext bearbeiten]Anwendungsgebiete
[Bearbeiten | Quelltext bearbeiten]Candesartan ist für folgende Anwendungsgebiete zugelassen:
- Behandlung von Bluthochdruck (arterielle Hypertonie) bei Erwachsenen und Kindern ab 6 Jahren[19]
- Behandlung von Herzinsuffizienz mit eingeschränkter linksventrikulärer systolischer Funktion (linksventrikuläre Ejektionsfraktion ≤ 40 %), wenn ACE-Hemmer nicht vertragen werden[19]
Die Behandlung mit Candesartan zusätzlich zu einem ACE-Hemmer ist laut Zulassung zwar ebenfalls möglich, sofern Mineralokortikoidrezeptor-Antagonisten nicht vertragen werden.[19] Jedoch wird die additive Gabe von AT1-Antagonisten wie Candesartan zusätzlich zu ACE-Hemmern durch aktuelle Leitlinien nicht mehr empfohlen.[20]
Die Dosierungen reichen von 4 mg bis 32 mg Candesartancilexetil. Im Handel sind Tabletten mit 4, 8, 16 und 32 mg.
Unerwünschte Wirkungen
[Bearbeiten | Quelltext bearbeiten]Zu den häufig auftretenden Nebenwirkungen zählen Schwindel, Kopfschmerzen, Atemwegsinfektionen, Hypotonie (zu niedriger Blutdruck), Nierenfunktionsstörungen sowie erhöhte Kaliumwerte im Blut.[21][22]
Nitrosamin-Risiko
[Bearbeiten | Quelltext bearbeiten]Candesartan besitzt in seiner chemischen Struktur einen Tetrazol-Ring und gehört damit zu jenen Sartanen, die potentiell durch Nitrosamin-Verunreinigungen betroffen sein können („Valsartan-Skandal“). Anfang Juli 2018 wurden Chargen gewisser Sartane, darunter neben Valsartan und anderen auch Candesartan, zurückgerufen, weil der Verdacht bestand, dass sie durch krebserregende Dialkylnitrosamine, u. a N-Nitrosodimethylamin (NDMA), verunreinigt waren. Die Rückrufaktion löste international ein erhebliches Medienecho aus und führte zum Teil zum ersatzlosen Absetzen der Medikamente.[23]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Monopräparate: Atacand (protect) (D, A, CH), Blopress, Blopresid (D, A, CH), Pemzek (CH), Amias, diverse Generika
- mit Hydrochlorothiazid: Atacand plus (D, A, CH), Blopress plus (D, A, CH), Pemzek plus (CH), diverse Generika
Umweltrelevanz
[Bearbeiten | Quelltext bearbeiten]Wie mehrere andere Sartane zersetzt sich Candesartan unter Bildung der sehr persistenten und sehr mobilen Valsartansäure. Sie stellt ein Problem für die Trinkwassergewinnung dar, da sie sich bei der konventionelle Abwasserbehandlung nicht zersetzt und sich so in Gewässern und im Grundwasser bis zum Gesundheitlichen Orientierungswert (GOW im Trinkwasser = 0,3 μg/L) anreichert. Selbst bei einer Behandlung mittels der sogenannten vierten Reinigungsstufe werden bei Ozonverfahren nur bis zu 39 und mittels Aktivkohle bis zu 43 % eliminiert.[24] Candesartan ist eine der Leitchemikalien der Schweizer Kontrollliste für die Einschätzung der Klärleistung in der vierten Reinigungsstufe.[25]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Europäisches Arzneibuch. 10. Ausgabe. Grundwerk 2020, Band 3. Deutscher Apotheker Verlag, S. 3111.
- Holger Projahn, Jörg Peters: Candesartancilexetil. In: Wolfgang Blaschek et al. (Hrsg.): Hagers Enzyklopädie der Arzneistoffe und Drogen. 6. Auflage. Band 3. S. 655–660, Wissenschaftliche Verlagsgesellschaft, Stuttgart 2007, ISBN 978-3-8047-2384-9.
- Axel Kleemann, Jürgen Engel, Bernhard Kutscher, Dietmar Reichert: Pharmaceutical Substances. 5. Auflage. Thieme, Stuttgart / New York 2009, ISBN 978-3-13-558405-8, S. 212–214.
- Janos Fischer, C. Robin Ganellin (Hrsg.): Analogue-Based Drug Discovery. Wiley-VCH, Weinheim 2006, ISBN 3-527-31257-9, S. 471.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ INN Recommended List 35. World Health Organisation (WHO), 9. September 1995.
- ↑ a b c The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station NJ 2006, ISBN 0-911910-00-X, S. 281.
- ↑ a b Registrierungsdossier zu 2-ethoxy-1-{[2'-(1H-tetrazol-5-yl)biphenyl-4-yl]methyl}-1H-benzimidazole-7-carboxylic acid (Abschnitt GHS) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 28. Dezember 2019.
- ↑ Yakuri to Chiryo. In: Pharmacology and Therapeutics, 24 (Suppl.)
- ↑ US-Patent 5196444, Erfinder: Takehiko Naka, Kohei Nishikawa, Takeshi Higashiosaka: 1-(Cyclohexyloxycarbonyloxy)ethyl 2-ethoxy-1-[[2'-(1H-tetrazol-5-yl)biphenyl-4-yl]methyl]benzimidazole-7-carboxylate and compositions and methods of pharmaceutical use thereof.
- ↑ Europäisches Patent EP0459136.
- ↑ Janos Fischer, C. Robin Ganellin (Hrsg.): Analogue-Based Drug Discovery. Wiley-VCH, 2006, S. 471.
- ↑ Keiji Kubo, Yasuhisa Kohara, Eiko Imamiya, Yoshihiro Sugiura, Yoshiyuki Inada, Yoshiyasu Furukawa, Kohei Nishikawa, Takehiko Naka: Nonpeptide angiotensin II receptor antagonists. Synthesis and biological activity of benzimidazolecarboxylic acids. In: Journal of Medicinal Chemistry, 1993, Band 36, Heft 15, S. 2182–2195.
- ↑ US-Patent 5196444, Erfinder: Takehiko Naka, Kohei Nishikawa, Takeshi Higashiosaka: 1-(Cyclohexyloxycarbonyloxy)ethyl 2-ethoxy-1-[[2'-(1H-tetrazol-5-yl)biphenyl-4-yl]methyl]benzimidazole-7-carboxylate and compositions and methods of pharmaceutical use thereof.
- ↑ Europäisches Patent EP0459136.
- ↑ Keiji Kubo, Yasuhisa Kohara, Eiko Imamiya, Yoshihiro Sugiura, Yoshiyuki Inada, Yoshiyasu Furukawa, Kohei Nishikawa, Takehiko Naka: Nonpeptide angiotensin II receptor antagonists. Synthesis and biological activity of benzimidazolecarboxylic acids. In: Journal of Medicinal Chemistry, 1993, Band 36, Heft 15, S. 2182–2195.
- ↑ US-Patent 5196444, Erfinder: Takehiko Naka, Kohei Nishikawa, Takeshi Higashiosaka: 1-(Cyclohexyloxycarbonyloxy)ethyl 2-ethoxy-1-[[2'-(1H-tetrazol-5-yl)biphenyl-4-yl]methyl]benzimidazole-7-carboxylate and compositions and methods of pharmaceutical use thereof.
- ↑ Jaroslav Havlíčeka, Zuzana Mandelováa, Ruediger Weisemannb, Ivo Střeleca, Lukáš Plačeka, Stanislav Rádla: Identification, synthesis and structural determination of some impurities of candesartan cilexetil. In: Collect. Czech. Chem. Commun., 2009, Band 74, S. 347–362; doi:10.1135/cccc2008072
- ↑ Ping Wang, Guo-jun Zheng, Ya-ping Wang, Xiang-jing Wang, Yan Li, Wen-sheng Xiang: A novel and practical synthesis of substituted 2-ethoxy benzimidazole: candesartan cilexetil. In: Tetrahedron, 2010, Band 66, Heft 29, S. 5402–5406; doi:10.1016/j.tet.2010.05.037
- ↑ Y. Hamada: Recent progress in prodrug design strategies based on generally applicable modifications. In: Bioorganic & Medicinal Chemistry Letters. 2017, Band 27, Nummer 8, S. 1627–1632. doi:10.1016/j.bmcl.2017.02.075.
- ↑ a b Murugaiah A. M. Subbaiah, Thangeswaran Ramar, Lakshumanan Subramani, Salil D. Desai, Sarmistha Sinha, Sandhya Mandlekar, Susan Jenkins, Mark Krystal, Murali Subramanian, Srikanth Sridhar, Shweta Padmanabhan, Priyadeep Bhutani, Rambabu Arla, John F. Kadow, Nicholas A. Meanwell: (Carbonyl)oxyalkyl linker-based amino acid prodrugs of the HIV-1 protease inhibitor atazanavir that enhance oral bioavailability and plasma trough concentration. In: European Journal of Medicinal Chemistry. 2020, Band 207, S. 112749. doi:10.1016/j.ejmech.2020.112749.
- ↑ Public Assessment Report / Scientific discussion Candesartan/Hydrochlorthiazid Actavis Tablets 8+12.5mg & 16+12.5mg Candesartan cilexetil and hydroclorthiazid. Bundesamt für Sicherheit im Gesundheitswesen, Februar 2014.
- ↑ Prescribing Information Atacand. (PDF; 209 kB) FDA, 22. Oktober 2009.
- ↑ a b c Fachinformation Candesartan-AbZ. AbZ Pharma, Mai 2021, abgerufen am 25. April 2022.
- ↑ Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF): Nationale VersorgungsLeitlinie Chronische Herzinsuffizienz – Langfassung, 3. Auflage. Version 3. 2019, S. 57 (awmf.org [abgerufen am 25. April 2022]).
- ↑ Candesartan AbZ – Anwendung, Nebenwirkungen, Wechselwirkungen. In: apotheken-umschau.de. 9. November 2015, abgerufen am 4. Februar 2020.
- ↑ Candesartan. Cora Health; abgerufen am 4. Februar 2020.
- ↑ Veronika Schlimpert: Die dramatische Kehrseite des Valsartan-Skandals. kardiologie.org, 3. März 2020; abgerufen am 20. März 2022.
- ↑ Umweltbundesamt – Kurzdossier Spurenstoffe von Valsartansäure, Seite 1 ,3 und 4, Stand Januar 2023, abgerufen am 7. Juli 2024
- ↑ Die Publikationsplattform des Bundesrechts - Verordnung des UVEK zur Überprüfung des Reinigungseffekts von Massnahmen zur Elimination von organischen Spurenstoffen bei Abwasserreinigungsanlagen, Stand 1. Dezember 2016, abgerufen am 21. Juli 2024
