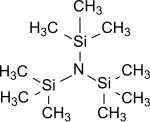
Tris(trimethylsilyl)amin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tris(trimethylsilyl)amin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C9H27NSi3 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 233,57 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
leicht löslich in unpolaren organischen Lösungsmitteln, wie z. B. Benzol, Tetrachlormethan, Diethylether, 1,4-Dioxan, Petrolether[4] oder Tetrahydrofuran[6] | |||||||||||||||
| Brechungsindex |
1,4545 (20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Tris(trimethylsilyl)amin ist der einfachste Vertreter von Tris(trialkylsilyl)aminen der allgemeinen Formel (R3Si)3N, in dem alle drei Wasserstoffatome des Ammoniaks durch Trimethylsilylgruppen (-Si(CH3)3) ersetzt sind.[4] Tris(trimethylsilyl)amin steht als stabile Zwischenstufe bei der chemischen Stickstofffixierung, d. h. der Einführung von atmosphärischem Stickstoff N2 in organische Substrate unter Normalbedingungen, seit Jahren im Zentrum großen wissenschaftlichen Interesses.[7][8][9]
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Frühe Versuche der Darstellung von Tris(trimethylsilyl)amin aus den Ausgangsverbindungen Ammoniak und Trimethylchlorsilan (TMS-Cl) verliefen auch bei Temperaturen von 500 °C und in Gegenwart der Base Pyridin ergebnislos.[10][11] Die Reaktion von Ammoniak und Trimethylchlorsilan bleibt auf der Stufe des zweifach silylierten Produkts Bis(trimethylsilyl)amin, meist als Hexamethyldisilazan (HMDS) bezeichnet, stehen.

Nonamethyltrisilazan entsteht bei der Reaktion des Natriumsalzes von Hexamethyldisilazan – aus HMDS und Natriumamid[3] bzw. aus mit HMDS, Natrium und Styrol[4] – mit Trimethylchlorsilan in 80%iger Ausbeute.[12]
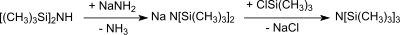
Das Lithiumsalz von HMDS – aus HMDS und n-Butyllithium[5] bzw. aus HMDS und Phenyllithium[12] – reagiert lediglich in Ausbeuten von 50–60 % mit Trimethylchlorsilan zu Tris(trimethylsilyl)amin.
Als Eintopfreaktion mit 72%iger Ausbeute kann die Umsetzung von Lithiumnitrid mit Trimethylchlorsilan in THF ausgeführt werden.[6]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Tris(trimethylsilyl)amin ist ein farbloser, kristalliner[1][2] bzw. wachsartiger[3] Feststoff, der stabil ist gegen Wasser und Alkalien[13], sich aber durch Einwirkung von Alkoholen oder Säuren unter Spaltung der Si-N-Bindung und Bildung von Ammoniak zersetzt.[3]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Tris(trimethylsilyl)amin als Synthesebaustein
[Bearbeiten | Quelltext bearbeiten]Aus Antimontrichlorid und Tris(trimethylsilyl)amin entsteht bei −60 °C fast quantitativ ein Nitridoantimon-Komplex mit Heterocubanstruktur.[14]
Ketone können in Gegenwart von P4-t-Bu und Nonamethyltrisilazan unter milden Bedingungen in Ausbeuten bis 84 % mit dem sehr reaktionsträgen Fluoroform (HCF3, HFC-23) trifluormethyliert werden.[15]
Aus Tris(trimethylsilyl)amin und Phosphorpentachlorid in Hexan entsteht bei 0 °C das Monomer Trichlor(trimethylsilyl)-phosphoranimin Cl3P=NSiMe3,

das zu linearen Polydichlorphosphazenen mit definierten Molmassen und Polydispersitäten polymerisiert werden kann.[16]
In siedendem Dichlormethan (ca. 40 °C) wird aus Tris(trimethylsilyl)amin und Phosphorpentachlorid neben anderen Oligomeren vorwiegend (zu 76 %) das cyclische Trimer (NPCl2)3 Hexachlorcyclotriphosphan gebildet, aus dem bei Erhitzen auf über 250 °C hochmolekulare, aber wenig definierte Polydichlorphosphazene erhalten werden.
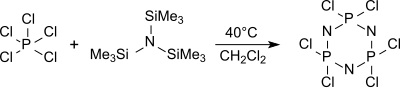
Stickstofftrifluorid NF3, das u. a. zum Plasmaätzen von Siliciumwafern Verwendung findet, ist aus Tris(trimethylsilyl)amin und Fluorgas bei −40 °C in Acetonitril zugänglich, wobei die Bildung von Stickstoff N2 und Tetrafluorhydrazin N2F4, die bei der Standardsynthese aus Ammoniak oder Ammoniumfluorid als unerwünschte Nebenprodukte anfallen, unterdrückt wird.[17]

Tris(trimethylsilyl)amin als Zwischenstufe der chemischen Stickstofffixierung
[Bearbeiten | Quelltext bearbeiten]Die technische Stickstofffixierung wurde durch das Haber-Bosch-Verfahren realisiert, bei dem Stickstoff in Gegenwart von Eisen-Katalysatoren unter hohen Drücken (>150 bar) und Temperaturen (>400 °C) durch reduktive Protonierung in Ammoniak überführt wird.
Bei der chemischen Stickstofffixierung, d. h. der Umwandlung von atmosphärischem Stickstoff unter Normalbedingungen in reaktive Ausgangsstoffe für chemische Synthesen – meist ebenfalls Ammoniak – spielt Tris(trimethylsilyl)amin bei der so genannten reduktiven Silylierung eine wichtige Rolle, da es mit Wasser glatt zu Ammoniak hydrolysiert wird.

Bereits 1895 wurde beobachtet, dass metallisches Lithium schon bei Raumtemperatur mit Stickstoff zum Lithiumnitrid reagiert.[18] 1972 beobachtete K. Shiina, dass Lithium (als Elektronendonor) in Gegenwart von Chrom(III)-chlorid als Katalysator bei Raumtemperatur mit dem zur Inertisierung eingesetzten Stickstoff unter Dunkelfärbung mit Trimethylsilylchlorid in geringen Mengen Tris(trimethylsilyl)amin bildet.[7]

In neuerer Zeit wurde für die reduktive Silylierung von N2 zur Stickstofffixierung unter Normalbedingungen statt Lithium bevorzugt Natrium als Elektronendonor, sowie Molybdän-[19] und Eisenverbindungen[8], wie z. B. Pentacarbonyleisen oder Ferrocene als Katalysatoren eingesetzt,[20] wobei bis zu 34 Äquivalente N(Me3Si)3 pro Eisenatom im Katalysator erhalten wurden.

Mit einem Molybdän-Ferrocen-Komplex als Katalysator konnte eine katalytische Produktivität (engl. turnover number, TON) von bis zu 226 erzielt werden.[21]

Die katalytische Produktivität der bisher entwickelten Katalysatoren für die chemische Stickstofffixierung ist trotz intensiver Forschungen[22] noch um Größenordnungen geringer als z. B. die moderner Polymerisationskatalysatoren vom Metallocen-Typ oder Enzyme.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Tris(trimethylsilyl)amine 98% bei Sigma-Aldrich, abgerufen am 28. Dezember 2016 (PDF).
- ↑ a b Datenblatt Nonamethyltrisilazane bei Alfa Aesar, abgerufen am 28. Dezember 2016 (Seite nicht mehr abrufbar).
- ↑ a b c d e C.R. Krüger, H. Niederprüm, M. Schmidt, O. Scherer: Sodium Bis(trimethylsilyl)amide and Tris(trimethylsilyl)amine, in Inorganic Syntheses. Hrsg.: H.F. Holtzlow. Band 8. John Wiley & Sons, Inc., Hoboken, NJ, USA 1966, ISBN 978-0-470-13167-1, S. 15–19, doi:10.1002/9780470132395.ch5.
- ↑ a b c d e f J. Goubeau, J. Jiminéz-Barberá: Tris-(trimethylsilyl)-amin. In: ZAAC. Band 303, Nr. 5–6, 1960, S. 217–226, doi:10.1002/zaac.19603030502.
- ↑ a b E.H. Amonoo-Neizer, R.A. Shaw, D.O. Skovlin, B.C. Smith, J.W. Rosenthal, W.L. Jolly: Lithium Bis(trimethylsilyl)amide and Tris(trimethylsilyl)amine, in Inorganic Syntheses. Hrsg.: H.F. Holtzlow. Band 8. John Wiley & Sons, Inc., Hoboken, NJ, USA 1966, ISBN 978-0-470-13167-1, S. 19–22, doi:10.1002/9780470132395.ch5.
- ↑ a b W.L. Lehn: Preparation of tris(trimethylsilyl)- and tris(trimethylstannyl)amines. In: J. Am. Chem. Soc. Band 86, Nr. 2, 1964, S. 305, doi:10.1021/ja01056a057.
- ↑ a b K. Shiina: Reductive silylation of molecular nitrogen via fixation to tris(trimethylsilyl)amine. In: J. Am. Chem. Soc. Band 94, Nr. 26, 1972, S. 9266–9267, doi:10.1021/ja00781a068.
- ↑ a b K.C. MacLeod, P.L. Holland: Recent developments in the homogeneous reduction of dinitrogen by molybdenum and iron. In: Nature Chemistry. Band 5, 2013, S. 559–565, doi:10.1038/nchem.1620.
- ↑ W.I. Dzik: Silylation of dinitrogen catalyzed by hydridodinitrogen(triphenylphosphine) cobalt (I). In: Inorganics. Band 4, Nr. 3, 2016, S. 21, doi:10.3390/inorganics4030021.
- ↑ R.O. Sauer: Derivatives of the methylchlorosilanes. I. Trimethylsilanol and its simple ethers. In: J. Am. Chem. Soc. Band 66, Nr. 10, 1944, S. 1707–1710, doi:10.1021/ja01238a030.
- ↑ R.O. Sauer, R.H. Hasek: Derivatives of the methylchlorosilanes. IV. Amines. In: J. Am. Chem. Soc. Band 68, Nr. 2, 1946, S. 241–244, doi:10.1021/ja01206a028.
- ↑ a b U. Wannagat, H. Niederprüm: Beiträge zur Chemie der Silicium-Stickstoff-Verbindungen, XIII. Silylsubstituierte Alkaliamide. In: Chem. Ber. Band 94, Nr. 6, 1961, S. 1540–1547, doi:10.1002/cber.19610940618.
- ↑ U. Wannagat, H. Niederprüm: dreifach silylierte Amine. In: ZAAC. Band 308, Nr. 1–6, 1961, S. 337–351, doi:10.1002/zaac.19613080135.
- ↑ M. Rhiel, F. Weller, J. Pebler, K. Dehnicke: [SbN(SbCl)3(NSbCl2)(NSiMe3)3 · SbCl3], ein ungewöhnlicher Nitridoantimonkomplex mit Heterocubanstruktur. In: Angew. Chem. Band 106, Nr. 5, 1994, S. 599–600, doi:10.1002/ange.19941060519.
- ↑ S. Okusu, K. Hirano, E. Tokunaga, N. Shibata: Organocatalyzed trifluormethylation of ketones and sulfonyl fluorides by fluoroform under a superbase system. In: ChemistryOpen. Band 4, 2015, S. 581–585, doi:10.1002/open.201500160.
- ↑ Patent US5698664: Synthesis of polyphosphazenes with controlled molecular weight and polydispersity. Angemeldet am 26. April 1995, veröffentlicht am 16. Dezember 1997, Anmelder: The Penn State Research Foundation, University of Toronto, Erfinder: H.R. Allcock, C.T. Morrissey, I. Manners, C.H. Honeyman.
- ↑ Patent US8163262B1: Method for production of nitrogen fluoride from trimethylsilylamines. Angemeldet am 4. Januar 2011, veröffentlicht am 24. April 2012, Erfinder: B. A. Omotowa.
- ↑ H. Deslandres: Absorption de l’azote par le lithium à froid. In: Comptes rendus. Band 121, 1895, S. 886–887 (bnf.fr).
- ↑ Q. Liao, N. Saffon-Merceron, N. Mézailles: N2 reduction into silylamine at tridentate phosphine/Mo center: catalysis and mechanistic study. In: ACS Catal. Band 5, Nr. 11, 2015, S. 6902–6906, doi:10.1021/acscatal.5b01626.
- ↑ M. Yuki, H. Tanaka, K. Sasaki, Y. Miyake, K. Yoshizawa, Y. Nishibayashi: Iron-catalyzed transformation of molecular dinitrogen into silylamine under ambient conditions. In: Nature Commun. Band 3, 2012, S. 1254, doi:10.1038/ncomms2264.
- ↑ H. Tanaka et al.: Molybdenum-Catalyzed Transformation of Molecular Dinitrogen into Silylamine: Experimental and DFT Study on the Remarkable Role of Ferrocenyldiphosphine Ligands. In: J. Am. Chem. Soc. Band 133, Nr. 10, 2011, S. 3498–3506, doi:10.1021/ja109181n.
- ↑ Y. Nishibayashi: Recent progress in transition-metal-catalyzed reduction of molecular dinitrogen under ambient reaction conditions. In: Inorg. Chem. Band 54, Nr. 19, 2015, S. 9234–9247, doi:10.1021/acs.inorgchem.5b00881.
