Carcharhinus obscurus
| Tiburón arenero o Jaquetón lobo | ||
|---|---|---|
 Piscina de tiburones grises nadando sobre la arena y algunas rocas dispersas. | ||
| Estado de conservación | ||
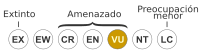 Vulnerable (UICN 3.1)[1] | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Clase: | Chondrichthyes | |
| Subclase: | Elasmobranchii | |
| Orden: | Carcharhiniformes | |
| Familia: | Carcharhinidae | |
| Género: | Carcharhinus | |
| Especie: |
C. obscurus (Lesueur, 1818) | |
| Distribución | ||
![Registro de tiburones areneros confirmado (azul oscuro) y supuesto (azul claro)[2]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/08/Carcharhinus_obscurus_distmap.png/250px-Carcharhinus_obscurus_distmap.png) Registro de tiburones areneros confirmado (azul oscuro) y supuesto (azul claro)[2] | ||
| Sinonimia | ||
Carcharhinus iranzae Fourmanoir, 1961 *sinónimo ambiguo | ||
El jaquetón lobo o tiburón arenero (Carcharhinus obscurus) es una especie de la familia de los carcarrínidos (Carcharhinidae) y suelen encontrarse en aguas cálidas y tropicales de los océanos continentales de todo el mundo. Es una especie generalista y un superpredador. El tiburón arenero se puede encontrar desde la costa hasta la plataforma continental y las aguas pelágicas adyacentes de hasta 400 m de profundidad. Estos tiburones migran estacionalmente hacia los polos en verano y hacia el ecuador en invierno, recorriendo así de cientos a miles de kilómetros. Además, el tiburón arenero es uno de los más grandes de su familia, llegando a medir 4,2 metros de longitud y 347 kg de peso. Su cuerpo es delgado y ágil y puede ser fácilmente identificado gracias a su hocico redondeado y corto, aletas pectorales largas en forma de hoz, cresta entre la primera y la segunda aleta dorsal y aletas ligeramente marcadas.
Los tiburones areneros adultos tienen una dieta amplia y variada que consiste principalmente en peces óseos, elasmobranquios y cefalópodos, pero también comen ocasionalmente crustáceos, estrellas de mar, briozoos, tortugas marinas, mamíferos marinos, carroña y basura. Es una especie vivípara con un ciclo reproductivo de tres años; las hembras dan a luz camadas de entre 3 y 14 crías después de un período de gestación de 22 a 24 meses, después del cual hay un año de descanso antes de quedar embarazadas de nuevo. Las hembras son capaces de almacenar semen durante largos períodos, ya que los encuentros con los machos adecuados pueden ser pocos debido a su estilo de vida nómada y la poca abundancia de estos. Los tiburones areneros son unos de los tiburones de crecimiento más lento y los últimos en desarrollarse, por lo que no llegan a la adultez hasta los 20 años de edad.
Debido a su lenta tasa reproductiva, la especie del jaquetón lobo o tiburón arenero es propensa a disminuir a causa de la acción humana. Este tipo de tiburón es muy apreciado en la pesca comercial por sus aletas, que son las que se usan para hacer sopa de aleta de tiburón, y por su carne, su piel y por el aceite del hígado. Los pescadores deportivos también valoran a esta especie; la Unión Internacional para la Conservación de la Naturaleza ha evaluado esta especie como casi amenazada a nivel mundial y vulnerable en la región oriental de Estados Unidos, donde el número de este tipo de tiburón ha descendido entre un 15 y un 20% respecto a los niveles de 1970. El tiburón arenero es considerado como potencialmente peligroso para los humanos debido a su gran tamaño, sin embargo, se le han atribuido pocos ataques.[2]
Taxonomía
[editar]

El naturalista francés Charles-Alexandre Lesueur publicó la primera descripción científica del tiburón arenero en una edición de 1818 de la revista Journal of the Academy of Natural Sciences of Philadelphia. Lo colocó en el género Squalus y le dio el nombre específico obscurus (del latín, "oscuro" o "débil"), refiriéndose a su coloración.[3][4] Posteriores autores han reconocido a esta especie como perteneciente al género Carcharhinus. Lesueur no le designó un tipo nomenclatural, aunque se supone que hizo el trabajo a partir de un tiburón capturado en aguas norteamericanas.[5]
Muchas fuentes antiguas le dieron al tiburón arenero el nombre científico de Carcharias (más tarde Carcharhinus) lamiella, que se originó de un informe de 1882 por David Starr Jordan y Charles Henry Gilbert. Aunque Jordan y Gilbert estudiaban una mandíbula que pertenecía a un tiburón arenero, más tarde se descubrió que el tipo nomenclatural que le designaron era en realidad el de un tiburón cobrizo (Carcharhinus brachyurus). Por lo tanto, Carcharhinus lamiella no se considera un sinónimo de C. obscurus, sino más bien de C. brachyurus.[6][4]
Filogenia y evolución
[editar]
| |||||||||||||||||||||||||||||||||||||||
|
Relación filogenética del tiburón arenero, basada en secuencias de alozima.[7] |
Los dientes del tiburón arenero están bastante bien representados en los fósiles, aunque asignar los dientes del género de los Carcharhinus a la especie puede ser un problema.[8] Los dientes del tiburón arenero de la época Mioceno (23-5,3 Ma) se han recuperado gracias a las formaciones de Kendeace y Grand Bay en Carriacou, las Granadinas,[9] la formación de Moghra en Egipto,[10] el Condado de Polk (Florida)[11] y posiblemente en el Cerro de La Cruz en el norte de Venezuela.[12] Los dientes de la época del Mioceno Superior o Zancliense (11.6-3,6 Ma) abundan en la formación de Yorktown y en el Río Pungo, en el norte de Carolina y en la región de la Bahía de Chesapeake. Estos dientes difieren un poco de los dientes de los tiburones areneros actuales y a menudo se han confundido con los que tiene el tiburón oceánico (Carcharhinus longimanus).[8] También se han recuperado de los alrededores de dos ballenas barbadas en el norte de Carolina, un protegido en Goose Creek Limestone de la época del Piacenziense (aprox. 3,5 Ma) y el otro entre el barro de la época del Pleistoceno-Holoceno (hace 12.000 años aprox.).[13]
En 1982, Jack Garrich publicó un análisis filogenético del género de los Carcarhinus basado en la morfología. En él situó al tiburón arenero y al tiburón galápago en el centro del “grupo obscurus”. El grupo consistía en grandes tiburones con dientes triangulares con una cresta entre las aletas dorsales. Además, también incluye al Carcharhinus altimus, el tiburón del arrecife del Caribe (Carcharhinus perezi), el tiburón gris (Carcharhinus plumbeus) y el tiburón oceánico.[14] Esta interpretación fue defendida en gran parte por Leonard Compagno en su fenético estudio de 1988,[15] y por Gavin Naylor en su estudio de secuencias de alozima en 1992. Naylor fue capaz de resolver más interrelaciones de los tiburones que tienen la cresta detrás del género de los Carcharhinus. Y encontró que el tiburón arenero, el tiburón galápago, el tiburón oceánico y el tiburón azul (Prionace glauca) forman la mayoría de sus clados derivados.[7]
Distribución y hábitat
[editar]
Los tiburones areneros se encuentran por todo el mundo, aunque de manera discontinua, en las aguas tropicales y cálidas. En la parte occidental del océano Atlántico, habitan en Massachusetts y en el banco Georges en el sur de Brasil, incluyendo las Bahamas y Cuba. En el este del océano Atlántico se encuentran en el oeste del mar Mediterráneo, las Islas Canarias, Cabo Verde, Senegal, Sierra Leona y posiblemente en otras partes incluyendo Portugal, España, Marruecos y Madeira. En el océano Índico, se hallan en Sudáfrica, Mozambique y Madagascar, en el mar Arábigo (aunque en menor medida), en la bahía de Bengala y quizás en el mar Rojo. En el océano Pacífico, se encuentran en Japón, China y Taiwán, Vietnam, Australia y el oeste de la Nueva Caledonia y desde el sur de California hasta el golfo, alrededor de Revillagigedo y posiblemente en la parte nordeste de Chile. La aparición de tiburones areneros del este y nordeste del centro del Atlántico y alrededor de las islas tropicales puede deberse, en realidad, por los tiburones galápagos.[1][2] El genoma mitocondrial (también llamado ADN mitocondrial) y las pruebas de los microsatélites sugieren que los tiburones de Indonesia y Australia representan poblaciones distintas.[16]
Los que habitan el litoral desde la zona de olas hasta el exterior de la plataforma continental y las aguas contiguas al oceánico, se encuentra en un hábitat intermedio que se traslapa con sus parientes más especializados, como el tiburón gris de la costa, el pelágico tiburón sedoso (Carcharhinus falciformis) y el tiburón oceánico, el tiburón Carcharhinus altimus, el tiburón galápago, y el tiburón de puntas blancas (Carcharhinus albimarginatus).[17] Un estudio de seguimiento en el norte del golfo de México demostró que pasa la mayoría de su tiempo en las profundidades de 10 a 80 m, mientras que de manera esporádica hace incursiones por debajo de los 200 m. Esta especie se conoce por bucear a una profundidad de 400 m. Además, prefiere aguas con temperaturas de 19 a 28 °C y evitar áreas de baja salinidad como los estuarios.[18][19]
El tiburón arenero es nómada y altamente migratorio, llegando a registrar un recorrido de 3.800 km de distancia. Por lo general, los adultos recorren distancias más largas que los jóvenes. Los tiburones que habitan a lo largo de ambas costas de América del Norte migran hacia el norte cuando suben las temperaturas en verano y se retiran hacia el ecuador en invierno.[1] En Sudáfrica, las hembras y los machos jóvenes que miden unos 0,9 m de largo, se dispersan hacia Norte y Sur respectivamente (con algunas coincidencias) a partir de su zona de cría a cierta distancia de KwaZulu-Natal; más tarde, se unen a los adultos mediante una ruta aún no identificada. Además, los jóvenes pasan la primavera y el verano en la zona de olas, y el otoño y el invierno en alta mar; y cuando alcanzan los 2,2 m de longitud migrarán de norte a sur entre KwaZulu-Natal en invierno y la Provincia Occidental del Cabo en verano. Los tiburones más grandes, los que miden más de 2,8 m de largo, migran hasta el sur de Mozambique.[1][5][20] En Australia Occidental, los adultos y jóvenes tiburones areneros migran hacia la costa en otoño y verano, mientras que los recién nacidos ocupan la zona de cría de la costa.[1]
Descripción
[editar]
El tiburón arenero, que a menudo alcanza una longitud de 3,2 m y un peso de 160 a 180 kg, es uno de los miembros más grandes de su género; su longitud y peso máximos registrados son 4,2 m y 347 kg respectivamente.[21][22] Las hembras son más grandes que los machos.[23] Este tiburón tiene un cuerpo esbelto e hidrodinámico y un hocico redondeado que en general no es superior a la anchura de la boca. Las fosas nasales están precedidas por unas aletas poco desarrolladas. Los ojos son medianos, de forma redondeada y cuentan con membranas nictitantes (tercer párpado protector). En las comisuras de la boca tiene unos cortos y finos surcos y tiene de 13 a 15 (generalmente 14) filas de dientes a cada lado de las dos mandíbulas. Los dientes superiores son particularmente anchos, triangulares y ligeramente oblicuos con bordes afilados y fuertes, mientras que los inferiores son más estrechos y con bordes más finos. Los cinco pares de hendiduras branquiales son bastante largas.[21]
Las grandes aletas pectorales miden alrededor de una quinta parte de la longitud total de su cuerpo, y tienen una forma curva en forma de hoz. La primera aleta dorsal es de un tamaño moderado y un tanto curvada, con un ápice puntiagudo y el margen posterior cóncavo. Se origina sobre la aleta pectoral sin puntas traseras. La segunda aleta dorsal es mucho más pequeña y está situada más o menos en frente de la aleta anal. Tiene una cresta dorsal inferior entre las dos aletas dorsales. La aleta caudal es grande y alta, con un lóbulo inferior bien desarrollado y un agujero ventral cerca de la punta del lóbulo superior.[24] Los dentículos dérmicos (escamas placoides) tienen forma de diamante y están dispuestos muy juntos, cada uno con cinco cadenas horizontales orientadas hacia los dientes en el margen posterior.[21] Esta especie es entre un color bronceado y gris azulado en la parte superior y blanco por la inferior, que se extiende hacia los costados como una fina raya apenas visible. Las aletas (las partes inferiores de las aletas pectorales y el lóbulo inferior de la aleta caudal en particular) se oscurecen hacia las puntas; lo cual es más evidente en los jóvenes.[25]
Biología y Ecología
[editar]Como superpredador se coloca en el nivel más alto de la cadena trófica. El tiburón arenero es, en general, menos abundante que otros tiburones que comparten su rango.[5] Sin embargo, se encuentran grandes concentraciones de individuos, principalmente alevines, en lugares determinados.[18] A menudo los adultos se hallan siguiendo a los buques lejos de tierra firme, como en la Corriente de las Agujas.[20] Un estudio de seguimiento en la Boca del Río Cape Fear en Carolina del Norte demostró que se desplaza a una velocidad media de 0,8 km/h.[26] El tiburón arenero es uno de los huéspedes de la rémora (Echeneis naucrated).[27] Entre los parásitos conocidos de esta especie se incluyen los cestodos Anthobothrium laciniatum,[28] Dasyrhynchus pacificus,[29] Platybothrium kirstenae,[30] Rhynchobothrium ingens,[31] Tentacularia coryphaenae,[32] y el Triloculatum triloculatum;[33] los monogéneos Dermophthirius carcharhini[34] y Loimos salpinggoides;[35] el hirudíneo Stibarobdella macrothela,[36] los copépodos Alebion sp., Pandarus cranchii,[37] P. sinuatus,[21] y P. smithii; y la lamprea marina (Petromyzon marinus).[38]
El tiburón arenero adulto no tiene ningún depredador natural de importancia.[21] Entre los depredadores principales de los tiburones más jóvenes encontramos al tiburón toro (Carcharias Taurus), el gran tiburón blanco (Carcharodon carcharias), el gayarre (C. leucas) y el tiburón tigre (Galeocerdo cuvier). En la costa de KwaZulu, el uso de redes para tiburón para proteger las playas ha reducido las poblaciones de estos depredadores de gran tamaño, que a su vez ha conducido a un incremento espectacular en el número de tiburones areneros jóvenes (un fenómeno llamado “liberación de depredador”). A su vez, los tiburones areneros jóvenes han diezmado las poblaciones de peces osteíctios pequeños, con consecuencias negativas para la biodiversidad del ecosistema local.[17][39]
Alimentación
[editar]
El tiburón arenero es una especie generalista que se alimenta de todo tipo de presas procedentes de todos los niveles de la columna de agua, aunque prefiere cazar por las cotas inferiores.[40][25] Un espécimen grande puede consumir más del 10% de su masa corporal de una sola vez. La fuerza de mordedura de un tiburón arenero de 2 m de largo es de 60 kg sobre un área de 2 mm² de la punta de un diente, según mediciones llevadas a cabo. Es la cifra más alta hasta el momento que se ha medido en ningún tiburón, aunque refleja también la concentración de fuerza en la punta del diente.[41] En el océano Índico se han registrado casos de grandes agrupaciones de tiburones jóvenes, formadas en respuesta a una mayor opción de poder alimentarse.[1]
La dieta conocida del tiburón arenero incluye diversos peces pelágicos, como el arenque y las anchoas, el atún y la caballa, el pez espada, el marlín, el jurel, los agujones y el pez volador, los barbudos, los sables, los lanzones y el pez linterna; también peces demersales, como lisas, besugos, corvinas, platycephalidae, anguilas, chiles, brótulas, rubios y lenguados; peces de arrecife, como barracudas, salmonetes, pagualas, meros, escorpenas y peces erizo; peces cartilaginosos, como escuálidos, tiburones sierra, angelotes, peces gato, peces zorro, mustelas, peces sierra, peces guitarra, rayas látigo y rayas de mariposa; e invertebrados, entre los que se incluyen cefalópodos, decápodos, cirrípedos y estrellas de mar. En muy raras ocasiones, los tiburones areneros de mayor tamaño también pueden consumir tortugas marinas, mamíferos marinos (principalmente carroña) y desechos humanos.[18][17][40][42]
Al noroeste del Atlántico, alrededor de un 60% de la dieta del tiburón arenero se basa en peces osteíctios, procedentes de más de diez familias, siendo los pomatómidos (Pomatomus saltatrix) y los peces planos (Paralichthys dentatus) los más importantes. Los peces cartilaginosos, en concreto los rájidos y los cascarones de sus huevos, son el segundo componente alimenticio más importante de su dieta, mientras que el cangrejo lady (Ovalipes ocellatus) también es una fuente alimentaria significativa.[40] En aguas sudafricanas y australianas, los osteíctios son de nuevo la presa principal. Los tiburones jóvenes y recién nacidos subsisten mayoritariamente a base de presas pelágicas pequeñas como la sardina o el calamar; los tiburones adultos de más de 2 m tienen una dieta mucho más variada que incluye peces cartilaginosos y osteíctios de mayor tamaño.[43][44] En la migración de la sardina sudafricana (Sardinops sagax), que ocurre en la costa este de Sudáfrica en invierno, hay presentes tiburones areneros de tamaño medio y grande. Los tiburones hembra que están encinta o en estado postparto no se unen, quizá porque la energía invertido en la gestación les hace incapaz el perseguir una presa tan rápida.[45] Según un estudio llevado a cabo en Sudáfrica, el 0,2% de los tiburones examinados había depredado sobre el delfín común (Tursiops truncatus).[46]
Ciclo reproductivo
[editar]
Como otros carcarrínidos, el tiburón arenero es vivíparo: al principio, los embriones en desarrollo se nutren a través del saco vitelino, el cual, una vez el suministro de vitelo se agota, establece una relación a través de la placenta con la madre. El apareamiento se produce en primavera en el noroeste del Atlántico, mientras que no parece haber una estación reproductiva específica en otras regiones, como fuera de Sudáfrica.[18][5] Las hembras son capaces de almacenar grandes cantidades de esperma, posiblemente de múltiples machos, durante meses o años dentro de la glándula de la cáscara (órgano que segrega el recubrimiento del huevo). Este aspecto de la reproducción es ventajoso, dada la naturaleza errante de esta especie y su escasez de ejemplares, ya que los encuentros con el macho adecuado para el coito son poco frecuentes e impredecibles.[47]
Las hembras dan a luz a una camada de crías, por lo menos, cada tres años.[1] Su período de gestación se estima de unos 22-24 meses y el tiempo de descanso entre uno y otro es de un año. El tamaño de la camada oscila entre 3 y 16 crías, siendo usuales de 6 a 12. El número de crías no tiene relación alguna con el tamaño de la hembra.[18][45] Los tiburones del Atlántico oeste tienden a parir camadas ligeramente más pequeñas que los del Atlántico sureste (un promedio de 8 crías por camada frente a 10).[21] Dependiendo de la región, el parto se puede producir en cualquier momento del año o durante un lapso de varios meses: se han encontrado crías de tiburón desde finales de invierno al verano en el Atlántico noroeste, en verano y otoño en Australia occidental, y durante todo el año, aunque especialmente en otoño, en Sudáfrica.[5][25] Las hembras se mueven por medios costeros poco profundos, como lagunas, para dar a luz y marcharse inmediatamente después.[18][44] Buscan zonas que puedan ofrecer a sus crías suministros abundantes de alimentos y refugio contra los depredadores (incluso de su propia especie). Estos criaderos son conocidos a lo largo de la costa de KwaZulu-Natal, al suroeste de Australia, al oeste de Baja California y al este de Estados Unidos, desde Nueva Jersey a Carolina del Norte.[1][18]
| Zona | Tamaño y edad de madurez de los machos | Tamaño y edad de madurez de las hembras |
|---|---|---|
| Atlántico noroeste | 2'8 m, 19 años[23] | 2'84 m, 21 años[23] |
| Este de Sudáfrica | 2'8 m, 19-21 años[18][48][49] | 2'6-3 m, 17-24 años[18][48] |
| Indonesia | 2'8-3 m, desconocida[50] | 2'8 m, desconocida[50] |
| Oeste de Australia | 2'65-2'8 m, 18-23 años[25][51] | 2'95–3'10 m 27-32 años[25][52] |
Las crías recién nacidas de tiburón arenero miden entre 0’7 cm. y 1 metro de largo;[1] su tamaño aumenta con el de la hembra y disminuye con el de la camada. Hay pruebas de que las hembras pueden determinar el tamaño con el que sus crías nacen, a fin de mejorar sus posibilidades de supervivencia a través de mejores o peores condiciones ambientales. Las hembras también suministran a sus crías reservas de energía, que mantienen al recién nacido hasta que aprende a cazar por sí mismo. Estas reservas de energía se almacenan en el hígado, que comprende una quinta parte del peso de la cría.[45] El tiburón arenero es una de las especies de tiburón que crece más lentamente, alcanzando la madurez sexual solo con un tamaño y edad considerable (véase tabla).[53] Varios estudios han encontrado tasas de crecimiento, en gran parte, similares en todas las regiones geográficas y entre los dos sexos.[23][50][53] La tasa de crecimiento anual es de 11’8 cm. en los primeros cinco años de vida.[51] Se cree que la esperanza de vida máxima es de 40 a 50 años, o incluso más.[53]
Relación con humanos
[editar]Se considera que el tiburón arenero es potencialmente peligroso para los humanos por su gran tamaño, aunque se sabe poco acerca de su comportamiento hacia la gente que se encuentra en el agua.[17] Desde 2009, el International Shark Attack File (Archivo Internacional de Ataques de Tiburones) lo incluye como responsable de seis ataques a personas y embarcaciones, tres sin motivación y uno mortal.[54] Sin embargo, los ataques atribuidos a esta especie en las Bermudas y otras islas los provocaron probablemente tiburones de Galápagos.[17] Algunos tiburones areneros adultos y jóvenes de gran tamaño quedan atrapados en las redes usadas para proteger las playas de Sudáfrica y Australia. Desde 1978 hasta 1999, se quedaron enganchados en las redes de KwaZulu-Natal una media de 256 individuos al año; No hay información disponible sobre esta especie en concreto en las redes de Australia.[53] Los tiburones areneros jóvenes se adaptan bien a su exhibición en acuarios.[17]

El tiburón arenero es una de las especies más demandadas por el comercio de aletas de tiburón, ya que éstas son grandes y contienen un elevado número de filamentos internos (ceratotrichia).[53] Además, la carne puede venderse fresca, congelada, seca y salada o ahumada; la piel es convertida en cuero y el aceite del hígado se trata para conseguir vitaminas.[22] Las pesquerías comerciales dirigidas a especies concretas capturan tiburones areneros en el este de América del Norte, el sudoeste de Australia y el este de Sudáfrica mediante palangres para múltiples especies y redes de enmalle. La industria pesquera del sudoeste australiano comenzó en 1940 y se expandió durante los años 70 produciendo entre 500 y 600 toneladas al año. Se utilizan redes de enmalle selectivas sumergidas que capturan casi exclusivamente tiburones menores de tres años, además de un 18% – 28% de todas las crías de un año. Los modelos demográficos indican que la pesca será sostenible siempre y cuando la tasa de mortalidad de los tiburones de más de 2 metros de largo sea menor al 4%.[53]
Además de las pesquerías comerciales, los palangres destinados a la pesca de atún o pez espada también capturan incidentalmente a los tiburones areneros (y normalmente se los quedan debido sus valiosas aletas), y por aquellos que practican la pesca recreativa. Un gran número de tiburones areneros, en su mayoría jóvenes, son capturados por pescadores deportivos en Sudáfrica y el este de Australia. Estos tiburones eran la especie más importante en los torneos de Florida en los que se gana el tiburón como trofeo, hasta que su población desapareció.[53]
Conservación
[editar]La Unión Internacional para la Conservación de la Naturaleza y los Recursos Naturales (IUCN), ha considerado a esta especie como “casi amenazada mundialmente” y como “vulnerable” en el noroeste Atlántico y el Golfo de México. La Sociedad Americana de Pesquerías también ha clasificado a las poblaciones de tiburones areneros de Norteamérica como “vulnerables”.[21] Su baja tasa reproductiva hace que el tiburón arenero sea extremadamente susceptible a la sobrepesca. Y las reservas de Estados Unidos se encuentran en un grave estado de sobreexplotación de los recursos marinos; Una evaluación de las reservas hecha en 2006 por el Servicio Nacional de Pesca Marina (NMFS en inglés) demostró que su población había descendido entre un 15% y un 20% desde 1970. En 1997, el NMFS identificó al tiburón arenero como “especie bajo preocupación”, lo que significa que el afán de que se conserve está justificado pero no hay información suficiente para añadirlo a la lista del Endangered Especies Act (ESA) de Estados Unidos. La captura comercial y recreativa de los tiburones areneros se prohibió en 1998, pero esto ha servido de poco debido al elevado ritmo de mortalidad que causa la pesca incidental en multitud de especies. Además, unos dos mil tiburones areneros fueron capturados por pescadores recreativos pese a la prohibición. En 2005, el norte de Carolina llevó a cabo una clausura espacial y temporal con el fin de reducir el impacto de la pesca recreativa.[55] Para ayudar a estos esfuerzos de conservación, se han desarrollado técnicas moleculares que usan la reacción en cadena de la polimerasa (PCR) mediante las que se puede identificar si las partes comercializadas del tiburón (e. g. las aletas) proceden de especies prohibidas como el tiburón arenero o, por el contrario, de especies similares, como el tiburón trozo, que sí está permitido pescar.[56]
Véase también
[editar]Referencias
[editar]- ↑ a b c d e f g h i Musick, J.A.; Grubbs, R.D.; Baum, J.; Cortés, E. (Versión 2010.1). IUCN 2010, ed. Carcharhinus obscurus. 3852. Consultado el 29 de abril de 2010.
- ↑ a b c Compagno, L.J.V.; Dando, M.; Fowler, S. (2005). Sharks of the World (en inglés). Princeton University Press. pp. 302–303. ISBN 9780691120720.
- ↑ Lesueur, C.A. (1818). «Description of several new species of North American fishes (part 1)». Journal of the Academy of Natural Sciences of Philadelphia 1 (en inglés). pp. 222-235.
- ↑ a b Ebert, D.A. (2003). Sharks, Rays, and Chimaeras of California (en inglés). University of California Press. pp. 160-162. ISBN 0520222652.
- ↑ a b c d e Compagno, L.J.V. (1984). «Sharks of the World: An Annotated and Illustrated Catalogue of Shark Species Known to Date». Food and Agricultural Organization (en inglés). pp. 489-491. ISBN 9251013845.
- ↑ Jordan, D.S.; Gilbert, C.H. (1882). Description of a new shark (Carcharias lamiella) from San Diego, California (en inglés). Proceedings of the United States National Museum 5 (269). pp. 110-111.
- ↑ a b Naylor, G.J.P. (1992). The phylogenetic relationships among requiem and hammerhead sharks: inferring phylogeny when thousands of equally most parsimonious trees result (en inglés) 8. Southeastern Naturalist. pp. 295-318. doi:10.1111/j.1096-0031.1992.tb00073.x.
- ↑ a b Heim, B. and Bourdon, J. (April 20, 2009). Species from the Fossil Record: Carcharhinus obscurus. The Life and Times of Long Dead Sharks. Retrieved on April 29, 2010.
- ↑ Portell, R.W.; Hubbell, G.; Donovan, S.K.; Green, J.K.; Harper, D.A.T.; Pickerill, R. (2008). Miocene sharks in the Kendeace and Grand Bay formations of Carriacou, The Grenadines, Lesser Antilles (en inglés) 44 (3). Caribbean Journal of Science. pp. 279-286.
- ↑ Cook, T.D.; Murray, A.M.; Simons, E.L.; Attia, Y.S.; Chatrath, P. (8 de febrero de 2010). A Miocene selachian fauna from Moghra, Egyp. Historical Biology: an International Journal of Paleobiology. pp. 1029-2381.
- ↑ Brown, R.C. (2008). Pineapple Press, ed. Florida's Fossils: Guide to Location, Identification, and Enjoyment (en inglés) (3º edición). p. 100. ISBN 1561644099.
- ↑ Sanchez-Villagra, M.R.; Burnham, R.J.; Campbell, D.C.; Feldmann, R.M.; Gaffney, E.S.; Kay, R.F.; Lozsan, R.; Purdy, R. et al. (septiembre de 2000). A New Near-Shore Marine Fauna and Flora from the Early Neogene of Northwestern Venezuela 74 (5). Journal of Paleontology. pp. 957-968. doi:10.1666/0022-3360(2000)074<0957:ANNSMF>2.0.CO;2.
- ↑ Cicimurri, D.J.; Knight, J.L. (2009). Two Shark-bitten Whale Skeletons from Coastal Plain Deposits of South Carolina (en inglés) 8 (1). Southeastern Naturalist. doi:10.1656/058.008.0107.
- ↑ Garrick, J.A.f. (1982). Sharks of the genus Carcharhinus. NOAA Technical Report, NMFS Circ. 445: 1–194.
- ↑ Compagno, L.J.V. (1988). Princeton University Press, ed. Sharks of the Order Carcharhiniformes (en inglés). pp. 319–320. ISBN 069108453X.
- ↑ Ovenden, J.R.; Kashiwagi, T.; Broderick, D.; Giles, J.; Salini, J. (2009). The extent of population genetic subdivision differs among four co-distributed shark species in the Indo-Australian archipelago (en inglés) 9 (1). BMC Evolutionary Biology. p. 40. PMC 2660307. PMID 19216767.
- ↑ a b c d e f Compagno, L.J.V. (1984). Sharks of the World: An Annotated and Illustrated Catalogue of Shark Species Known to Date (en inglés). Food and Agricultural Organization. pp. 489-491. ISBN 9251013845.
- ↑ a b c d e f g h i Ebert, D.A. (2003). Sharks, Rays, and Chimaeras of California (en inglés). University of California Press. pp. 160-162. ISBN 0520222652.
- ↑ Hoffmayer, E.R., Franks, J.S., Driggers, W.B. (III) and Grace, M.A. (March 26, 2009). "Movements and Habitat Preferences of Dusky (Carcharhinus obscurus) and Silky (Carcharhinus falciformis) Sharks in the Northern Gulf of Mexico: Preliminary Results." 2009 MTI Bird and Fish Tracking Conference Proceedings.
- ↑ a b Van der Elst, R.; Borchert, P. (1993). Struik, ed. A Guide to the Common Sea Fishes of Southern Africa (en inglés) (Tercera edición). p. 39. ISBN 1868253945.
- ↑ a b c d e f g Florida Museum of Natural History Ichthyology Department. «Biological Profiles: Dusky Shark» (en inglés). Archivado desde el original el 4 de enero de 2016. Consultado el 18 de mayo de 2009.
- ↑ a b "Carcharhinus obscurus". En FishBase (Rainer Froese y Daniel Pauly, eds.). Consultada en May de 2009. N.p.: FishBase, 2009.
- ↑ a b c d Natanson, L.J.; Casey, J.G.; Kohler, N.E. (1995). «Age and growth estimates for the dusky shark, Carcharhinus obscurus, in the western North Atlantic Ocean». Fishery Bulletin (en inglés) 93 (1): 116-126.
- ↑ McEachran, J.D.; Fechhelm, J.D. (1998). University of Texas Press, ed. Fishes of the Gulf of Mexico: Myxiniformes to Gasterosteiformes (en inglés). p. 82. ISBN 0292752067.
- ↑ a b c d e Last, P.R.; Stevens, J.D. (2009). Harvard University Press, ed. Sharks and Rays of Australia (en inglés) (Segunda edición). pp. 269-270. ISBN 0674034112.
- ↑ Huish, M.T.; Benedict, C. (1977). «Sonic tracking of dusky sharks in Cape Fear River, North Carolina». Journal of the Elisha Mitchell Scientific Society 93 (1): 21-26.
- ↑ Schwartz, F.J. (verano 2004). Journal of the North Carolina Academy of Science (en inglés) 120 (2): 44-49.
- ↑ Ruhnke, T.R. y Caira, J.N. (2009). «Two new species of Anthobothrium van Beneden, 1850 (Tetraphyllidea: Phyllobothriidae) from carcharhinid sharks, with a redescription of Anthobothrium laciniatum Linton, 1890». Systematic Parasitology (en inglés) 72 (3): 217-227. PMID 19189232. doi:10.1007/s11230-008-9168-0.
- ↑ Beveridge, I. y Campbell, R.A. (febrero de 1993). «A revision of Dasyrhynchus Pintner (Cestoda, Trypanorhyncha), parasitic in elasmobranch and teleost fishes». Systematic Parasitology (en inglés) 24 (2): 129-157. doi:10.1007/BF00009597.
- ↑ Healy, C.J. (octubre de 2003). «A revision of Platybothrium Linton, 1890 (Tetraphyllidea : Onchobothriidae), with a phylogenetic analysis comments on host-parasite associations». Systematic Parasitology (en inglés) 56 (2): 85-139. PMID 14574090. doi:10.1023/A:1026135528505.
- ↑ Linton, E. (1921). «Rhynchobothrium ingens spec. nov., a parasite of the dusky shark (Carcharhinus obscurus)». Journal of Parasitology (en inglés) 8 (1): 22-32. doi:10.2307/3270938.
- ↑ Knoff, M.; De Sao Clemente, S.C.; Pinto, R.M.; Lanfredi, R.M. y Gomes, D.C. (abril-junio de 2004). «New records and expanded descriptions of Tentacularia coryphaenae and Hepatoxylon trichiuri homeacanth trypanorhynchs (Eucestoda) from carcharhinid sharks from the State of Santa Catarina off-shore, Brazil». Revista Brasileira de Parasitologia Veterinaria (en inglés) 13 (2): 73-80.
- ↑ Caira, J.N. y Jensen, K. (2009). «Erection of a new onchobothriid genus (Cestoda: Tetraphyllidea) and the description of five new species from whaler sharks (Carcharhinidae)». Journal of Parasitology (en inglés) 95 (4): 924-940. PMID 19271790. doi:10.1645/GE-1963.1.
- ↑ Bullard, S.A.; Dippenaar, S.M.; Hoffmayer, E.R. y Benz, G.W. (enero de 2004). «New locality records for Dermophthirius carcharhini (Monogenea : Microbothriidae) and Dermophthirius maccallumi and a list of hosts localities for species of Dermophthirius». Comparative Parasitology (en inglés) 71 (1): 78-80. doi:10.1654/4093.
- ↑ MacCullum, G.A. (1917). «Some new forms of parasitic worms». Zoopathologica; scientific contributions of the New York Zoological Society (en inglés) 1 (2): 1-75.
- ↑ Yamauchi, T.; Ota, Y. y Nagasawa, K. (20 de agosto de 2008). «Stibarobdella macrothela (Annelida, Hirudinida, Piscicolidae) from Elasmobranchs in Japanese Waters, with New Host Records». Biogeography (en inglés) 10: 53-57.
- ↑ Newbound, D.R. y Knott, B. (noviembre de 1999). «Parasitic copepods from pelagic sharks in Western Australia». Bulletin of Marine Science (en inglés) 65 (3): 715-724.
- ↑ Jensen, C. y Schwartz, F.J. (diciembre de 1994). «Atlantic Ocean occurrences of the sea lamprey, Petromyzon marinus (Petromyzontiformes: Petromyzontidae), parasitizing sandbar, Carcharhinus plumbeus, and dusky, C. obscurus (Carcharhiniformes: Carcharhinidae), sharks off North and South Carolina». Brimleyana (en inglés) 21: 69-76.
- ↑ Martin, R.A. A Place For Sharks. A Place For Sharks ReefQuest Centre for Shark Research. Consultado el 5 de mayo de 2010..
- ↑ a b c Gelsleichter, J.; Musick, J.A. y Nichols, S. (febrero de 1999). «Food habits of the smooth dogfish, Mustelus canis, dusky shark, Carcharhinus obscurus, Atlantic sharpnose shark, Rhizoprionodon terraenovae, and the sand tiger, Carcharias taurus, from the northwest Atlantic Ocean». Environmental Biology of Fishes (en inglés) 54 (2): 205-217. doi:10.1023/A:1007527111292.
- ↑ Martin, R.A. The Power of Shark Bites.. ReefQuest Centre for Shark Research. Consultado el 31 de agosto de 2009..
- ↑ Gubanov, E.P. (1988). «Morphological characteristics of the requiem shark, Carcharinus obscurus, of the Indian Ocean». Journal of Ichthyology (en inglés) 28 (6): 68-73.
- ↑ Simpfendorfer, C.A.; Goodreid, A. y McAuley, R.B. (2001). «Diet of three commercially important shark species from Western Australian waters». Marine and Freshwater Research (en inglés) 52 (7): 975-985. doi:10.1071/MF01017.
- ↑ a b Smale, M.J. (1991). «Occurrence and feeding of three shark species, Carcharhinus brachyurus, C. obscurus and Sphyrna zygaena, on the eastern Cape coast of South Africa». South African Journal of Marine Science (en inglés): 31-42.
- ↑ a b c Hussey, N.E.; Cocks, D.T.; Dudley, S.F.J.; McCarthy, I.D.; Wintner, S.P. (2009). «The condition conundrum: application of multiple condition indices to the dusky shark Carcharhinus obscurus». Marine Ecology Progress Series (en inglés) 380: 199-212.
- ↑ Cockcroft, V.G.; Cliff, G. y Ross, G.J.B. (1989). «Shark predation on Indian Ocean bottlenose dolphins Tursiops truncatus off Natal, South Africa». South African Journal of Zoology (en inglés) 24 (4): 305-310.
- ↑ Pratt, H.L. (1993). «The storage of spermatozoa in the oviducal glands of western North Atlantic sharks». Environmental Biology of Fishes (en inglés) 38: 139-149. doi:10.1007/BF00842910.
- ↑ a b Natanson, L.J.; Kohler, N.E. (1996). «A preliminary estimate of age and growth of the dusky shark Carcharhinus obscurus from the South-West Indian Ocean, with comparisons to the western North Atlantic population». South African Journal of Marine Science (en inglés) 17: 217-224.
- ↑ Dudley, S.J.F.; Cliff, G.; Zungu, M.P.; Smale, M.J. (2005). «Sharks caught in the protective gillnets off KwaZulu-Natal, South Africa. 10. The dusky shark Carcharhinus obscurus (LeSueur, 1818)». South African Journal of Marine Science (en inglés) 27: 107-127.
- ↑ a b c White, W.T. (2007). «Catch composition and reproductive biology of whaler sharks (Carcharhiniformes: Carcharhinidae) caught by fisheries in Indonesia». Journal of Fish Biology (en inglés) 71: 1512-1540. doi:10.1111/j.1095-8649.2007.01623.x.
- ↑ a b Simpfendorfer, C.A. (Octubre de 2000). «Growth rates of juvenile dusky sharks, Carcharhinus obscurus (Lesueur, 1818), from southwestern Australia estimated from tag-recapture data». Fishery Bulletin (en inglés) 98 (4): 811-822.
- ↑ McAuley, R.; Lenanton, R.; Chidlow, J.; Allison, R.; Heist, E. (2005). «Biology and stock assessment of the thickskin (sandbar) shark, Carcharhinus plumbeus, in Western Australia and further refinement of the dusky shark, Carcharhinus obscurus, stock assessment. Final FRDC Report - Project 2000/134». Fisheries Western Australia Fisheries Research Report (en inglés) 151: 1-132.
- ↑ a b c d e f g Fowler, S.L.; Cavanagh, R.D.; Camhi, M.; Burgess, G.H.; Cailliet, G.M.; Fordham, S.V.; Simpfendorfer, C.A.; Musick, J.A. (2005). International Union for Conservation of Nature and Natural Resources, ed. Sharks, Rays and Chimaeras: The Status of the Chondrichthyan Fishes (en inglés). pp. 297-300. ISBN 2831707005.
- ↑ ISAF Statistics on Attacking Species of Shark. International Shark Attack File, Florida Museum of Natural History, University of Florida. Consultado el 14 de mayo de 2010.
- ↑ Species of Concern: Dusky Shark Archivado el 3 de agosto de 2010 en Wayback Machine.. (Jan. 6, 2009). NMFS Office of Protected Resources. Consultado el 18 de mayo de 2009.
- ↑ Pank, M., Stanhope, M., Natanson, L., Kohler, N. and Shivji, M. (2001). «Rapid and Simultaneous Identification of Body Parts from the Morphologically Similar Sharks Carcharhinus obscurus and Carcharhinus plumbeus (Carcharhinidae) Using Multiplex PCR». Marine Biotechnology 3 (3): 231-240. PMID 14961360. doi:10.1007/s101260000071.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Carcharhinus obscurus.
Wikimedia Commons alberga una categoría multimedia sobre Carcharhinus obscurus. Wikispecies tiene un artículo sobre Carcharhinus obscurus.
Wikispecies tiene un artículo sobre Carcharhinus obscurus.- Biological Profiles: Dusky Shark
- Carcharhinus obscurus, (Tiburón arenero) en FishBase
- Biological Profiles: Dusky Shark en Florida Museum of Natural History Ichthyology Department
- Esta obra contiene una traducción total derivada de «Dusky shark» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.