Étoricoxib
| Étoricoxib | |
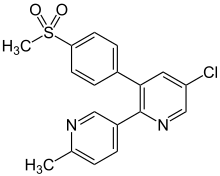
| |
| Identification | |
|---|---|
| Nom UICPA | 5-chloro-6'-méthyl-3-[4-(méthylsulfonyl)phényl]-2,3'-bipyridine |
| No CAS | |
| No ECHA | 100.207.709 |
| Code ATC | M01 |
| DrugBank | DB01628 |
| PubChem | 123619 |
| SMILES | |
| InChI | |
| Apparence | Solide |
| Propriétés chimiques | |
| Formule | C18H15ClN2O2S |
| Masse molaire[1] | 358,842 ± 0,023 g/mol C 60,25 %, H 4,21 %, Cl 9,88 %, N 7,81 %, O 8,92 %, S 8,94 %, |
| Données pharmacocinétiques | |
| Biodisponibilité | 100 % |
| Métabolisme | hépatique |
| Demi-vie d’élim. | 22 heures |
| Excrétion |
Rénale(70 %) and fécale (20 %) |
| Considérations thérapeutiques | |
| Classe thérapeutique | analgésique[2]; Anti-inflammatoire non stéroïdien : inhibiteur sélectif de la COX-2 |
| Voie d’administration | Oral |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'étoricoxib est un nouveau coxib. Aux États-Unis, la FDA exige des données supplémentaires concernant la sécurité et l'efficacité de l'étoricoxib avant d'autoriser sa mise sur le marché. Le médicament est enregistré dans certains pays d'Europe, par exemple, la Grande-Bretagne, la Belgique (Arcoxia). En France, son autorisation de mise sur le marché a été prononcée en commission d'AMM par la haute autorité de santé, le [3].
Liens externes
[modifier | modifier le code]- Compendium suisse des médicaments : spécialités contenant Étoricoxib
Notes et références
[modifier | modifier le code]- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ Classement pharmaco-thérapeutique VIDAL
- ↑ [PDF] AVIS du 29 avril 2009 - HAS - Commission de la transparence.