Noretisteron

| |
|---|---|

| |
| Nama sistematis (IUPAC) | |
| (8R,9S,10R,13S,14S,17R)-17-etinil-17-hidroksi-13-metil-1,2,6,7,8,9,10,11,12,14,15,16-dodekahidrosiklopenta[a]fenantren-3-ona | |
| Data klinis | |
| Nama dagang | Banyak |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a604034 |
| Data lisensi | US Daily Med:pranala |
| Kat. kehamilan | ? |
| Status hukum | ℞-only (US) |
| Rute | Oral, intramuskular (sebagai noretisteron enantat) |
| Data farmakokinetik | |
| Bioavailabilitas | 47–73% (rata-rata 64%)[1][2] |
| Ikatan protein | 97%:[3] Albumin serum manusia: 61%;[3] globulin pengikat hormon seks: 36%[3] |
| Metabolisme | Terutama CYP3A4 (Hati);[4] juga 5α-/5β-reduktase, 3α-/3β-HSD, & aromatase |
| Waktu paruh | 5.2–12.8 jam (rata-rata 8.0 jam)[1] |
| Pengenal | |
| Nomor CAS | 68-22-4 |
| Kode ATC | G03AC01 G03DC02 |
| PubChem | CID 6230 |
| Ligan IUPHAR | 2880 |
| DrugBank | DB00717 |
| ChemSpider | 5994 |
| UNII | T18F433X4S |
| KEGG | D00182 |
| ChEBI | CHEBI:7627 |
| ChEMBL | CHEMBL1162 |
| Sinonim | NET; Noretindron; NSC-9564; LG-202; Etinilnortestosteron; Norpregneninolon; Anhidrohidroksi-norprogesteron; Etinilestrenolon; 17α-Etinil-19-nortestosteron; 17α-Etinilestra-4-en-17β-ol-3-ona; 17α-Hidroksi-19-norpregn-4-en-20-in-3-ona |
| Data kimia | |
| Rumus | C20H26O2 |
| |
| Data fisik | |
| Titik lebur | 203–204 °C (397–399 °F) |
Noretisteron, juga dikenal sebagai noretindron dan dijual dengan banyak merek, adalah obat progestin yang digunakan dalam pil kontrasepsi oral gabungan, terapi hormon menopause, dan untuk pengobatan gangguan ginekologi.[3][5] Obat ini tersedia dalam formulasi dosis rendah dan dosis tinggi, baik sendiri maupun dalam kombinasi dengan estrogen.[5][6] Obat ini digunakan melalui mulut, atau sebagai noretisteron enantat dengan suntikan ke otot.[3][5][7]
Efek samping noretisteron termasuk ketidakteraturan menstruasi, sakit kepala, mual, nyeri payudara, perubahan suasana hati, jerawat, dan hirsutisme.[8][9] Noretisteron adalah progestin, atau progestogen sintetik, dan karenanya merupakan agonis reseptor progesteron, yakni target biologis progestogen seperti progesteron.[3][5] Ia memiliki aktivitas androgenik dan estrogenik yang lemah, sebagian besar pada dosis tinggi, dan tidak ada aktivitas hormonal penting lainnya.[3][10]
Noretisteron ditemukan pada tahun 1951 dan merupakan salah satu progestin pertama yang dikembangkan.[11][12][13] Obat ini pertama kali diperkenalkan untuk penggunaan medis pada tahun 1957 dan diperkenalkan dalam kombinasi dengan estrogen untuk digunakan sebagai pil KB pada tahun 1963.[13][14] Kadang-kadang disebut sebagai progestin "generasi pertama".[15][16] Bersama dengan desogestrel, obat ini adalah satu-satunya progestin yang tersedia secara luas sebagai "pil mini" khusus progestogen untuk pengendalian kelahiran.[17][18] Noretisteron dipasarkan secara luas di seluruh dunia.[19] Obat ini tersedia sebagai obat generik.[20] Obat ini ada dalam Daftar Obat Esensial Organisasi Kesehatan Dunia.[21]
Sejarah
[sunting | sunting sumber]Noretisteron disintesis pertama kali oleh ahli kimia Luis Miramontes, Carl Djerassi, dan George Rosenkranz di Syntex di Mexico City pada tahun 1951.[11] Obat ini berasal dari etisteron, dan ditemukan memiliki potensi 20 kali lipat lebih besar sebagai progestogen jika dibandingkan.[butuh rujukan] Noretisteron adalah progestogen oral pertama yang sangat aktif yang disintesis, dan didahului (sebagai progestogen) oleh progesteron (1934), etisteron (1938), 19-norprogesteron (1944), dan 17α-metilprogesteron (1949) serta oleh nandrolon (1950), sedangkan noretinodrel (1952) dan noretandrolon (1953) mengikuti sintesis noretisteron.[12][13] Obat ini diperkenalkan sebagai Norlutin di Amerika Serikat pada tahun 1957.[14] Noretisteron kemudian digabungkan dengan mestranol dan dipasarkan sebagai Ortho-Novum di Amerika Serikat pada tahun 1963. Obat ini adalah progestin kedua, setelah noretinodrel pada tahun 1960, yang digunakan dalam kontrasepsi oral.[13] Pada tahun 1964, sediaan kontrasepsi tambahan yang mengandung noretisteron yang dikombinasikan dengan mestranol atau etinilestradiol, seperti Norlestrin dan Norinyl, dipasarkan di Amerika Serikat.[13]
Kegunaan dalam Medis
[sunting | sunting sumber]Noretisteron digunakan sebagai kontrasepsi hormonal yang dikombinasikan dengan estrogen – biasanya etinilestradiol (EE) – dalam pil kontrasepsi oral gabungan dan hanya pada pil progestogen saja.
Penggunaan medis lain dari noretisteron adalah untuk meringankan nyeri terkait endometriosis. Faktanya, 50% pasien yang menerima perawatan medis atau bedah untuk nyeri panggul terkait endometriosis telah mendapatkan manfaat dari terapi progestin. Hal ini mungkin disebabkan oleh fakta bahwa noretisteron menginduksi proliferasi endometrium selama fase sekretori, yang terbukti mengurangi keluhan nyeri endometrium. Cara lain di mana noretisteron dapat bertindak untuk mengurangi nyeri endometrium adalah melalui penghambatan ovulasi. Rasa sakit dan ketidaknyamanan akibat endometriosis semakin parah selama ovulasi.[22]
Kontraindikasi
[sunting | sunting sumber]Noretisteron dosis tinggi (10 mg/hari) telah dikaitkan dengan penyakit veno-oklusif hati, dan karena efek buruk ini, noretisteron tidak boleh diberikan kepada pasien yang menjalani transplantasi sumsum tulang alogenik, karena hal ini dikaitkan dengan kelangsungan hidup satu tahun pasca transplantasi yang jauh lebih rendah.[23][24]
Efek Samping
[sunting | sunting sumber]Pada dosis kontrasepsi dan penggantian hormon (0,35 hingga 1 mg/hari), noretisteron pada dasarnya hanya memiliki efek samping progestogenik. Dalam sebagian besar studi klinis noretisteron untuk kontrasepsi atau terapi hormon menopause, obat tersebut telah dikombinasikan dengan estrogen, dan karena alasan ini, sulit untuk menentukan efek samping mana yang disebabkan oleh noretisteron dan efek samping mana yang disebabkan oleh estrogen dalam penelitian tersebut. Namun, NETE, suatu bakal obat noretisteron yang diberikan secara intramuskular yang digunakan sebagai kontrasepsi jangka panjang, digunakan tanpa estrogen, dan karenanya dapat digunakan sebagai pengganti noretisteron dalam hal memahami efek dan tolerabilitasnya. Dalam studi klinis, efek samping yang paling umum dari NETE adalah gangguan menstruasi, termasuk perdarahan berkepanjangan atau bercak dan amenorea.[23] Efek samping lainnya termasuk perut kembung dan nyeri payudara secara berkala, yang keduanya diduga disebabkan oleh retensi air dan dapat diatasi dengan diuretik.[23] Tidak ada hubungan dengan penambahan berat badan, dan tekanan darah, penggumpalan darah, dan toleransi glukosa semuanya tetap normal.[23] Namun, terjadi penurunan kolesterol HDL telah diamati.[23]
Pada dosis tinggi (5 hingga 60 mg/hari), misalnya yang digunakan dalam pengobatan kelainan ginekologi, noretisteron dapat menyebabkan hipogonadisme karena efek antigonadotropiknya dan dapat menimbulkan efek samping estrogenik dan androgenik lemah.
NETA dosis tinggi (10 mg/hari) telah dikaitkan dengan tes fungsi hati yang abnormal, termasuk peningkatan enzim hati yang signifikan.[25][26][27] Enzim hati ini termasuk laktat dehidrogenase dan glutamat piruvat transaminase.[27] Meskipun obat-obatan tersebut digambarkan tidak memiliki relevansi klinis,[27] peningkatan enzim hati yang terkait dengan NETA mungkin menghalangi pengembangan lebih lanjut untuk kontrasepsi hormonal pria.[25][26]
Androgenik
[sunting | sunting sumber]Karena aktivitas androgeniknya yang lemah, noretisteron dapat menghasilkan efek samping androgenik seperti jerawat, hirsutisme, dan perubahan suara yang tidak terlalu parah pada beberapa wanita dengan dosis tinggi (misalnya, 10 hingga 40 mg/hari).[9] Namun, hal ini tidak terjadi pada pil kontrasepsi oral gabungan yang mengandung noretisteron dan EE. Formulasi tersebut mengandung noretisteron dosis rendah (0,35 hingga 1 mg/hari)[10] yang dikombinasikan dengan estrogen dan sebenarnya berhubungan dengan perbaikan gejala jerawat.[28][29] Sesuai dengan hal tersebut, obat-obatan tersebut sebenarnya disetujui oleh FDA untuk pengobatan jerawat pada wanita di Amerika Serikat.[28][29] Perbaikan gejala jerawat diyakini disebabkan oleh peningkatan 2 hingga 3 kali lipat kadar globulin pengikat hormon seks (SHBG) dan penurunan kadar testosteron bebas yang disebabkan oleh EE, yang mengakibatkan penurunan sinyal androgenik secara keseluruhan di dalam tubuh.[30]
Kelenjar minyak sangat sensitif terhadap androgen dan ukuran serta aktivitasnya merupakan penanda potensial efek androgenik.[31] Noretisteron atau NETA dosis tinggi 20 mg/hari terbukti merangsang kelenjar minyak secara signifikan, sedangkan dosis rendah masing-masing 5 mg/hari dan 2,5 mg/hari noretisteron dan NETA tidak merangsang produksi sebum secara signifikan dan akibatnya dianggap karena tidak memiliki androgenisitas yang signifikan.[31] Sebaliknya, dosis noretisteron 0,5 hingga 3 mg/hari terbukti menurunkan kadar SHBG secara ketergantungan dosis (dan karenanya menekan produksi SHBG hati), yang merupakan penanda androgenisitas lain yang sangat sensitif.[32]
Sebuah studi klinis besar tentang noretisteron dosis tinggi hingga sangat tinggi (10 hingga 40 mg/hari) yang diberikan dalam jangka waktu lama (4 hingga 35 minggu) untuk mencegah keguguran pada wanita hamil menemukan bahwa 5,5% wanita mengalami efek androgenik ringan. Efek seperti perubahan suara ringan (suara serak), jerawat, dan hirsutisme dan 18,3% bayi perempuan yang lahir dari ibu menunjukkan (dalam banyak kasus hanya sedikit) virilisasi alat kelamin. Gejala androgenik ibu paling sering terjadi pada wanita yang menerima dosis noretisteron 30 mg/hari atau lebih untuk jangka waktu 15 minggu atau lebih. Pada bayi perempuan yang mengalami virilisasi alat kelamin, manifestasi tunggal pada 86,7% kasus bervariasi tetapi hampir selalu berupa sedikit pembesaran klitoris. Pada sisa 13,3% kasus yang terkena, terjadi pembesaran klitoris yang nyata dan fusi parsial lipatan labioskrotal. Dosis yang digunakan dalam kasus ini adalah 20 hingga 40 mg/hari.[9]
Dalam sebuah surat kepada editor tentang topik virilisasi yang disebabkan oleh NETA dosis tinggi pada wanita, seorang dokter menyatakan bahwa mereka tidak mengamati "sedikit pun bukti virilisasi" dan bahwa "tentu saja tidak ada hirsutisme atau perubahan suara apa pun" di 55 wanita dengan kanker payudara stadium lanjut yang telah mereka obati dengan noretisteron 30 hingga 60 mg/hari hingga enam bulan.[33]
Noretisteron dosis tinggi telah digunakan untuk menekan menstruasi pada wanita dengan disabilitas intelektual parah yang tidak mampu menangani menstruasi mereka sendiri.[34][35] Sebuah penelitian terhadap 118 wanita nulipara yang diobati dengan noretisteron 5 mg/hari untuk jangka waktu 2 hingga 30 bulan menemukan bahwa obat tersebut efektif dalam menyebabkan amenorea pada 86% wanita, dengan perdarahan hebat terjadi pada 14% sisanya. Efek samping termasuk penambahan berat badan, hirsutisme, jerawat, sakit kepala, mual, dan muntah semuanya tampaknya tidak meningkat insidennya dan tidak ada "efek samping yang mengganggu" yang tercatat pada wanita mana pun.[34][35] Penelitian lain mengenai noretisteron 5 mg/hari pada 132 wanita juga tidak menyebutkan efek samping androgenik.[36] Temuan ini menunjukkan sedikit atau tidak ada risiko efek samping androgenik dengan noretisteron dengan dosis 5 mg/hari.[34][35] Sebuah penelitian terhadap 194 wanita yang diobati dengan NETA 5 hingga 15 mg/hari dengan durasi rata-rata 13 bulan terapi untuk menekan gejala endometriosis tidak menemukan efek samping pada 55,2% pasien; penambahan berat badan pada 16,1%; jerawat pada 9,9%; dan suasana hati labilitas pada 8,9%; hot flash pada 8,3%; dan suara yang semakin dalam pada dua wanita (1,0%).[37]
Estrogenik
[sunting | sunting sumber]Noretisteron bersifat estrogenik lemah (melalui konversi menjadi metabolitnya EE), dan karena alasan ini, pada dosis tinggi ditemukan berhubungan dengan tingginya tingkat efek samping estrogenik seperti pembesaran payudara pada wanita dan ginekomastia pada pria, tetapi juga dengan perbaikan gejala menopause pada wanita pascamenopause.[38] Telah dikemukakan bahwa dosis NETA yang sangat tinggi (misalnya, 40 mg/hari, yang kadang-kadang digunakan dalam praktik klinis untuk berbagai indikasi) NETA (dan selanjutnya noretisteron) dapat menyebabkan peningkatan risiko tromboemboli vena (VTE) serupa dengan EE dosis tinggi (di atas 50 μg/hari), dan bahkan dosis NETA 10 hingga 20 mg, yang sesuai dengan dosis EE sekitar 20 hingga 30 μg/hari, mungkin pada wanita tertentu dikaitkan dengan peningkatan risiko.[39][40] Sebuah penelitian juga menemukan bahwa etinilestradiol dan noretisteron memiliki pengaruh yang lebih besar terhadap faktor koagulasi ketika dosis noretisteron adalah 3 atau 4 mg dibandingkan ketika 1 mg.[41] Hal ini mungkin disebabkan oleh tambahan etinilestradiol yang dihasilkan oleh noretisteron dengan dosis lebih tinggi.[41]
Overdosis
[sunting | sunting sumber]Belum ada laporan mengenai efek samping serius akibat overdosis noretisteron, bahkan pada anak kecil. Oleh karena itu, overdosis biasanya tidak memerlukan pengobatan.[42] Noretisteron dosis tinggi sebanyak 60 mg/hari telah dipelajari untuk jangka waktu pengobatan yang lebih lama tanpa dijelaskan efek samping yang serius.[33]
Interaksi
[sunting | sunting sumber]5α-Reduktase memainkan peran penting dalam metabolisme noretisteron, dan inhibitor 5α-reduktase seperti finasterid dan dutasterid dapat menghambat metabolismenya.[butuh rujukan] Noretisteron sebagian dimetabolisme melalui hidroksilasi oleh CYP3A4, dan inhibitor enzim serta penginduksi CYP3A4 dapat mengubah secara signifikan tingkat noretisteron yang beredar.[4] Misalnya, penginduksi CYP3A4 rifampisin dan bosentan terbukti menurunkan paparan noretisteron masing-masing sebesar 42% dan 23%, dan penginduksi CYP3A4 karbamazepin dan Hypericum perforatum juga terbukti mempercepat pembersihan noretisteron.[4]
Farmakologi
[sunting | sunting sumber]Farmakodinamik
[sunting | sunting sumber]Noretisteron adalah progestogen yang kuat dan merupakan androgen dan estrogen yang lemah.[3] Artinya, ia merupakan agonis kuat pada reseptor progesteron (PR) dan agonis lemah pada reseptor androgen (AR) dan reseptor estrogen (ER).[3] Noretisteron sendiri memiliki afinitas yang tidak signifikan terhadap ER; aktivitas estrogeniknya berasal dari metabolit aktif yang terbentuk dalam jumlah sangat kecil, etinilestradiol (EE), yang merupakan estrogen yang sangat kuat.[3] Noretisteron dan metabolitnya memiliki afinitas yang dapat diabaikan terhadap reseptor glukokortikoid (GR) dan reseptor mineralokortikoid (MR) dan karenanya tidak memiliki aktivitas glukokortikoid, antiglukokortikoid, mineralokortikoid, atau antimineralokortikoid.[3]
Aktivitas progestogenik
[sunting | sunting sumber]Noretisteron adalah progestogen kuat dan berikatan dengan PR dengan sekitar 150% afinitas progesteron.[3] Sebaliknya, senyawa induknya yakni testosteron, nandrolon (19-nortestosteron), dan etisteron (17α-etiniltestosteron), memiliki 2%, 22%, dan 44% afinitas pengikatan relatif progesteron terhadap PR.[43] Tidak seperti noretisteron, metabolit aktif utamanya yakni 5α-dihidronoretisteron (5α-DHNET), yang dibentuk melalui transformasi melalui 5α-reduktase, diketahui memiliki aktivitas progestogenik dan antiprogestogenik yang nyata,[44] meskipun afinitasnya terhadap PR sangat berkurang dibandingkan dengan noretisteron, yaitu hanya 25% dari progesteron.[3] Norethisterone menghasilkan perubahan serupa pada endometrium dan vagina, seperti transformasi endometrium, dan juga bersifat antigonadotropik, penghambat ovulasi, dan termogenik pada wanita dibandingkan dengan progesteron, yang sesuai dengan aktivitas progestogeniknya.[45][43][46]
Aktivitas androgenik
[sunting | sunting sumber]Norethisterone memiliki sekitar 15% afinitas steroid anabolik-androgenik (AAS) metribolon (R-1881) untuk AR, dan karenanya, bersifat androgenik lemah.[3] Berbeda dengan noretisteron, 5α-DHNET, metabolit utama noretisteron, menunjukkan afinitas yang lebih tinggi terhadap AR, dengan sekitar 27% afinitas terhadap metribolon.[3] Namun, meskipun 5α-DHNET memiliki afinitas yang lebih tinggi terhadap AR dibandingkan noretisteron, ia telah berkurang secara signifikan dan bahkan hampir menghilangkan potensi androgenik dibandingkan dengan noretisteron dalam bioassay hewan pengerat.[47][48] Temuan serupa diamati untuk etisteron (17α-etiniltestosteron) dan metabolitnya yang tereduksi 5α, sedangkan reduksi 5α meningkatkan afinitas AR dan potensi androgenik testosteron dan nandrolon (19-nortestosteron) dalam bioassay hewan pengerat.[48] Dengan demikian, nampaknya gugus etinil noretisteron pada posisi C17α bertanggung jawab atas hilangnya androgenisitasnya pada reduksi 5α.[48]
Noretisteron (0,5 hingga 3 mg/hari) terbukti menurunkan kadar SHBG dalam sirkulasi secara ketergantungan dosis, yang merupakan sifat umum androgen dan disebabkan oleh penekanan produksi SHBG hati yang dimediasi oleh AR. Obat ini juga mempunyai aktivitas estrogenik, dan estrogen diketahui meningkatkan produksi SHBG di hati dan kadar sirkulasi, sehingga aktivitas androgenik noretisteron mengalahkan aktivitas estrogeniknya dalam hal ini.[32]
Noretisteron terikat sebagian besar (36%) pada SHBG yang beredar.[3] Meskipun memiliki afinitas yang lebih rendah terhadap SHBG dibandingkan androgen dan estrogen endogen,[49] noretisteron dapat menggantikan testosteron dari SHBG dan dengan demikian meningkatkan kadar testosteron bebas, dan tindakan ini mungkin berkontribusi terhadap efek androgeniknya yang lemah.[50]
Aktivitas estrogenik
[sunting | sunting sumber]
Noretisteron berikatan dengan ER, ERα dan ERβ; dengan 0,07% dan 0,01% afinitas pengikatan relatif estradiol.[51] Karena afinitas relatifnya yang sangat rendah, ligan ini pada dasarnya tidak aktif sebagai ligan ER pada konsentrasi klinis.[3] Namun, noretisteron telah ditemukan menjadi substrat untuk aromatase dan diubah di hati dalam jumlah kecil (0,35%) menjadi estrogen etinilestradiol (EE) yang sangat kuat, dan karena alasan ini, tidak seperti kebanyakan progestin lainnya, noretisteron mempunyai aktivitas estrogenik.[3] Namun, dengan dosis khas noretisteron yang digunakan dalam pil KB (0,5 hingga 1 mg), kadar EE yang dihasilkan rendah, dan dikatakan bahwa EE tersebut mungkin tidak memiliki relevansi klinis.[3] Sebaliknya, dosis noretisteron 5 dan 10 mg, yang digunakan dalam pengobatan gangguan ginekologi, dikonversi pada tingkat 0,7% dan 1,0% dan menghasilkan kadar EE yang sesuai dengan yang dihasilkan oleh dosis EE 30 dan 60 μg, masing-masing.[1][3] Tingkat EE yang dibentuk oleh 0,5 dan 1 mg noretisteron telah diperkirakan berdasarkan dosis yang lebih tinggi sesuai dengan dosis EE 2 dan 10 μg.[1] Pada dosis tinggi, noretisteron dapat meningkatkan risiko tromboemboli vena akibat metabolisme menjadi etinilestradiol.[52]
Aktivitas neurosteroid
[sunting | sunting sumber]Seperti progesteron dan testosteron, noretisteron dimetabolisme menjadi metabolit 3,5-tetrahidro. Apakah metabolit noretisteron ini berinteraksi dengan reseptor GABAA serupa dengan metabolit 3,5-tetrahidro dari progesteron dan testosteron seperti allopregnanolon dan 3α-androstanediol, merupakan topik yang tampaknya belum pernah diteliti dan oleh karena itu memerlukan klarifikasi.[53]
Penghambatan steroidogenesis
[sunting | sunting sumber]Noretisteron adalah substrat dan dikenal sebagai inhibitor enzim 5α-reduktase, dengan penghambatan 4,4% dan 20,1% masing-masing pada 0,1 dan 1 μM. Namun, konsentrasi terapeutik noretisteron berada dalam kisaran nanomolar rendah, sehingga tindakan ini mungkin tidak relevan secara klinis pada dosis tertentu.[3]
Noretisteron dan metabolit aktif utamanya 5α-DHNET telah ditemukan bertindak sebagai penghambat aromatase ireversibel (Ki = 1.7 μM & 9.0 μM, masing-masing).[54] Namun, seperti halnya 5α-reduktase, konsentrasi yang dibutuhkan mungkin terlalu tinggi untuk relevan secara klinis pada dosis tertentu.[3] 5α-DHNET secara khusus telah dinilai dan terbukti selektif dalam menghambat aromatase, dan tidak mempengaruhi enzim pemutus rantai cabang kolesterol (P450scc); 17α-hidroksilase/17,20-lyase; 21-hidroksilase; atau 11β-hidroksilase.[54] Karena tidak bersifat aromatisasi (dan karenanya tidak dapat diubah menjadi metabolit estrogenik), tidak seperti noretisteron, 5α-DHNET telah diusulkan sebagai agen terapi potensial dalam pengobatan kanker payudara ER-positif.[54]
Aktifitas lain
[sunting | sunting sumber]Noretisteron adalah penghambat CYP2C9 dan CYP3A4 yang sangat lemah (masing-masing IC50 = 46 μM dan 51 μM), tetapi tindakan ini memerlukan konsentrasi noretisteron yang sangat tinggi yang jauh di atas tingkat sirkulasi terapeutik (yang berada dalam kisaran nanomolar) dan karenanya mungkin tidak relevan secara klinis.[3]
Noretisteron dan beberapa metabolit tereduksi 5α-nya diketahui menghasilkan efek vasodilatasi pada hewan yang tidak bergantung pada reseptor steroid seks dan karenanya tampaknya memiliki mekanisme non-genomik.[55]
Noretisteron merangsang proliferasi sel kanker payudara MCF-7 secara in vitro, suatu tindakan yang tidak bergantung pada PR klasik dan sebaliknya dimediasi melalui komponen membran reseptor progesteron-1 (PGRMC1).[56] Progestin tertentu lainnya bertindak serupa dalam pengujian ini, sedangkan progesteron bertindak netral.[56] Tidak jelas apakah temuan ini dapat menjelaskan perbedaan risiko kanker payudara yang diamati dengan progesteron dan progestin dalam uji klinis.[57]
Efek antigonadotropik
[sunting | sunting sumber]Karena aktivitas progestogeniknya, noretisteron menekan sumbu hipotalamus-hipofisis-gonad (sumbu HPG) dan karenanya memiliki efek antigonadotropik.[3][43] Aktivitas estrogenik noretisteron pada dosis tinggi juga diharapkan berkontribusi terhadap efek antigonadotropiknya.[58] Karena efek antigonadotropiknya, noretisteron menekan produksi hormon seks gonad, menghambat ovulasi pada wanita, dan menekan spermatogenesis pada pria.[3][43][59]
Dosis noretisteron oral dan NETA oral yang menghambat ovulasi adalah sekitar 0,5 mg/hari pada wanita.[3][60][61] Namun ada beberapa data yang bertentangan, yang menunjukkan bahwa dosis yang lebih tinggi mungkin diperlukan untuk menghambat ovulasi sepenuhnya.[62] Suntikan NETE 200 mg intramuskular telah terbukti mencegah ovulasi dan menekan kadar estradiol, progesteron, hormon pelutein (LH), dan hormon perangsang folikel (FSH) pada wanita.[63][64][65][66]
Studi awal tentang noretisteron oral pada pria yang menggunakan dosis 20 hingga 50 mg/hari mengamati penekanan ekskresi 17-ketosteroid, peningkatan ekskresi estrogen (karena konversi menjadi etinilestradiol); penekanan spermatogenesis, libido, dan fungsi ereksi; dan kejadian ginekomastia.[67][68][69][38][70] Dosis noretisteron oral 25 mg/hari selama 3 minggu pada pria telah dilaporkan menekan kadar testosteron sekitar 70%, hingga 100 hingga 200 ng/dL dalam waktu 4 atau 5 hari, serta menekan jumlah sperma dan tidak berpengaruh pada libido atau fungsi ereksi dalam jangka waktu singkat.[71][72] Pada pria muda yang sehat, NETA saja dengan dosis 5 hingga 10 mg/hari secara oral selama 2 minggu menekan kadar testosteron dari ~527 ng/dL hingga ~231 ng/dL (–56%).[73]

Suntikan NETE intramuskular 200 mg tunggal atau dalam kombinasi dengan 2 mg estradiol valerat telah terbukti menghasilkan penurunan kadar gonadotropin dan testosteron yang cepat, kuat, dan berkelanjutan hingga satu bulan pada pria.[59][75][76] Suntikan NETE 200 mg intramuskular setiap 3 minggu sekali juga terbukti menekan spermatogenesis pada pria.[67][77] Demikian pula, suntikan intramuskular tunggal 50 mg NETE yang dikombinasikan dengan 5 mg estradiol valerat terbukti sangat menekan kadar testosteron pada pria.[74] Kadar testosteron menurun dari ~503 ng/dL pada awal menjadi ~30 ng/dL pada titik terendah (–94%) yang terjadi pada hari ke 7 pasca injeksi.[74]
Farmakokinetik
[sunting | sunting sumber]Farmakokinetik noretisteron telah ditinjau.[3][78]
Penyerapan
[sunting | sunting sumber]Bioavailabilitas oral noretisteron adalah antara 47 dan 73%, dengan rata-rata bioavailabilitas oral 64%.[1][2] Mikronisasi telah ditemukan secara signifikan meningkatkan bioavailabilitas oral noretisteron dengan meningkatkan penyerapan usus dan mengurangi metabolisme usus.[3][79] Dosis tunggal noretisteron oral 2 mg telah ditemukan menghasilkan tingkat puncak sirkulasi obat sebesar 12 ng/mL (40 nmol/L), sedangkan dosis oral tunggal noretisteron 1 mg dalam kombinasi dengan 2 mg estradiol menghasilkan puncaknya. kadar noretisteron 8,5 ng/mL (29 nmol/L) satu jam pasca pemberian.[3]
Distribusi
[sunting | sunting sumber]Pengikatan protein plasma noretisteron adalah 97%. Ia terikat 61% terikat pada albumin dan 36% terikat pada SHBG.[3]
Metabolisme
[sunting | sunting sumber]Metabolisme dari noretisteron dan bakal obatnya pada manusia
|
Noretisteron memiliki waktu paruh biologis 5,2 hingga 12,8 jam; dengan waktu paruh eliminasi rata-rata 8,0 jam.[1] Metabolisme noretisteron sangat mirip dengan testosteron (dan nandrolon) dan terutama melalui reduksi ikatan ganda Δ4 menjadi 5α- dan 5β-dihidronoretisteron, yang diikuti dengan reduksi gugus fungsi keton C3 menjadi empat isomer 3,5-tetrahidronoretistero.[3] Biotransformasi ini dikatalisis oleh 5α- dan 5β-reduktase serta 3α- dan 3β-hidroksisteroid dehidrogenase baik di hati maupun di jaringan ekstrahepatik seperti kelenjar pituitari, rahim, kelenjar prostat, vagina, dan payudara.[89] Dengan pengecualian 3α,5α- dan 3β,5α-tetrahidronoretisteron, yang memiliki afinitas signifikan terhadap ER dan bersifat estrogenik sampai tingkat tertentu, metabolit 3,5-tetrahidro dari noretisteron tidak aktif dalam hal afinitas terhadap reseptor steroid seks (khususnya PR, AR, dan ER).[90][91][92] Sejumlah kecil noretisteron juga diubah oleh aromatase menjadi etinilestradiol.[1][3][39] Noretisteron juga dimetabolisme di hati melalui hidroksilasi, terutama oleh CYP3A4.[4] Beberapa konjugasi (termasuk glukuronidasi dan sulfasi)[89][93] noretisteron dan metabolitnya terjadi meskipun ada hambatan sterik oleh gugus etunil di C17α. Kelompok etinil noretisteron disimpan di sekitar 90% dari seluruh metabolitnya.[3]
Noretisteron digunakan dalam pil KB, berlawanan dengan progesteron itu sendiri, karena tidak dimetabolisme secepat progesteron bila dikonsumsi secara oral. Ketika progesteron dikonsumsi secara oral, ia dengan cepat dimetabolisme di saluran pencernaan dan hati, dan dipecah menjadi banyak metabolit berbeda. Padahal, noretisteron tidak dimetabolisme dengan cepat sehingga memungkinkan noretisteron hadir dalam jumlah yang lebih tinggi sehingga memungkinkannya bersaing secara lebih efektif untuk tempat pengikatan reseptor progesteron.[3]
Eliminasi
[sunting | sunting sumber]Noretisteron dieliminasi 33 hingga 81% melalui urin dan 35 hingga 43% melalui feses.[94]
Kimia
[sunting | sunting sumber]Noretisteron, juga dikenal sebagai 17α-etinil-19-nortestosteron atau sebagai 17α-etinilestra-4-en-17β-ol-3-ona, adalah steroid estran sintetik dan turunan testosteron. Steroid ini secara khusus merupakan turunan testosteron yang mana gugus etunil telah ditambahkan pada posisi C17α dan gugus metil pada posisi C19 telah dihilangkan; oleh karena itu, noretisteron merupakan turunan gabungan dari etisteron (17α-etiniltestosteron) dan nandrolon (19-nortestosteron).[95][96] Modifikasi ini menghasilkan peningkatan aktivitas progestogenik dan bioavailabilitas oral serta penurunan aktivitas androgenik/anabolik.[97]
Derivatif
[sunting | sunting sumber]Noretisteron (NET) adalah senyawa induk dari sekelompok besar progestin yang mencakup sebagian besar progestin yang dikenal sebagai turunan 19-nortestosteron.[98] Kelompok ini dibagi berdasarkan struktur kimianya menjadi estran (turunan dari noretisteron) dan gonan (18-metilgonan atau 13β-etilestran; turunan dari levonorgestrel) dan mencakup obat-obatan yang dipasarkan berikut ini:[99]
|
Beberapa di antaranya bertindak sebagai bakal obat dari noretisteron, termasuk NETA, NETE, etinodiol diasetat, linestrenol, dan kuingestanol asetat.[100][101][102] Noretinodrel mungkin juga merupakan bakal obat dari noretisteron.[3][1] NETA diminum seperti halnya noretisteron, sedangkan NETE diberikan melalui suntikan ke otot.[10]
Non-17α-etinilasi
[sunting | sunting sumber]Progestin 19-Nortestosteron (19-NT) yang secara teknis bukan turunan dari noretisteron (karena tidak memiliki gugus etunil C17α) namun masih berkerabat dekat (dengan substitusi lain pada posisi C17α dan/atau C16β) termasuk obat-obatan yang dipasarkan berikut ini :[95][96]
- Turunan vinil (etenil) C17, norgesteron (17α-vinil-δ5(10)-19-NT) dan norvinisteron (17α-vinil-19-NT)
- Turunan alil C17α alilestrenol (3-deketo-17α-alil-19-NT) dan altrenoges (17α-alil-δ9,11-19-NT)
- Normetandron turunan alkil C17α (17α-metil-19-NT)
- Dienoges turunan sianometil C17α (17α-sianometil-δ9-19-NT)
- Oksendolon turunan etil C16β (16β-etil-19-NT)
Banyak steroid anabolik dari keluarga 19-nortestosteron, seperti noretandrolon dan etilestrenol juga merupakan progestogen yang kuat, tetapi tidak pernah dipasarkan seperti itu.
Sintesis
[sunting | sunting sumber]Sintesis kimia noretisteron telah dipublikasikan.[95][78]
Sintesis 1
[sunting | sunting sumber]
Estradiol 3-metil eter (1, EME) sebagian direduksi menjadi 1,5-diena (2) seperti yang juga terjadi pada langkah pertama sintesis nandrolon. Oksidasi Oppenauer kemudian mengubah gugus hidroksil C17β menjadi fungsi keton (3). Ini kemudian direaksikan dengan logam asetilida menjadi senyawa etinil C17α yang sesuai (4). Hidrolisis enol eter dalam kondisi ringan mengarah langsung ke (5),[103] yang nampaknya adalah noretinodrel (meskipun Lednicer menyatakan bahwa itu adalah "etinodrel" dalam bukunya (yang mungkin merupakan sinonim etinodiol); etinodrel dengan klorin atom terpasang), suatu progestin yang aktif secara oral. Ini adalah komponen progestogen dari pil KB pertama yang ditawarkan untuk dijual (yaitu Enovid). Perlakuan terhadap etinil enol eter dengan asam kuat menghasilkan noretisteron (6).[11]
Dalam praktiknya, pil KB kombinasi ini dan semua kontrasepsi oral kombinasi lainnya adalah campuran 1 hingga 2% EE atau mestranol dan progestin oral. Ada spekulasi bahwa penemuan kebutuhan estrogen selain progestin untuk kemanjuran kontrasepsi disebabkan oleh adanya sejumlah kecil EME yang tidak tereduksi (1) pada batch awal 2. Hal ini bila mengalami oksidasi dan etinilasi, akan menyebabkan tentu saja mengarah ke mestranol (3). Bagaimanapun, kebutuhan akan adanya estrogen dalam campuran tersebut kini telah diketahui secara eksperimental.
Sintesis 2
[sunting | sunting sumber]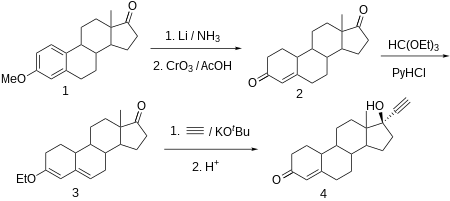
Noretisteron terbuat dari estr-4-ene-3,17-diona (bolandiona), yang selanjutnya disintesis melalui reduksi parsial daerah aromatik 3-O-metil eter estron dengan litium dalam amonia cair, dan secara bersamaan dari gugus keto di C17α menjadi gugus hidroksil, yang kemudian dioksidasi kembali menjadi gugus keto oleh kromium trioksida dalam asam asetat. Olefin C4-C5 terkonjugasi dan gugus karbonil pada C3 kemudian diubah menjadi dienol etil eter menggunakan etil ortoformat. Produk yang diperoleh dietinilasi oleh asetilena dengan adanya kalium ter-butoksida. Setelah hidrolisis hidroklorida dari turunan O-kalium yang terbentuk, di mana enol eter juga dihidrolisis, dan ikatan rangkap yang tersisa digeser, diperoleh noretisteron yang diinginkan.
Dalam Budaya Masyarakat
[sunting | sunting sumber]Nama Generik
[sunting | sunting sumber]Noretisteron adalah Nama Non-Kepemilikan Internasional dari INN dan BAN, sedangkan noretindron adalah Nama yang Diadopsi USAN.[95][96]
Nama-nama Merek
[sunting | sunting sumber]Noretisteron tersedia di Bangladesh sebagai Menogia (ACI), Normens (Renata), dll. Noretisteron (NET), termasuk sebagai NETA dan NETE, telah dipasarkan dengan banyak nama merek di seluruh dunia.[96][19]
Penelitian
[sunting | sunting sumber]Noretisteron, seperti NETA dan NETE, telah dipelajari untuk digunakan sebagai kontrasepsi laki-laki yang potensial dikombinasikan dengan testosteron pada pria.[109][110]
Mikrosfer noretisteron yang bekerja lama untuk injeksi intramuskular telah dipelajari untuk potensi penggunaan dalam pengendalian kelahiran.[111]
Referensi
[sunting | sunting sumber]- ^ a b c d e f g h Stanczyk FZ (September 2002). "Pharmacokinetics and potency of progestins used for hormone replacement therapy and contraception". Reviews in Endocrine & Metabolic Disorders. 3 (3): 211–24. doi:10.1023/A:1020072325818. PMID 12215716.
- ^ a b Fotherby K (August 1996). "Bioavailability of orally administered sex steroids used in oral contraception and hormone replacement therapy". Contraception. 54 (2): 59–69. doi:10.1016/0010-7824(96)00136-9. PMID 8842581.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak Kuhl H (August 2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration" (PDF). Climacteric. 8 (Suppl 1): 3–63. doi:10.1080/13697130500148875. PMID 16112947. Diarsipkan dari versi asli (PDF) tanggal 22 August 2016. Diakses tanggal 6 September 2018.
- ^ a b c d Korhonen T, Turpeinen M, Tolonen A, Laine K, Pelkonen O (May 2008). "Identification of the human cytochrome P450 enzymes involved in the in vitro biotransformation of lynestrenol and norethindrone". The Journal of Steroid Biochemistry and Molecular Biology. 110 (1–2): 56–66. doi:10.1016/j.jsbmb.2007.09.025. PMID 18356043.
- ^ a b c d Taitel HF, Kafrissen ME (1995). "Norethindrone--a review of therapeutic applications". International Journal of Fertility and Menopausal Studies. 40 (4): 207–23. PMID 8520623.
- ^ Alden KR, Lowdermilk DL, Cashion MC, Perry SE (27 December 2013). Maternity and Women's Health Care - E-Book. Elsevier Health Sciences. hlm. 135–. ISBN 978-0-323-29368-6. Diarsipkan dari versi asli tanggal 9 March 2023. Diakses tanggal 8 January 2018.
- ^ a b Kuhl H (September 1990). "Pharmacokinetics of oestrogens and progestogens". Maturitas. 12 (3): 171–197. doi:10.1016/0378-5122(90)90003-o. PMID 2170822.
- ^ https://www.accessdata.fda.gov/drugsatfda_docs/label/2007/018405s023lbl.pdf Diarsipkan 10 February 2017 di Wayback Machine. [URL PDF mentah]
- ^ a b c Jacobson BD (October 1962). "Hazards of norethindrone therapy during pregnancy". American Journal of Obstetrics and Gynecology. 84 (7): 962–8. doi:10.1016/0002-9378(62)90075-3. PMID 14450719.
- ^ a b c IARC Working Group on the Evaluation of Carcinogenic Risks to Humans; World Health Organization; International Agency for Research on Cancer (2007). Combined Estrogen-progestogen Contraceptives and Combined Estrogen-progestogen Menopausal Therapy. World Health Organization. hlm. 417–. ISBN 978-92-832-1291-1. Diarsipkan dari versi asli tanggal 10 January 2023. Diakses tanggal 12 October 2016.
Norethisterone and its acetate and enanthate esters are progestogens that have weak estrogenic and androgenic properties.
- ^ a b c d Djerassi C, Miramontes L, Rosenkranz G, Sondheimer F, Longo LD (January 2006). "Steroids LIV. Synthesis of 19-nor-17alpha-ethynyltestosterone and 19-nor-17alpha-methyltestosterone. 1954". American Journal of Obstetrics and Gynecology. 194 (1): 289; discussion 290. doi:10.1021/ja01645a010. PMID 16389045.
- ^ a b Shoupe D (7 November 2007). The Handbook of Contraception: A Guide for Practical Management. Springer Science & Business Media. hlm. 15–. ISBN 978-1-59745-150-5.
- ^ a b c d e Marks L (2010). Sexual Chemistry: A History of the Contraceptive Pill. Yale University Press. hlm. 74, 76. ISBN 978-0-300-16791-7.
- ^ a b William Andrew Publishing (22 October 2013). Pharmaceutical Manufacturing Encyclopedia, 3rd Edition. Elsevier. hlm. 2935–. ISBN 978-0-8155-1856-3.
- ^ Hatcher RA, Nelson AL (2007). Contraceptive Technology. Ardent Media. hlm. 195–. ISBN 978-1-59708-001-9. Diarsipkan dari versi asli tanggal 10 January 2023. Diakses tanggal 8 January 2018.
- ^ Gunasheela S (14 March 2011). Practical Management of Gynecological Problems. JP Medical Ltd. hlm. 31–. ISBN 978-93-5025-240-6. Diarsipkan dari versi asli tanggal 9 March 2023. Diakses tanggal 8 January 2018.
- ^ Grimes DA, Lopez LM, O'Brien PA, Raymond EG (November 2013). "Progestin-only pills for contraception". The Cochrane Database of Systematic Reviews (11): CD007541. doi:10.1002/14651858.CD007541.pub3. PMID 24226383.
- ^ Hussain SF (February 2004). "Progestogen-only pills and high blood pressure: is there an association? A literature review". Contraception. 69 (2): 89–97. doi:10.1016/j.contraception.2003.09.002. PMID 14759612.
- ^ a b "Norethisterone". Diarsipkan dari versi asli tanggal 15 September 2018. Diakses tanggal 8 January 2018.
- ^ "Generic Aygestin Availability". Diarsipkan dari versi asli tanggal 24 August 2018. Diakses tanggal 8 January 2018.
- ^ World Health Organization (2021). World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. hdl:10665/345533
 . WHO/MHP/HPS/EML/2021.02.
. WHO/MHP/HPS/EML/2021.02.
- ^ Kim JJ, Kurita T, Bulun SE (February 2013). "Progesterone action in endometrial cancer, endometriosis, uterine fibroids, and breast cancer". Endocrine Reviews. 34 (1): 130–62. doi:10.1210/er.2012-1043. PMC 3565104
 . PMID 23303565.
. PMID 23303565.
- ^ a b c d e Aronson JK (21 February 2009). Meyler's Side Effects of Endocrine and Metabolic Drugs. Elsevier. hlm. 217, 253, 275. ISBN 978-0-08-093292-7.
- ^ Hägglund H, Remberger M, Klaesson S, Lönnqvist B, Ljungman P, Ringdén O (December 1998). "Norethisterone treatment, a major risk-factor for veno-occlusive disease in the liver after allogeneic bone marrow transplantation". Blood. 92 (12): 4568–72. doi:10.1182/blood.V92.12.4568. PMID 9845522.
- ^ a b Cornia PB, Anawalt BD (November 2004). "Male hormonal contraception". Expert Opinion on Emerging Drugs. 9 (2): 335–344. doi:10.1517/14728214.9.2.335. PMID 15571489.
- ^ a b Cornia PB, Anawalt BD (2005). "Male hormonal contraceptives: a potentially patentable and profitable product". Expert Opinion on Therapeutic Patents. 15 (12): 1727–1737. doi:10.1517/13543776.15.12.1727. ISSN 1354-3776.
- ^ a b c Kamischke A, Heuermann T, Krüger K, von Eckardstein S, Schellschmidt I, Rübig A, Nieschlag E (February 2002). "An effective hormonal male contraceptive using testosterone undecanoate with oral or injectable norethisterone preparations". The Journal of Clinical Endocrinology and Metabolism. 87 (2): 530–539. doi:10.1210/jcem.87.2.8218
 . PMID 11836281.
. PMID 11836281.
- ^ a b Junkins-Hopkins JM (March 2010). "Hormone therapy for acne". Journal of the American Academy of Dermatology. 62 (3): 486–8. doi:10.1016/j.jaad.2009.12.002. PMID 20159314.
- ^ a b Arowojolu AO, Gallo MF, Lopez LM, Grimes DA (July 2012). Arowojolu AO, ed. "Combined oral contraceptive pills for treatment of acne". The Cochrane Database of Systematic Reviews (7): CD004425. doi:10.1002/14651858.CD004425.pub6. PMID 22786490.
- ^ van Vloten WA, Sigurdsson V (2004). "Selecting an oral contraceptive agent for the treatment of acne in women". American Journal of Clinical Dermatology. 5 (6): 435–41. doi:10.2165/00128071-200405060-00008. PMID 15663340.
- ^ a b Pochi PE, Strauss JS (December 1965). "Lack of androgen effect on human sebaceous glands with low-dosage norethindrone". American Journal of Obstetrics and Gynecology. 93 (7): 1002–4. doi:10.1016/0002-9378(65)90162-6. PMID 5843402.
- ^ a b c Kuhnz W, Heuner A, Hümpel M, Seifert W, Michaelis K (December 1997). "In vivo conversion of norethisterone and norethisterone acetate to ethinyl etradiol in postmenopausal women". Contraception. 56 (6): 379–85. doi:10.1016/s0010-7824(97)00174-1. PMID 9494772.
- ^ a b Curwen S (1962). "Virilization with Norethisterone". BMJ. 1 (5289): 1415. doi:10.1136/bmj.1.5289.1415-a. ISSN 0959-8138. PMC 1958463
 .
.
- ^ a b c Roxburgh DR, West MJ (August 1973). "The use of norethisterone to suppress menstruation in the intellectually severely retarded woman". The Medical Journal of Australia. 2 (7): 310–3. doi:10.5694/j.1326-5377.1973.tb128175.x. PMID 4746398. Diarsipkan dari versi asli tanggal 20 December 2016. Diakses tanggal 6 December 2016.
- ^ a b c Roxburgh DR, West MJ (August 1973). "The use of norethisterone to suppress menstruation in the intellectually severely retarded woman". The Medical Journal of Australia. 2 (7): 310–3. doi:10.1097/00006254-197408000-00021. PMID 4746398.
- ^ Board JA (April 1965). "Clinical Evaluation of the Oral Contraceptive Use of Norethindrone 5 Mg. Plus Mestranol 0.075 Mg". Canadian Medical Association Journal. 92 (15): 814–7. PMC 1927985
 . PMID 14272499.
. PMID 14272499.
- ^ Kaser DJ, Missmer SA, Berry KF, Laufer MR (April 2012). "Use of norethindrone acetate alone for postoperative suppression of endometriosis symptoms". Journal of Pediatric and Adolescent Gynecology. 25 (2): 105–108. doi:10.1016/j.jpag.2011.09.013. PMID 22154396.
- ^ a b Paulsen CA, Leach RB, Lanman J, Goldston N, Maddock WO, Heller CG (October 1962). "Inherent estrogenicity of norethindrone and norethynodrel: comparison with other synthetic progestins and progesterone". The Journal of Clinical Endocrinology and Metabolism. 22 (10): 1033–9. doi:10.1210/jcem-22-10-1033. PMID 13942007.
- ^ a b Chu MC, Zhang X, Gentzschein E, Stanczyk FZ, Lobo RA (June 2007). "Formation of ethinyl estradiol in women during treatment with norethindrone acetate". The Journal of Clinical Endocrinology and Metabolism. 92 (6): 2205–7. doi:10.1210/jc.2007-0044
 . PMID 17341557.
. PMID 17341557.
- ^ Connolly A, Britton AG (31 March 2017). Women's Health in Primary Care. Cambridge University Press. hlm. 153–. ISBN 978-1-108-16595-2.
- ^ a b Farris M, Bastianelli C, Rosato E, Brosens I, Benagiano G (October 2017). "Pharmacodynamics of combined estrogen-progestin oral contraceptives: 2. effects on hemostasis". Expert Review of Clinical Pharmacology. 10 (10): 1129–1144. doi:10.1080/17512433.2017.1356718. PMID 28712325.
- ^ https://www.accessdata.fda.gov/drugsatfda_docs/label/2014/016954s106lbl.pdf Diarsipkan 10 February 2017 di Wayback Machine. [URL PDF mentah]
- ^ a b c d e Kuhl H (2011). "Pharmacology of Progestogens" (PDF). J Reproduktionsmed Endokrinol. 8 (1): 157–177. Diarsipkan dari versi asli (PDF) tanggal 11 October 2016. Diakses tanggal 10 October 2016.
- ^ Chu YH, Li QA, Zhao ZF, Zhou YP, Cao DC (June 1985). "[Antiprogestational action of 5 alpha-dihydronorethisterone]". Zhongguo Yao Li Xue Bao = Acta Pharmacologica Sinica (dalam bahasa Tionghoa). 6 (2): 125–9. PMID 2934946.
- ^ McCuistion LE, Kee JL, Hayes ER (25 March 2014). Pharmacology: A Patient-Centered Nursing Process Approach. Elsevier Health Sciences. hlm. 846–. ISBN 978-0-323-29348-8.
- ^ Greenblatt RB (July 1956). "The progestational activity of 17-alpha-ethinyl-19-nortestosterone". The Journal of Clinical Endocrinology and Metabolism. 16 (7): 869–75. doi:10.1210/jcem-16-7-869. PMID 13332050.
- ^ Fragkaki AG, Angelis YS, Koupparis M, Tsantili-Kakoulidou A, Kokotos G, Georgakopoulos C (February 2009). "Structural characteristics of anabolic androgenic steroids contributing to binding to the androgen receptor and to their anabolic and androgenic activities. Applied modifications in the steroidal structure". Steroids. 74 (2): 172–97. doi:10.1016/j.steroids.2008.10.016. PMID 19028512.
Many synthetic steroids with high myotrophic activity exhibit myotrophic–androgenic dissociation, since, due to changes introduced in the structure of ring A, they will probably not be substrates for the 5α-reductases [85]. 5α-Reduction does not always amplify the androgenic potency in spite of high RBA of androgens to the AR. This is the case for norethisterone (Fig. 1, 34), a synthetic 19-nor-17α-ethynyl testosterone derivative, which also undergoes enzyme-mediated 5α-reduction and exerts potent androgenic effects in target organs. 5α-Reduced norethisterone displays a higher AR binding but shows a significantly lower androgenic potency than unchanged norethisterone [102,103].
- ^ a b c Lemus AE, Enríquez J, García GA, Grillasca I, Pérez-Palacios G (January 1997). "5alpha-reduction of norethisterone enhances its binding affinity for androgen receptors but diminishes its androgenic potency". The Journal of Steroid Biochemistry and Molecular Biology. 60 (1–2): 121–9. doi:10.1016/s0960-0760(96)00172-0. PMID 9182866.
- ^ Filshie M, Guillebaud J (22 October 2013). Contraception: Science and Practice. Elsevier Science. hlm. 26–. ISBN 978-1-4831-6366-6.
Norethisterone binds to SHBG with less affinity than endogenous androgens and oestrogens [...]
- ^ Azziz R (8 November 2007). Androgen Excess Disorders in Women. Springer Science & Business Media. hlm. 124–. ISBN 978-1-59745-179-6.
- ^ Kuiper GG, Carlsson B, Grandien K, Enmark E, Häggblad J, Nilsson S, Gustafsson JA (March 1997). "Comparison of the ligand binding specificity and transcript tissue distribution of estrogen receptors alpha and beta". Endocrinology. 138 (3): 863–70. doi:10.1210/endo.138.3.4979
 . PMID 9048584.
. PMID 9048584.
- ^ Wiegratz I, Kuhl H (September 2006). "Metabolic and clinical effects of progestogens". The European Journal of Contraception & Reproductive Health Care. 11 (3): 153–61. doi:10.1080/13625180600772741. PMID 17056444.
- ^ Giatti S, Melcangi RC, Pesaresi M (August 2016). "The other side of progestins: effects in the brain". Journal of Molecular Endocrinology. 57 (2): R109–26. doi:10.1530/JME-16-0061
 . PMID 27339142.
. PMID 27339142.
- ^ a b c Yamamoto T, Tamura T, Kitawaki J, Osawa Y, Okada H (June 1994). "Suicide inactivation of aromatase in human placenta and uterine leiomyoma by 5 alpha-dihydronorethindrone, a metabolite of norethindrone, and its effect on steroid-producing enzymes". European Journal of Endocrinology. 130 (6): 634–40. doi:10.1530/eje.0.1300634. PMID 8205267.
- ^ Perusquía M, Villalón CM, Navarrete E, García GA, Pérez-Palacios G, Lemus AE (August 2003). "Vasodilating effect of norethisterone and its 5 alpha metabolites: a novel nongenomic action". European Journal of Pharmacology. 475 (1–3): 161–9. doi:10.1016/s0014-2999(03)02106-x. PMID 12954372.
- ^ a b Neubauer H, Ma Q, Zhou J, Yu Q, Ruan X, Seeger H, et al. (October 2013). "Possible role of PGRMC1 in breast cancer development". Climacteric. 16 (5): 509–13. doi:10.3109/13697137.2013.800038. PMID 23758160.
- ^ Trabert B, Sherman ME, Kannan N, Stanczyk FZ (April 2020). "Progesterone and Breast Cancer". Endocrine Reviews. 41 (2): 320–344. doi:10.1210/endrev/bnz001
 . PMC 7156851
. PMC 7156851  . PMID 31512725.
. PMID 31512725.
- ^ Anderson RA, Baird DT (December 2002). "Male contraception" (PDF). Endocrine Reviews. 23 (6): 735–62. doi:10.1210/er.2002-0002
 . PMID 12466187. Diarsipkan dari versi asli (PDF) tanggal 28 August 2021. Diakses tanggal 11 December 2019.
. PMID 12466187. Diarsipkan dari versi asli (PDF) tanggal 28 August 2021. Diakses tanggal 11 December 2019.
- ^ a b Kamischke A, Nieschlag E (January 2004). "Progress towards hormonal male contraception". Trends in Pharmacological Sciences. 25 (1): 49–57. doi:10.1016/j.tips.2003.11.009. PMID 14723979.
- ^ Rudel HW (September 1968). "Pharmacology of oral contraceptives". Clinical Obstetrics and Gynecology. 11 (3): 632–44. doi:10.1097/00003081-196811030-00002. PMID 4878826.
- ^ Stanczyk FZ (November 2003). "All progestins are not created equal". Steroids. 68 (10–13): 879–90. doi:10.1016/j.steroids.2003.08.003. PMID 14667980.
- ^ Endrikat J, Gerlinger C, Richard S, Rosenbaum P, Düsterberg B (December 2011). "Ovulation inhibition doses of progestins: a systematic review of the available literature and of marketed preparations worldwide". Contraception. 84 (6): 549–57. doi:10.1016/j.contraception.2011.04.009. PMID 22078182.
- ^ Shoupe D (1993). "Injectable Contraceptives and Contraceptive Vaginal Rings". Contraception. Clinical Perspectives in Obstetrics and Gynecology. Springer. hlm. 144–157. doi:10.1007/978-1-4612-2730-4_13. ISBN 978-1-4612-7645-6. ISSN 0178-0328.
- ^ Weiner E, Johansson ED (April 1975). "Plasma levels of norethindrone after i.m. injection of 200 mg norethindrone enanthate". Contraception. 11 (4): 419–25. doi:10.1016/0010-7824(75)90004-9. PMID 1122756.
- ^ Fotherby K, Howard G, Shrimanker K, Elder M, Bye PG (December 1977). "Effect of norethisterone oenanthate on serum gonadotrophin levels". Contraception. 16 (6): 591–604. doi:10.1016/0010-7824(77)90060-9. PMID 606499.
- ^ Goebelsmann U, Stanczyk FZ, Brenner PF, Goebelsmann AE, Gentzschein EK, Mishell DR (March 1979). "Serum norethindrone (NET) concentrations following intramuscular NET enanthate injection. Effect upon serum LH, FSH, estradiol and progesterone". Contraception. 19 (3): 283–313. doi:10.1016/0010-7824(79)90022-2. PMID 572279.
- ^ a b Neumann F, Diallo FA, Hasan SH, Schenck B, Traore I (1976). "The influence of pharmaceutical compounds on male fertility". Andrologia. 8 (3): 203–235. doi:10.1111/j.1439-0272.1976.tb02137.x
 . PMID 793446.
. PMID 793446.
- ^ Heller CG, Laidlaw WM, Harvey HT, Nelson WO (July 1958). "Effects of progestational compounds on the reproductive processes of the human male". Annals of the New York Academy of Sciences. 71 (5): 649–65. doi:10.1111/j.1749-6632.1958.tb54641.x. PMID 13583821.
- ^ Heller CG, Moore DJ, Paulsen CA, Nelson WO, Laidlaw WM (December 1959). "Effects of progesterone and synthetic progestins on the reproductive physiology of normal men". Federation Proceedings. 18: 1057–65. PMID 14400846. Diarsipkan dari versi asli tanggal 18 December 2018. Diakses tanggal 11 December 2019.
- ^ Paulsen CA (March 1965). "Progestin Metabolism: Special Reference to Estrogenic Pathways". Metabolism. 14 (3): SUPPL:313–9. doi:10.1016/0026-0495(65)90018-1. PMID 14261416.
- ^ Moudgal NR, Suresh R (1995). "Some thoughts on development of chemically based male contraceptives" (PDF). Current Science (Bangalore). 68 (4): 470–474. ISSN 0011-3891. Diarsipkan dari versi asli (PDF) tanggal 11 December 2019. Diakses tanggal 11 December 2019.
- ^ Johonsson ED, Nygren KG (1973). "Depression of plasma testosterone levels in men with norethindrone". Contraception. 8 (3): 219–226. doi:10.1016/0010-7824(73)90032-2. ISSN 0010-7824.
- ^ Zitzmann M, Rohayem J, Raidt J, Kliesch S, Kumar N, Sitruk-Ware R, Nieschlag E (May 2017). "Impact of various progestins with or without transdermal testosterone on gonadotropin levels for non-invasive hormonal male contraception: a randomized clinical trial". Andrology. 5 (3): 516–526. doi:10.1111/andr.12328
 . PMID 28189123.
. PMID 28189123.
- ^ a b c Efecto de una Dosis de 50 mg de Enantato de Noretisterona y 5 mg de Valerato de Estradiol en los Niveles de Testosterona Total en Hombres Mexicanos Sanos (Tesis MSc). National Polytechnic Institute of Mexico. 11 May 2011. http://repositoriodigital.ipn.mx/handle/123456789/12490. Diakses pada 12 September 2022.
- ^ Amory JK (2003). "Androgens and Male Contraception". Androgens in Health and Disease. Contemporary Endocrinology. Humana Press. hlm. 405–417. doi:10.1007/978-1-59259-388-0_21. ISBN 978-1-61737-314-5.
- ^ Kamischke A, Diebäcker J, Nieschlag E (September 2000). "Potential of norethisterone enanthate for male contraception: pharmacokinetics and suppression of pituitary and gonadal function". Clinical Endocrinology. 53 (3): 351–358. doi:10.1046/j.1365-2265.2000.01097.x. PMID 10971453.
- ^ Petry R, Mauss J, Senge T, Rausch-Stroomann JG (1970). "Influence of Cyproterone-acetate, Norethisterone-enanthate and Gestonorone-capronate on the Hypophyseal-Gonadal-Axis in the Male". Über den Einfluß von Cyproteronacetat, Norethisteronönanthat und Gestonoroncapronat auf die Hypophysen-Gonadenachse beim Mann [Influence of Cyproterone-acetate, Norethisterone-enanthate and Gestonorone-capronate on the Hypophyseal-Gonadal-Axis in the Male]. Endokrinologie der Entwicklung und Reifung. Symposion der Deutschen Gesellschaft für Endokrinologie in Ulm vom 26.—28. Februar 1970. Springer. hlm. 428–430. doi:10.1007/978-3-642-80591-2_118. ISBN 9783642805912.
- ^ a b Die Gestagene. Springer-Verlag. 27 November 2013. hlm. 13–14,283–284. ISBN 978-3-642-99941-3. Diarsipkan dari versi asli tanggal 10 January 2023. Diakses tanggal 19 September 2018.
- ^ Saperstein S, Edgren RA, Jung D, Mroszczak EJ, Lee GJ, Dorr A, Pritchard R, Kushinsky S, Fong JC, Combs DL (December 1989). "Pharmacokinetics of norethindrone: effect of particle size". Contraception. 40 (6): 731–40. doi:10.1016/0010-7824(89)90075-9. PMID 2620531.
- ^ Friedrich C, Berse M, Klein S, Rohde B, Höchel J (June 2018). "In Vivo Formation of Ethinylestradiol After Intramuscular Administration of Norethisterone Enantate". Journal of Clinical Pharmacology. 58 (6): 781–789. doi:10.1002/jcph.1079. PMID 29522253.
- ^ Thijssen JH (September 1972). "Metabolism of Orally Active Synthetic Progestational Compounds". Dalam Tausk M. Pharmacology of the Endocrine System and Related Drugs: Progesterone, Progestational Drugs and Antifertility Agents. II. Pergamon Press. hlm. 217–273. ISBN 978-0080168128. OCLC 278011135.
- ^ Okada H (2010). "Receptors and Mechanism Action of Synthetic Progestogens". Asia-Oceania Journal of Obstetrics and Gynaecology. 7 (1): 15–27. doi:10.1111/j.1447-0756.1981.tb00511.x. ISSN 0389-2328.
- ^ Briggs MH (1980). "Comparative Pharmacodynamics and Pharmacokinetics of Contraceptive Steroids in Animals and Man: A Selective Review". Clinical Pharmacology & Therapeutics. Palgrave Macmillan UK. hlm. 493–518. doi:10.1007/978-1-349-05952-2_57. ISBN 978-1-349-05954-6.
- ^ Thomas JA, Keenan EJ (1986). "Progestins and Oral Contraceptives". Principles of Endocrine Pharmacology. Springer. hlm. 167–196. doi:10.1007/978-1-4684-5036-1_8. ISBN 978-1-4684-5036-1.
- ^ Orme ML, Back DJ, Breckenridge AM (1983). "Clinical pharmacokinetics of oral contraceptive steroids". Clinical Pharmacokinetics. 8 (2): 95–136. doi:10.2165/00003088-198308020-00001. PMID 6342899.
- ^ Fotherby K (1974). "Metabolism of synthetic steroids by animals and man". Acta Endocrinologica. Supplementum. 185: 119–147. doi:10.1530/acta.0.075s119. PMID 4206183.
- ^ Kuhl H, Wiegratz I (August 2007). "Can 19-nortestosterone derivatives be aromatized in the liver of adult humans? Are there clinical implications?". Climacteric. 10 (4): 344–353. doi:10.1080/13697130701380434. PMID 17653961.
- ^ Stanczyk FZ, Roy S (July 1990). "Metabolism of levonorgestrel, norethindrone, and structurally related contraceptive steroids". Contraception. 42 (1): 67–96. doi:10.1016/0010-7824(90)90093-B. PMID 2143719.
- ^ a b Schoonen WG, Deckers GH, de Gooijer ME, de Ries R, Kloosterboer HJ (November 2000). "Hormonal properties of norethisterone, 7alpha-methyl-norethisterone and their derivatives". The Journal of Steroid Biochemistry and Molecular Biology. 74 (4): 213–22. doi:10.1016/s0960-0760(00)00125-4. PMID 11162927.
[...] several mono- and disulphated as well as mono- and diglucuronidated metabolites of NET have been detected in urine from NET treated women [16,17]. In unconjugated form these NET (or MeNET) metabolites are represented by 5α- and 5β-reduced NET (5α-NET or 5β-NET) and by 3α- and 3β-hydrogenated 5α-NET and 5β-NET, leading to 3α,5α-NET, 3β,5α-NET, 3α,5β-NET and 3β,5β-NET or their corresponding MeNET metabolites (Figs. 1 and 2). These steroid conversions of NET or MeNET may take place in the liver, but also in the pituitary, endometrium, prostate, vagina and breast. The enzymes involved in these metabolic processes are 5α- and 5β-reductase as well as 3α- and 3β-hydroxysteroid dehydrogenase (HSD).
- ^ Chávez BA, Vilchis F, Pérez AE, García GA, Grillasca I, Pérez-Palacios G (January 1985). "Stereospecificity of the intracellular binding of norethisterone and its A-ring reduced metabolites". Journal of Steroid Biochemistry. 22 (1): 121–6. doi:10.1016/0022-4731(85)90151-7
 . PMID 3871879.
. PMID 3871879.
- ^ Garza-Flores J, Vilchis F, García GA, Menjívar M, Pérez-Palacios G (June 1986). "A-ring reduction enhances the antigonadotropic potency of norethisterone". Acta Endocrinologica. 112 (2): 278–83. doi:10.1530/acta.0.1120278. PMID 3090814.
- ^ Lemus AE, Enríquez J, Hernández A, Santillán R, Pérez-Palacios G (February 2009). "Bioconversion of norethisterone, a progesterone receptor agonist into estrogen receptor agonists in osteoblastic cells". The Journal of Endocrinology. 200 (2): 199–206. doi:10.1677/JOE-08-0166
 . PMID 19008332.
. PMID 19008332.
- ^ Scarsi KK, Darin KM, Chappell CA, Nitz SM, Lamorde M (November 2016). "Drug-Drug Interactions, Effectiveness, and Safety of Hormonal Contraceptives in Women Living with HIV". Drug Safety. 39 (11): 1053–1072. doi:10.1007/s40264-016-0452-7. PMC 5048570
 . PMID 27562873.
. PMID 27562873.
- ^ DeGroot LJ (2001). Endocrinology. W.B. Saunders Co. hlm. 2617. ISBN 978-0-7216-7843-6.
- ^ a b c d Elks J (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. hlm. 886–. ISBN 978-1-4757-2085-3. Diarsipkan dari versi asli tanggal 10 January 2023. Diakses tanggal 5 October 2016.
- ^ a b c d Index Nominum 2000: International Drug Directory. Taylor & Francis. January 2000. hlm. 749–. ISBN 978-3-88763-075-1.
- ^ Chwalisz K, Surrey E, Stanczyk FZ (June 2012). "The hormonal profile of norethindrone acetate: rationale for add-back therapy with gonadotropin-releasing hormone agonists in women with endometriosis". Reproductive Sciences. 19 (6): 563–71. doi:10.1177/1933719112438061. PMID 22457429.
- ^ Shoupe D, Haseltine FP (6 December 2012). Contraception. Springer Science & Business Media. hlm. 112–. ISBN 978-1-4612-2730-4.
- ^ Ryan KJ (1999). Kistner's Gynecology and Women's Health. Mosby. hlm. 292. ISBN 978-0-323-00201-1.
- ^ Hammerstein J (December 1990). "Prodrugs: advantage or disadvantage?". American Journal of Obstetrics and Gynecology. 163 (6 Pt 2): 2198–203. doi:10.1016/0002-9378(90)90561-K. PMID 2256526.
- ^ Edelman AB, Cherala G, Stanczyk FZ (October 2010). "Metabolism and pharmacokinetics of contraceptive steroids in obese women: a review". Contraception. 82 (4): 314–23. doi:10.1016/j.contraception.2010.04.016. PMID 20851224.
- ^ Raynaud JP, Ojasoo T (November 1986). "The design and use of sex-steroid antagonists". Journal of Steroid Biochemistry. 25 (5B): 811–33. doi:10.1016/0022-4731(86)90313-4. PMID 3543501.
Similar androgenic potential is inherent to norethisterone and its prodrugs (norethisterone acetate, ethynodiol diacetate, lynestrenol, norethynodrel, quingestanol [acetate]).
- ^ a b Frank B. Colton, U.S. Patent 2,655,518 (1952 to Searle & Co).
- ^ Ringold HJ, Rosenkranz G, Sondheimer F (1956). "Steroids. LXXX.11-Methyl-19-nortestosterone and 1-Methyl-17α-ethinyl-19-nortestosterone". Journal of the American Chemical Society. 78 (11): 2477–2479. doi:10.1021/ja01592a037.
- ^ Ueberwasser H, Heusler K, Kalvoda J, Meystre C, Wieland P, Anner G, Wettstein A (1963). "19-Norsteroide II. Ein einfaches Herstellungsverfahren für 19-Norandrostan-Derivate. über Steroide, 193. Mitteilung". Helvetica Chimica Acta. 46: 344–352. doi:10.1002/hlca.19630460135.
- ^ Onken D, Heublein D (January 1970). "[Ethinylated steroids]". Die Pharmazie. 25 (1): 3–9. PMID 4914401.
- ^ U.S. Patent 2.744.122
- ^ U.S. Patent 2.774.777
- ^ Nieschlag E (November 2010). "Clinical trials in male hormonal contraception" (PDF). Contraception. 82 (5): 457–70. doi:10.1016/j.contraception.2010.03.020. PMID 20933120. Diarsipkan dari versi asli (PDF) tanggal 5 December 2020. Diakses tanggal 28 December 2018.
- ^ Nieschlag E, Behre HM, Nieschlag E, Behre HM, Nieschlag S (2012). Nieschlag E, Behre HM, Nieschlag S, ed. "The essential role of testosterone in hormonal male contraception". Testosterone: 470–493. doi:10.1017/CBO9781139003353.023. ISBN 9781139003353.
- ^ Benagiano G, Primiero FM (June 1983). "Long acting contraceptives. Present status". Drugs. 25 (6): 570–609. doi:10.2165/00003495-198325060-00003. PMID 6223801.
Bacaan Lebih Lanjut
[sunting | sunting sumber]- Brogden RN, Speight TM, Avery GS (1973). "Progestagen-only oral contraceptives: a preliminary report of the action and clinical use of norgestrel and norethisterone". Drugs. 6 (3): 169–81. doi:10.2165/00003495-197306030-00004. PMID 4130566.
- "Norethisterone and norethisterone acetate". IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Humans. 21: 441–60. December 1979. PMID 120838.
- Stanczyk FZ, Roy S (July 1990). "Metabolism of levonorgestrel, norethindrone, and structurally related contraceptive steroids". Contraception. 42 (1): 67–96. doi:10.1016/0010-7824(90)90093-b. PMID 2143719.
- Wiseman LR, McTavish D (March 1994). "Transdermal estradiol/norethisterone. A review of its pharmacological properties and clinical use in postmenopausal women". Drugs & Aging. 4 (3): 238–56. doi:10.2165/00002512-199404030-00006. PMID 8199397.
- Taitel HF, Kafrissen ME (1995). "Norethindrone--a review of therapeutic applications". International Journal of Fertility and Menopausal Studies. 40 (4): 207–23. PMID 8520623.
- Maier WE, Herman JR (August 2001). "Pharmacology and toxicology of ethinyl estradiol and norethindrone acetate in experimental animals". Regulatory Toxicology and Pharmacology. 34 (1): 53–61. doi:10.1006/rtph.2001.1483. PMID 11502156.
- Riis BJ, Lehmann HJ, Christiansen C (October 2002). "Norethisterone acetate in combination with estrogen: effects on the skeleton and other organs. A review". American Journal of Obstetrics and Gynecology. 187 (4): 1101–16. doi:10.1067/mob.2002.122852. PMID 12389012.
- Draper BH, Morroni C, Hoffman M, Smit J, Beksinska M, Hapgood J, Van der Merwe L (July 2006). "Depot medroxyprogesterone versus norethisterone oenanthate for long-acting progestogenic contraception". The Cochrane Database of Systematic Reviews (3): CD005214. doi:10.1002/14651858.CD005214.pub2. PMID 16856087.
- Kuhl H, Wiegratz I (August 2007). "Can 19-nortestosterone derivatives be aromatized in the liver of adult humans? Are there clinical implications?". Climacteric. 10 (4): 344–53. doi:10.1080/13697130701380434. PMID 17653961.
- Casey CL, Murray CA (2008). "HT update: spotlight on estradiol/norethindrone acetate combination therapy". Clinical Interventions in Aging. 3 (1): 9–16. doi:10.2147/cia.s1663
 . PMC 2544373
. PMC 2544373  . PMID 18488874.
. PMID 18488874. - Paulen ME, Curtis KM (October 2009). "When can a woman have repeat progestogen-only injectables--depot medroxyprogesterone acetate or norethisterone enantate?". Contraception. 80 (4): 391–408. doi:10.1016/j.contraception.2009.03.023. PMID 19751863.
- Chwalisz K, Surrey E, Stanczyk FZ (June 2012). "The hormonal profile of norethindrone acetate: rationale for add-back therapy with gonadotropin-releasing hormone agonists in women with endometriosis". Reproductive Sciences. 19 (6): 563–71. doi:10.1177/1933719112438061. PMID 22457429.
![Kadar noretisteron dan etinilestradiol selama 24 jam setelah dosis oral tunggal 10 mg NETA pada wanita pascamenopause.[32]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e5/Norethisterone_and_ethinylestradiol_levels_after_a_single_oral_dose_of_10_mg_norethisterone_acetate_in_postmenopausal_women.png/450px-Norethisterone_and_ethinylestradiol_levels_after_a_single_oral_dose_of_10_mg_norethisterone_acetate_in_postmenopausal_women.png)
![Kadar noretisteron dan etinilestradiol selama 8 minggu setelah injeksi intramuskular tunggal 200 mg NETE pada wanita pramenopause.[80]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Norethisterone_and_ethinylestradiol_levels_after_a_single_intramuscular_injection_of_200_mg_norethisterone_enanthate_in_premenopausal_women.png/450px-Norethisterone_and_ethinylestradiol_levels_after_a_single_intramuscular_injection_of_200_mg_norethisterone_enanthate_in_premenopausal_women.png)

