Pentafluoruro di rutenio
| Pentafluoruro di rutenio | |
|---|---|
 | |
| Nome IUPAC | |
| pentafluoruro di rutenio | |
| Nomi alternativi | |
| fluoruro di rutenio(V) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | F5Ru |
| Peso formula (u) | 196,06 |
| Aspetto | solido verde scuro[1] |
| Numero CAS | |
| Numero EINECS | 238-533-8 |
| PubChem | 15797579 e 101946419 |
| SMILES | F[Ru](F)(F)(F)F |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | 86,5 °C (360 K)[1] |
| Temperatura di ebollizione | 227 °C (500 K)[1] |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | -893,5[2] |
| Indicazioni di sicurezza | |
Il pentafluoruro di rutenio è il composto inorganico con formula RuF5. In questo fluoruro il rutenio è nello stato di ossidazione +5. In condizioni normali è un solido volatile di colore verde scuro; allo stato vapore è incolore.[1][3] È un composto estremamente reattivo, senza usi pratici, pericoloso da utilizzare dato che reagisce formando fluoro e acido fluoridrico.
Sintesi
[modifica | modifica wikitesto]Il composto fu preparato per la prima volta nel 1925 da Otto Ruff e Ernst Vidic facendo reagire fluoro su rutenio spugnoso.[4] Più conveniente risulta la sintesi diretta di Holloway e Peacock del 1963:[5] il rutenio metallico reagisce con un flusso di fluoro diluito con azoto, a circa 300 ºC. Si forma un olio viscoso verde scuro, dal quale RuF5 è separato per distillazione sotto vuoto.
- 2 Ru + 5 F2 → 2 RuF5
Struttura
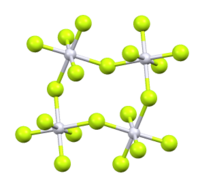
[modifica | modifica wikitesto]RuF5 allo stato solido forma tetrameri (RuF5)4 formati da ottaedri RuF6 uniti da atomi di fluoro condivisi (vedi figura).[1][3] La struttura cristallina risulta monoclina, con costanti di reticolo a = 549,7 pm, b = 994,6 pm e c = 1253,1 pm, otto unità di formula per cella elementare.[6] In fase gassosa a 120 ºC sono presenti principalmente molecole trimere, assieme a una quantità minore di dimeri.[1][7]
Proprietà e reattività
[modifica | modifica wikitesto]RuF5 è un composto estremamente reattivo; si può maneggiare in recipienti di vetro a temperatura ambiente, ma già a 100 ºC il vetro è attaccato. È molto sensibile all'umidità e in acqua si idrolizza rapidamente formando RuO2 idrato e RuO4 gassoso.[5][8]
Reagisce con XeF2 (un fortissimo donatore di fluoro), formando vari composti ionici, a seconda dei rapporti stechiometrici utilizzati:[9]
- 2 XeF2 + RuF5 → [Xe2F3]+[RuF6]–
- XeF2 + RuF5 → [XeF]+[RuF6]–
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- (EN) W. J. Casteel Jr., A. P. Wilkinson, H. Borrmann, R. E. Serfass e N. Bartlett, Preparation and structure of ruthenium tetrafluoride and a structural comparison with ruthenium trifluoride and ruthenium pentafluoride, in Inorg. Chem., vol. 31, n. 14, 1992, pp. 3124–3131, DOI:10.1021/ic00040a024.
- (EN) F. A. Cotton, G. Wilkinson, C. A. Murillo e M. Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley-Interscience, 1999, ISBN 978-0471199571.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) J. H. Holloway e R. D. Peacock, Ruthenium pentafluoride and ruthenium oxytetrafluoride, in J. Chem. Soc., 1963, pp. 527-530, DOI:10.1039/JR9630000527.
- (EN) J. H. Holloway e J. G. Knowles, Reactions of xenon difluoride with the pentafluorides of tantalum, niobium, ruthenium, and osmium, in J. Chem. Soc. A, 1969, pp. 756-761, DOI:10.1039/J19690000756.
- (EN) E. M. Page, D. A. Rice, M. J. Almond, K. Hagen e altri, Gas-phase electron diffraction study of ruthenium(V) fluoride and osmium(V) fluoride, in Inorg. Chem., vol. 32, n. 20, 1993, pp. 4311–4316, DOI:10.1021/ic00072a026.
- (EN) H. A. Porte, E. Greenberg e W. N. Hubbard, Fluorine Bomb Calorimetry. XII. The Enthalpy of Formation of Ruthenium Pentafluoride, in J. Phys. Chem., vol. 69, n. 7, 1965, pp. 2308-2310, DOI:10.1021/j100891a029.
- (DE) O. Ruff e E. Vidic, Das Rutheniumpentafluorid und ein Verfahren zur Trennung von Platin und Ruthenium, in Z. Anorg. Allg. Chem., vol. 143, n. 1, 1925, pp. 163-182, DOI:10.1002/zaac.19251430112.
- G. Stanger, Preparation and Characterisation of the Platinum Group Metal Fluorides, Tesi di Dottorato, Università di Leicester (PDF), su lra.le.ac.uk, 1988. URL consultato il 18 dicembre 2018 (archiviato dall'url originale il 1º novembre 2018).