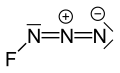Fluor azid
| |||
| Називи | |||
|---|---|---|---|
| Други називи
triazadienil fluorid
| |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| |||
| |||
| Својства | |||
| FN 3 | |||
| Моларна маса | 61,019 g/mol | ||
| Агрегатно стање | Žuto-zeleni gas | ||
| Тачка топљења | −139 °C (−218 °F; 134 K) | ||
| Тачка кључања | −30 °C (−22 °F; 243 K) | ||
| Експлозивност | |||
| Осетљивост на шок | Ekstremno | ||
| Осетљивост на трење | Ekstremno | ||
| Опасности | |||
| Главне опасности | Ekstremno osetljiv eksploziv | ||
| NFPA 704 | |||
| Сродна једињења | |||
Други катјони
|
Hidrazoinska kiselina Hlor azid Bromin azid Jod azid | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |||
| Референце инфокутије | |||
Fluor-azid ili triazadienil fluorid je žutozeleni gas sastavljen od azota i fluora sa formulom FN
3. [3] Njegova svojstva podsećaju na svojstva ClN
3, BrN
3 i IN
3. [4] Veza između atoma fluora i azota je veoma slaba, što dovodi do toga da je ova supstanca veoma nestabilna i sklona eksploziji. [5] Proračuni pokazuju da je ugao F–N–N oko 102° sa pravom linijom od 3 atoma azota. [6]
Gas ključa na −30 °C (−22 °F; 243 K) i topi se na −139 °C (−218 °F; 134 K). [7]
Prvi ga je napravio Džon F. Haler 1942. [8]
Istorija
[уреди | уреди извор]Fluorazid zauzima poseban položaj među halogenim azidima jer je njegova N3 grupa pozitivno polarizovana. Kao poslednje jedinjenje ove klase supstanci, sintetizovao ga je 1942. DŽon F. Haler reakcijom HN3 sa fluorom. Pošto se fluorazid razlaže u gasnoj fazi na sobnoj temperaturi i eksplodira izuzetno lako u kondenzovanom stanju, čista reprezentacija i detaljnija karakterizacija, kao i tačno određivanje spektroskopskih podataka, kao i vrednosti tačke topljenja i ključanja, postignuti su tek 1990-ih. [9]
Reakcije
[уреди | уреди извор]Fluor-azid se može dobiti reakcijom hidrazojeve kiseline ili natrijum-azida sa gasovitim fluorom. [7][10]
- HN
3 + F
2 → N
3F + HF - NaN
3 + F
2 → N
3F + NaF
Fluor azid se razlaže bez eksplozije na normalnim temperaturama da bi napravio dizot difluorid:
- 2 FN
3 → N
2F
2 + 2 N
2. [3]
Na višim temperaturama kao što je 1.000 °C (1.830 °F; 1.270 K) fluor azid se raspada u azot monofluorid radikal: [10]
- FN
3 → NF + N
2
Sam FN se dimerizira pri hlađenju.
- 2 NF → N
2F
2
Čvrsti ili tečni FN
3 može eksplodirati, oslobađajući veliku količinu energije. Tanak film gori brzinom od 1,6 km/s. [11] Zbog opasnosti od eksplozije, istovremeno treba rukovati samo vrlo malim količinama ove supstance. [12]
FN
3 adukti se mogu formirati sa Luisovim kiselinama bor trifluoridom (BF
3) i pentafluoridom arsena (AsF
5) na −196 °C (−320,8 °F; 77,1 K). Ovi molekuli se vezuju za Nα atom. [13]
Svojstva
[уреди | уреди извор]Spektroskopija
[уреди | уреди извор]| Parametar | Vrednost [12] | Jedinica |
| A | 48131.448 | MHz |
| B | 5713.266 | MHz |
| C | 5095.276 | MHz |
| μa | 1.1 | |
| μb | 0.7 |
Oblik
[уреди | уреди извор]Udaljenosti između atoma su F–N 0.1444 nm, FN=NN 0.1253 nm i FNN=N 0,1132 nm. [12]
Fizički
[уреди | уреди извор]FN
3 ima gustinu od 1.3 g/cm3. [14]
FN
3 se adsorbuje na čvrste površine kalijum fluorida, ali ne i na litijum fluorid ili natrijum fluorid. Ovo svojstvo se istražuje kako bi FN
3 mogao da poveća energiju čvrstog goriva. [14]
Ultraljubičasti fotoelektrični spektar pokazuje pikove jonizacije na 11,01, 13,72, 15,6, 15,9, 16,67, 18,2 i 19.7 eV. Respektivno, ovi se dodeljuju orbitalama: π, nN ili nF, nF, πF, nN ili σ, π i σ.[5]
Upotreba
[уреди | уреди извор]Fluorazid se egzotermno disocira na azot i elektronski pobuđene NF molekule, tako da se potencijalno može koristiti za napajanje hemijskih lasera visoke energije. [9]
Reference
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б Gipstein, Edward; John F. Haller (1966). „Absorption Spectrum of Fluorine Azide”. Applied Spectroscopy. 20 (6): 417—418. Bibcode:1966ApSpe..20..417G. ISSN 0003-7028. S2CID 96337253. doi:10.1366/000370266774386470.
- ^ Saxena, P. B. (2007-01-01). Chemistry of Interhalogen Compounds. Discovery Publishing House. стр. 96. ISBN 9788183562430. Приступљено 16. 6. 2014.
- ^ а б Rademacher, Paul; Andreas J. Bittner; Gabriele Schatte; Helge Willner (1988). „Photoelectron Spectrum and Electronic Structure of Triazadienyl Fluoride, N3F”. Chemische Berichte. 121 (3): 555—557. ISSN 0009-2940. doi:10.1002/cber.19881210325.
- ^ Peters, Nancy J. S.; Leland C. Allen; Raymond A. Firestone (1988). „Fluorine azide and fluorine nitrate: structure and bonding”. Inorganic Chemistry. 27 (4): 755—758. ISSN 0020-1669. doi:10.1021/ic00277a035.
- ^ а б Gholivand, Khodayar; Gabriele Schatte; Helge Willner (1987). „Properties of triazadienyl fluoride, N3F”. Inorganic Chemistry. 26 (13): 2137—2140. ISSN 0020-1669. doi:10.1021/ic00260a025.
- ^ Lowe, Derek (21. 10. 2008). „Things I Won't Work With: Triazadienyl Fluoride.”. In the Pipeline. Приступљено 15. 6. 2014.
- ^ а б Schatte, Gabriele; Willner, Helge (1991). „Die Wechselwirkung von N3F mit Lewis-Säuren und HF. N3F als möglicher Vorläufer für die Synthese von N3 +-Salzen / The Interaction of N3F with Lewis-Acids and HF. N3F as Possible Precursor for the Synthesis of N3 + Salts”. Zeitschrift für Naturforschung B. 46 (4): 483—489. doi:10.1515/znb-1991-0410..
- ^ а б Benard, D. J.; B. K. Winker; T. A. Seder; R. H. Cohn (1989). „Production of nitrogen monofluoride (a1Δ) by dissociation of fluorine azide”. The Journal of Physical Chemistry. 93 (12): 4790—4796. ISSN 0022-3654. doi:10.1021/j100349a022.
- ^ Seder, T.A.; D.J. Benard (1991). „The decomposition of condensed phase fluorine azide”. Combustion and Flame. 85 (3–4): 353—362. ISSN 0010-2180. doi:10.1016/0010-2180(91)90139-3.
- ^ а б в Christen, Dines.; H. G. Mack; G. Schatte; H. Willner (1988). „Structure of triazadienyl fluoride, FN3, by microwave, infrared, and ab initio methods”. Journal of the American Chemical Society. 110 (3): 707—712. ISSN 0002-7863. doi:10.1021/ja00211a007.
- ^ Schatte, G.; H. Willner (1991). „Die Wechselwirkung von N3F mit Lewis-Säuren und HF. N3F als möglicher Vorläufer für die Synthese von N3+-Salzen = The interaction of N3F with Lewis acids and HF•N3F as possible precursor for the synthesis of N3+ salts”. Zeitschrift für Naturforschung B (на језику: немачки). 46 (4): 483—489. ISSN 0932-0776. S2CID 97045269. doi:10.1515/znb-1991-0410
 .
.
- ^ а б Brener, Nathan E.; Kestner, Neil R.; Callaway, Joseph (децембар 1990). Theoretical Studies of Highly Energetic CBES Materials: Final Report for the Period 2 March 1987 to 31 May 1987 (PDF). Louisiana State University, Department of Physics and Astronomy. стр. 21—27. Архивирано (PDF) из оригинала 3. 3. 2016. г. Приступљено 25. 6. 2014.
Bibliografija
[уреди | уреди извор]- D. J. Benard, B. K. Winker, T. A. Seder, R. H. Cohn (1989). „Production of nitrogen monofluoride (a1Δ) by dissociation of fluorine azide”. J. Phys. Chem. 93 (na jeziku: енглески) (12): 4790—4796. doi:10.1021/j100349a022.
- N. G. Connelly, T. Damhus, R. M. Hartshorn, A. T. Hutton (urednici) (2005). Nomenclature of Inorganic Chemistry - IUPAC Recommendations 2005 (PDF) (na jeziku: енглески). Cambridge, UK: RCS Publishing. ISBN 0-85404-438-8.
- K. Gholivand, G. Schatte, H. Willner (1987). „Properties of triazadienyl fluoride, N
3F”. Inorg. Chem. 26 (na jeziku: енглески) (13): 2137—2140. doi:10.1021/ic00260a025. - A. Hammerl, T. M. Klapötke (2006). „Nitrogen: Inorganic Chemistry”. Encyclopedia of Inorganic Chemistry (na jeziku: енглески) (2 izd.). John Wiley & Sons. ISBN 9780470862100. doi:10.1002/0470862106.ia157.
- A. F. Holleman, N. Wiberg (2007). Lehrbuch der Anorganischen Chemie (na jeziku: немачки). Berlin: Walter de Gruyter. ISBN 978-3-11-017770-1.
Literatura
[уреди | уреди извор]- Химическая энциклопедия. 1. М.: Советская энциклопедия. Редкол.: Кнунянц И. Л. и др. 1988.
- Справочник химика. 2 (3-е изд., испр изд.). Л.: Химия. Редкол.: Никольский Б. П. и др. 1971.
- Гринвуд Н., Эрншо А. (2008). Химия элементов. 1. Бином. Лаборатория знаний. ISBN 978-5-94774-373-9.
Spoljašnje veze
[уреди | уреди извор] Медији везани за чланак Fluor azid на Викимедијиној остави
Медији везани за чланак Fluor azid на Викимедијиној остави