Cấu trúc và bộ gen của HIV
Bộ gen và protein của HIV (virus gây suy giảm miễn dịch ở người) là chủ đề của nghiên cứu sâu rộng kể từ khi phát hiện ra virus này vào năm 1983.[1][2] "Trong quá trình tìm kiếm tác nhân gây bệnh, ban đầu người ta tin rằng virus này là một dạng của virus ung thư bạch cầu tế bào T ở người (HTLV), vào thời điểm đó được biết đến có ảnh hưởng đến hệ thống miễn dịch của con người và gây ra các bệnh bạch cầu nhất định. Tuy nhiên, các nhà nghiên cứu tại Viện Pasteur ở Paris đã phân lập được một loại retrovirus chưa được biết đến và khác biệt về mặt di truyền ở bệnh nhân AIDS mà sau này được đặt tên là HIV. " [3] Mỗi virion bao gồm một màng bọc virus và ma trận liên quan bao quanh một capsid, nó chứa hai bản sao của bộ gen RNA chuỗi đơn và một số enzyme. Việc phát hiện ra virus này đã xảy ra hai năm sau báo cáo về các trường hợp mắc bệnh AIDS đầu tiên.[4][5]
Cấu trúc
[sửa | sửa mã nguồn]Chuỗi hoàn chỉnh của bộ gen HIV-1, được chiết xuất từ virion truyền nhiễm, đã được giải quyết thành phân giải nucleotide đơn.[6] Bộ gen HIV mã hóa một số lượng nhỏ protein virut, luôn thiết lập mối liên kết hợp tác giữa các protein HIV và giữa các protein HIV và vật chủ để xâm chiếm tế bào chủ và chiếm quyền điều khiển tế bào của chúng.[7]
HIV có cấu trúc khác với các retrovirus khác. Virion HIV có đường kính ~ 100 nm. Vùng trong cùng của nó bao gồm một lõi hình nón bao gồm hai bản sao của bộ gen ssRNA (cảm giác tích cực), enzyme phiên mã ngược, integrase và protease, một số protein nhỏ và protein lõi chính.[8] Bộ gen của virus gây suy giảm miễn dịch ở người (HIV) mã hóa 8 protein virut đóng vai trò thiết yếu trong vòng đời của HIV.[7]

HIV-1 bao gồm hai bản sao RNA đơn chuỗi không liên kết, không ghép nối, ý nghĩa dương được bao bọc bởi một capsid hình nón bao gồm protein p24 của virus, điển hình của lentivirus.[9][10] Thành phần RNA dài 9749 nucleotide [11][12] và có nắp 5 ' (Gppp), đuôi 3' poly (A) và nhiều khung đọc mở (ORF).[13] Các protein cấu trúc virus được mã hóa bằng các ORF dài, trong khi các ORF nhỏ hơn mã hóa các bộ điều chỉnh của vòng đời của virut: đính kèm, hợp nhất màng, sao chép và lắp ráp.
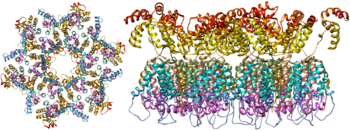
RNA chuỗi đơn này có liên kết chặt chẽ với protein nucleocapsid p7, protein lắp ráp muộn p6 và các enzyme cần thiết cho sự phát triển của virion, chẳng hạn như transcriptase ngược và integrase. Lysine tRNA là chính của enzyme sao chép ngược phụ thuộc magnesi.[9] Nucleocapsid liên kết với RNA genomic (một phân tử trên hexamer) và bảo vệ RNA khỏi bị các nuclease tiêu hóa. Cũng nằm trong hạt virion là Vif, Vpr, Nef và protease virus. Một ma trận bao gồm sự liên kết của protein virut p17 bao quanh capsid, đảm bảo tính toàn vẹn của hạt virion. Điều này lần lượt được bao quanh bởi một phong bì có nguồn gốc tế bào chủ. Màng bọc được hình thành khi capsid chồi ra từ tế bào chủ, và lấy đi một số màng tế bào chủ. Màng bọc bao gồm glycoprotein gp120 và gp41, chịu trách nhiệm liên kết và xâm nhập vào tế bào chủ.
Là protein duy nhất trên bề mặt của virus, glycoprotein bao (gp120 và gp41) là mục tiêu chính cho các nỗ lực chế tạo vắc-xin HIV.[14] Hơn một nửa khối lượng của lớp vỏ bọc trimeric là glycans liên kết N. Mật độ cao khi các glycan che chắn protein virus bên dưới khỏi sự trung hòa bằng kháng thể. Đây là một trong những phân tử glycosyl hóa dày đặc nhất được biết đến và mật độ đủ cao để ngăn chặn quá trình trưởng thành bình thường của glycans trong quá trình sinh học trong bộ máy endoplasmic và Golgi.[15][16] Do đó, phần lớn các glycan bị ngưng trệ là glycans 'mannose' chưa trưởng thành thường không có trên glycoprotein người được tiết ra hoặc trên bề mặt tế bào.[17] Việc xử lý bất thường và mật độ cao này có nghĩa là hầu như tất cả các kháng thể trung hòa rộng rãi đã được xác định cho đến nay (từ một tập hợp bệnh nhân đã bị nhiễm bệnh trong nhiều tháng đến nhiều năm) liên kết với hoặc được điều chỉnh để đối phó với các glycan bao này.[18]
Cấu trúc phân tử của đột biến virus hiện đã được xác định bằng phương pháp tinh thể học tia X [19] và kính hiển vi điện tử cryo.[20] Những tiến bộ trong sinh học cấu trúc này đã được thực hiện do sự phát triển của các dạng tái tổ hợp ổn định của sự tăng đột biến của virus bằng cách đưa ra một liên kết disubphide interubunit và một isoleucine để đột biến proline trong gp41.[21] Cái gọi là trimers SOSIP không chỉ tái tạo các đặc tính kháng nguyên của đột biến virus bản địa mà còn hiển thị cùng mức độ glycans chưa trưởng thành như được trình bày trên virus bản địa.[22] Các gai virus trimeric tái tổ hợp là ứng cử viên vắc-xin đầy hứa hẹn vì chúng hiển thị ít epitopes không trung hòa hơn so với gp120 monomeric tái tổ hợp có tác dụng ức chế đáp ứng miễn dịch với epitopes đích.[23]
Tham khảo
[sửa | sửa mã nguồn]- ^ Barré-Sinoussi F, Chermann JC, Rey F, Nugeyre MT, Chamaret S, Gruest J, Dauguet C, Axler-Blin C, Vézinet-Brun F, Rouzioux C, Rozenbaum W, Montagnier L (tháng 5 năm 1983). “Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS)”. Science. 220 (4599): 868–71. Bibcode:1983Sci...220..868B. doi:10.1126/science.6189183. PMID 6189183.
- ^ Gallo RC, Sarin PS, Gelmann EP, Robert-Guroff M, Richardson E, Kalyanaraman VS, Mann D, Sidhu GD, Stahl RE, Zolla-Pazner S, Leibowitch J, Popovic M (tháng 5 năm 1983). “Isolation of human T-cell leukemia virus in acquired immune deficiency syndrome (AIDS)”. Science. 220 (4599): 865–7. Bibcode:1983Sci...220..865G. doi:10.1126/science.6601823. PMID 6601823.
- ^ Churi, C.; Ross, M. W. (2015). Whelehan, P. (biên tập). The international encyclopedia of human sexuality. Wiley. ISBN 9781405190060. OCLC 949701914.
- ^ Centers for Disease Control (tháng 6 năm 1981). “Pneumocystis pneumonia--Los Angeles”. MMWR. Morbidity and Mortality Weekly Report. 30 (21): 250–2. PMID 6265753.
- ^ Centers for Disease Control (CDC) (tháng 7 năm 1981). “Kaposi's sarcoma and Pneumocystis pneumonia among homosexual men--New York City and California” (PDF). MMWR. Morbidity and Mortality Weekly Report. 30 (25): 305–8. PMID 6789108. Bản gốc (PDF) lưu trữ ngày 22 tháng 10 năm 2012. Truy cập ngày 15 tháng 9 năm 2017.
- ^ Watts JM, Dang KK, Gorelick RJ, Leonard CW, Bess JW, Swanstrom R, Burch CL, Weeks KM (tháng 8 năm 2009). “Architecture and secondary structure of an entire HIV-1 RNA genome”. Nature. 460 (7256): 711–6. Bibcode:2009Natur.460..711W. doi:10.1038/nature08237. PMC 2724670. PMID 19661910.
- ^ a b Li G, De Clercq E (tháng 9 năm 2016). “HIV Genome-Wide Protein Associations: a Review of 30 Years of Research”. Microbiology and Molecular Biology Reviews. 80 (3): 679–731. doi:10.1128/MMBR.00065-15. PMC 4981665. PMID 27357278.
- ^ Singleton, P.; Sainsbury, D. biên tập (2006). “Hiv”. Dictionary of microbiology & molecular biology (ấn bản thứ 3). Hoboken, NJ: Wiley. ISBN 9780470035450. OCLC 71223221.
- ^ a b Montagnier, Luc (1999). “Human Immunodeficiency Viruses (Retroviridae)”. Encyclopedia of Virology (ấn bản thứ 2). tr. 763–774.
- ^ Lu K, Heng X, Summers MF (tháng 7 năm 2011). “Structural determinants and mechanism of HIV-1 genome packaging”. Journal of Molecular Biology. 410 (4): 609–33. doi:10.1016/j.jmb.2011.04.029. PMC 3139105. PMID 21762803.
- ^ Wain-Hobson S, Sonigo P, Danos O, Cole S, Alizon M (tháng 1 năm 1985). “Nucleotide sequence of the AIDS virus, LAV”. Cell. 40 (1): 9–17. doi:10.1016/0092-8674(85)90303-4. PMID 2981635.
- ^ Ratner L, Haseltine W, Patarca R, Livak KJ, Starcich B, Josephs SF, Doran ER, Rafalski JA, Whitehorn EA, Baumeister K (1985). “Complete nucleotide sequence of the AIDS virus, HTLV-III”. Nature. 313 (6000): 277–84. Bibcode:1985Natur.313..277R. doi:10.1038/313277a0. PMID 2578615.
- ^ “HIV (Human Immunodeficiency Virus)”. Encyclopedia of Cancer. 2 (ấn bản thứ 2). 2002. tr. 407–415.
- ^ “Crystal structure of key HIV protein reveals new prevention, treatment targets” (Thông cáo báo chí). ngày 17 tháng 6 năm 1998. Bản gốc lưu trữ ngày 19 tháng 2 năm 2006. Truy cập ngày 14 tháng 9 năm 2006.
- ^ Behrens AJ, Vasiljevic S, Pritchard LK, Harvey DJ, Andev RS, Krumm SA, Struwe WB, Cupo A, Kumar A, Zitzmann N, Seabright GE, Kramer HB, Spencer DI, Royle L, Lee JH, Klasse PJ, Burton DR, Wilson IA, Ward AB, Sanders RW, Moore JP, Doores KJ, Crispin M (tháng 3 năm 2016). “Composition and Antigenic Effects of Individual Glycan Sites of a Trimeric HIV-1 Envelope Glycoprotein”. Cell Reports (bằng tiếng Anh). 14 (11): 2695–706. doi:10.1016/j.celrep.2016.02.058. PMC 4805854. PMID 26972002.
- ^ Pritchard LK, Spencer DI, Royle L, Bonomelli C, Seabright GE, Behrens AJ, Kulp DW, Menis S, Krumm SA, Dunlop DC, Crispin DJ, Bowden TA, Scanlan CN, Ward AB, Schief WR, Doores KJ, Crispin M (tháng 6 năm 2015). “Glycan clustering stabilizes the mannose patch of HIV-1 and preserves vulnerability to broadly neutralizing antibodies”. Nature Communications. 6: 7479. Bibcode:2015NatCo...6.7479P. doi:10.1038/ncomms8479. PMC 4500839. PMID 26105115.
- ^ Pritchard LK, Harvey DJ, Bonomelli C, Crispin M, Doores KJ (tháng 9 năm 2015). “Cell- and Protein-Directed Glycosylation of Native Cleaved HIV-1 Envelope”. Journal of Virology. 89 (17): 8932–44. doi:10.1128/JVI.01190-15. PMC 4524065. PMID 26085151.
- ^ Crispin M, Doores KJ (tháng 4 năm 2015). “Targeting host-derived glycans on enveloped viruses for antibody-based vaccine design”. Current Opinion in Virology. Viral pathogenesis • Preventive and therapeutic vaccines. 11: 63–9. doi:10.1016/j.coviro.2015.02.002. PMC 4827424. PMID 25747313.
- ^ Julien JP, Cupo A, Sok D, Stanfield RL, Lyumkis D, Deller MC, Klasse PJ, Burton DR, Sanders RW, Moore JP, Ward AB, Wilson IA (tháng 12 năm 2013). “Crystal structure of a soluble cleaved HIV-1 envelope trimer”. Science. 342 (6165): 1477–83. Bibcode:2013Sci...342.1477J. doi:10.1126/science.1245625. PMC 3886632. PMID 24179159.
- ^ Lyumkis D, Julien JP, de Val N, Cupo A, Potter CS, Klasse PJ, Burton DR, Sanders RW, Moore JP, Carragher B, Wilson IA, Ward AB (tháng 12 năm 2013). “Cryo-EM structure of a fully glycosylated soluble cleaved HIV-1 envelope trimer”. Science. 342 (6165): 1484–90. Bibcode:2013Sci...342.1484L. doi:10.1126/science.1245627. PMC 3954647. PMID 24179160.
- ^ Sanders RW, Derking R, Cupo A, Julien JP, Yasmeen A, de Val N, Kim HJ, Blattner C, de la Peña AT, Korzun J, Golabek M, de Los Reyes K, Ketas TJ, van Gils MJ, King CR, Wilson IA, Ward AB, Klasse PJ, Moore JP (tháng 9 năm 2013). “A next-generation cleaved, soluble HIV-1 Env trimer, BG505 SOSIP.664 gp140, expresses multiple epitopes for broadly neutralizing but not non-neutralizing antibodies”. PLOS Pathogens. 9 (9): e1003618. doi:10.1371/journal.ppat.1003618. PMC 3777863. PMID 24068931.
- ^ Pritchard LK, Vasiljevic S, Ozorowski G, Seabright GE, Cupo A, Ringe R, Kim HJ, Sanders RW, Doores KJ, Burton DR, Wilson IA, Ward AB, Moore JP, Crispin M (tháng 6 năm 2015). “Structural Constraints Determine the Glycosylation of HIV-1 Envelope Trimers”. Cell Reports. 11 (10): 1604–13. doi:10.1016/j.celrep.2015.05.017. PMC 4555872. PMID 26051934.
- ^ de Taeye SW, Ozorowski G, Torrents de la Peña A, Guttman M, Julien JP, van den Kerkhof TL, Burger JA, Pritchard LK, Pugach P, Yasmeen A, Crampton J, Hu J, Bontjer I, Torres JL, Arendt H, DeStefano J, Koff WC, Schuitemaker H, Eggink D, Berkhout B, Dean H, LaBranche C, Crotty S, Crispin M, Montefiori DC, Klasse PJ, Lee KK, Moore JP, Wilson IA, Ward AB, Sanders RW (tháng 12 năm 2015). “Immunogenicity of Stabilized HIV-1 Envelope Trimers with Reduced Exposure of Non-neutralizing Epitopes”. Cell. 163 (7): 1702–15. doi:10.1016/j.cell.2015.11.056. PMC 4732737. PMID 26687358.
 GIẢM
11%
GIẢM
11%
 GIẢM
32%
GIẢM
32%
 GIẢM
24%
GIẢM
24%
 GIẢM
22%
GIẢM
22%
 GIẢM
40%
GIẢM
40%

![[Review] Đường Mây Qua Xứ Tuyết: Điểm giống và khác giữa Phật giáo Tây Tạng với Phật giáo Việt Nam](https://down-bs-vn.img.susercontent.com/d582778a882305f006031617fc0a69d5.webp)



