Rucaparib
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Phát âm | /ruːˈkæpərɪb/ roo-KAP-ər-ib |
| Tên thương mại | Rubraca |
| Đồng nghĩa | AG014699 |
| AHFS/Drugs.com | entry |
| Dược đồ sử dụng | By mouth (tablets) |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Dữ liệu dược động học | |
| Sinh khả dụng | 30–45% (Tmax = 1.9 hours) |
| Liên kết protein huyết tương | 70% (in vitro) |
| Chuyển hóa dược phẩm | Gan (primarily CYP2D6; 1A2 và 3A4 to a lesser extent) |
| Chu kỳ bán rã sinh học | 17–19 hours[1] |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Phối tử ngân hàng dữ liệu protein | |
| ECHA InfoCard | 100.247.490 |
| Dữ liệu hóa lý | |
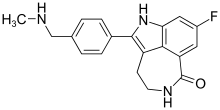
| Công thức hóa học | C19H18FN3O |
| Khối lượng phân tử | 323,37 g·mol−1 |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
Rucaparib (tên thương hiệu Rubraca /ruːˈbrɑːkə/ roo-BRAH -kə) là một chất ức chế PARP sử dụng như một tác nhân chống ung thư. Rucaparib là một loại dược phẩm hạng nhất nhắm đến enzyme sửa chữa DNA poly-ADP ribose polymerase-1 (PARP-1). Nó được phát hiện như một phần của sự hợp tác giữa các nhà khoa học làm việc tại Viện nghiên cứu ung thư và y học phía Bắc của Đại học Newcastle và Dược phẩm Agouron ở San Diego, California.[2] Nó đang được phát triển bởi Clovis Oncology.
Vào tháng 12 năm 2016, FDA Hoa Kỳ đã cấp phê duyệt nhanh cho việc sử dụng trong các trường hợp ung thư buồng trứng tiến triển trước điều trị.[3]
Ở châu Âu, nó được chỉ định là một sản phẩm thuốc mồ côi vào ngày 10 tháng 10 năm 2012. Vào ngày 22 tháng 3 năm 2018, Ủy ban Sản phẩm Thuốc cho Người sử dụng (CHMP) đã thông qua một ý kiến tích cực, khuyến nghị cấp giấy phép tiếp thị có điều kiện, dành cho điều trị ung thư buồng trứng tái phát hoặc tiến triển.[4]
Nó có thể được dùng bằng đường uống ở dạng viên nén.[5]
Dược lý
[sửa | sửa mã nguồn]Cơ chế hoạt động
[sửa | sửa mã nguồn]Rucaparib ức chế "sự co thắt của cơ trơn mạch máu bị cô lập, bao gồm cả từ khối u của bệnh nhân ung thư. Nó cũng làm giảm sự di chuyển của một số bệnh ung thư và tế bào bình thường trong nuôi cấy. " [6]
Là một chất ức chế PARP, rucaparib dự kiến sẽ có hiệu quả hơn trong 9% bệnh ung thư tuyến tụy có đột biến BRCA (BRCA1 hoặc BRCA2).[7]
Thông tin về các quy định
[sửa | sửa mã nguồn]Các thử nghiệm lâm sàng
[sửa | sửa mã nguồn]Năm 2013, tổng cộng 106 bệnh nhân từ sáu quốc gia khác nhau đã tham gia thử nghiệm giai đoạn II (ARIEL2) để đánh giá hoạt động của thuốc điều tra ở những phụ nữ mắc bệnh buồng trứng tiến triển nhạy cảm với bạch kim, ống dẫn trứng hoặc ung thư phúc mạc nguyên phát. Vào năm 2015, dữ liệu ban đầu từ ARIEL2 đã được trình bày tại ASCO, đại diện cho chỉ định trị liệu đột phá. Trong số 106 bệnh nhân trong nghiên cứu, 52 đối tượng không cho thấy bất kỳ tác dụng phụ nào, chẳng hạn như tử vong hoặc tiến triển bệnh. Trong số 52 bệnh nhân này, 18 đối tượng đã ngừng điều trị vì lý do cá nhân.[8]
Trong quý đầu tiên của năm 2016, các ứng dụng tiếp thị đã được gửi để chứng minh việc điều trị ung thư buồng trứng tiến triển ở những phụ nữ mắc bệnh đột biến BRCA đột biến dương tính (BRCAmut +). Vào tháng 6 năm 2016, một NDA đã được đệ trình với FDA và ngày PDUFA được chỉ định cho tháng 2 năm 2017. Tuy nhiên, thật đáng ngạc nhiên, rucaparib đã được cấp tình trạng theo dõi nhanh và được FDA chấp thuận vào tháng 12 năm 2016 khi điều trị đơn trị liệu cho những bệnh nhân được đề cập đã điều trị ≥2 hóa trị liệu trước đó. Hơn nữa, FDA cũng đã phê duyệt Thử nghiệm CDxBRCA FoundationF Focus như là chẩn đoán đồng hành dựa trên trình tự thế hệ tiếp theo (NGS) để xác định bệnh nhân ung thư buồng trứng mạnh nhất đáp ứng với liệu pháp rucaparib.[9]
Sau khi được FDA chấp thuận, các nghiên cứu TRITON2 và TRITON3 mCRPC đã được bắt đầu để xác định bệnh nhân ung thư tuyến tiền liệt sẽ đáp ứng với thuốc rucaparib như thế nào. Các nghiên cứu cho hai thử nghiệm này vẫn đang diễn ra và ngày ước tính cho kết quả đầu tiên đang hoành hành từ năm 2019 đến năm 2022.[10]
ARIEL3 và ARIEL4 là hai nghiên cứu ngẫu nhiên, mù đôi pha III. Nghiên cứu ARIEL3 được thiết kế để đánh giá hiệu quả của tác nhân điều tra như là một điều trị duy trì cho bệnh nhân ung thư buồng trứng nhạy cảm với bạch kim so với giả dược sau khi đáp ứng với 2 hóa trị liệu trước đó. Các kết quả hàng đầu từ nghiên cứu đã được trình bày tại đại hội ESMO 2017 và ngay sau đó, nó đã được công bố trên tạp chí Lancet vào tháng 9 năm 2017. Các phát hiện cho thấy sự cải thiện đáng kể trong tỷ lệ sống không tiến triển (PFS) ở những bệnh nhân được điều trị bằng Rubraca so với giả dược. Gần đây, vào tháng 10 năm 2017, một sNDA bổ sung cho điều trị duy trì rucaparib ARIEL3 đã được đệ trình lên FDA.[11]
Thử nghiệm ARIEL4 vẫn đang tiếp tục để đánh giá bệnh nhân sẽ đáp ứng tốt nhất với điều trị bằng rucaparib so với hóa trị như thế nào. Ngày thu thập dữ liệu ước tính cho đo lường kết quả chính sẽ là vào tháng 6 năm 2022.[12]
Thương mại hóa
[sửa | sửa mã nguồn]Rucaparib là một loại thuốc theo toa đang được thương mại hóa dưới tên thương hiệu Rubraca® bởi một công ty dược phẩm sinh học có tên là Clovis Oncology, Inc. (NASDAQ: CLVS). Mục tiêu cao nhất của công ty là phát hiện, phát triển và thương mại hóa các loại thuốc chống khối u mới.[13] Họ tin rằng, việc đưa ra phương pháp điều trị đúng cho bệnh nhân phù hợp là tương lai của liệu pháp điều trị ung thư ", Patrick J. Mahaffy, Chủ tịch và Giám đốc điều hành của Clovis nói.[14]
Khía cạnh thương mại
[sửa | sửa mã nguồn]Clovis đã báo cáo một khoản lỗ ròng đáng kể kể từ khi thành lập, nhưng trong năm 2017, họ đã chuyển sang lợi nhuận dựa vào doanh thu từ loại thuốc duy nhất được bán trên thị trường của họ, Rubraca. Vào tháng 1 năm 2017, công ty đã bán được 5.750.000 cổ phiếu (41,00 đô la mỗi cổ phiếu) và số tiền thu được ròng của họ là 221,2 triệu đô la. Hơn nữa, vào tháng 6 năm 2017, họ đã bán 3.920.454 cổ phiếu (88,00 đô la mỗi cổ phiếu) với số tiền thu được là $ 324,9 triệu. Mục tiêu của công ty là dành số tiền thu được được đề cập từ việc cung cấp cho chi phí tiếp thị và bán hàng liên quan đến Rubraca.[15]
Vào tháng 6 năm 2011, Pfizer đã công bố một thỏa thuận với Clovis Oncology Inc., cho phép công ty trì hoãn các khoản thanh toán cột mốc phải trả khi có sự chấp thuận theo quy định của NDA. Clovis cũng đã được cấp phép từ AstraZeneca vào tháng 4 năm 2012 để phát triển thuốc rucaparib cho một số phương pháp điều trị bệnh nhân bị ức chế PARP. Trong quý đầu tiên của năm 2017, Clovis đã trả 0,75 triệu đô la thanh toán cho Pfizer. Công ty cũng đã cam kết trả khoản thanh toán cột mốc 20,0 triệu đô la khi được FDA chấp thuận. Tuy nhiên, Clovis đã đồng ý trả thêm 3.0 triệu đô la trong vòng 18 tháng với hy vọng kiếm được lợi nhuận đáng kể bằng cách bán Rubraca.[16]
Sở hữu trí tuệ
[sửa | sửa mã nguồn]Có tổng cộng tám bằng sáng chế của Văn phòng Bằng sáng chế và Thương hiệu Hoa Kỳ (USPTO) và một NDA cho rucaparib được bán trên thị trường.[17]
Các bằng sáng chế liên quan đến các phương pháp sản xuất, sử dụng các phương pháp, viên nén cường độ cao, công thức và nhiều dạng muối / đa hình của thuốc, có ngày hết hạn từ năm 2022-2035. Ví dụ, bằng sáng chế liên quan đến thành phần của vật chất sẽ hết hạn vào năm 2020 và họ bằng sáng chế muối / đa hình camsylate được cấp phép từ Pfizer sẽ hết hạn vào năm 2031. Đơn xin cấp bằng sáng chế bổ sung vẫn đang chờ xử lý tại Hoa Kỳ hoặc Châu Âu ở nhiều khu vực pháp lý khác nhau, nếu được ban hành, sẽ có ngày hết hạn từ năm 2029 đến năm 2033.[18]
Xem thêm
[sửa | sửa mã nguồn]Tham khảo
[sửa | sửa mã nguồn]- ^ “Rubraca (rucaparib) Tablets, for Oral Use. Full Prescribing Information” (PDF). Clovis Oncology, Inc. Boulder, CO 80301. Bản gốc (PDF) lưu trữ ngày 8 tháng 8 năm 2018. Truy cập ngày 20 tháng 12 năm 2016.
- ^ White, AW; Almassy, R; Calvert, AH; Curtin, NJ; Griffin, RJ; Hostomsky, Z; Maegley, K; Newell, DR; Srinivasan, S (ngày 2 tháng 11 năm 2000). “Resistance-Modifying Agents. 9. Synthesis and Biological Properties of Benzimidazole Inhibitors of the DNA Repair Enzyme Poly(ADP-ribose) Polymerase”. Journal of Medicinal Chemistry. 43 (22): 4084–97. doi:10.1021/jm000950v. PMID 11063605.
- ^ Bankhead, C (ngày 19 tháng 12 năm 2016). “PARP Inhibitor Gets FDA Nod for Ovarian Cancer”. MedPage Today, LLC. Truy cập ngày 20 tháng 12 năm 2016.
- ^ “Bản sao đã lưu trữ”. Bản gốc lưu trữ ngày 29 tháng 5 năm 2018. Truy cập ngày 6 tháng 9 năm 2021. Đã bỏ qua tham số không rõ
|=(trợ giúp) - ^ “Cancer Research Launches New Drug Trial”. netdoctor.co.uk. Hearst Magazines UK. ngày 10 tháng 1 năm 2012. Bản gốc lưu trữ ngày 26 tháng 12 năm 2017. Truy cập ngày 20 tháng 12 năm 2016.
- ^ “Archived copy” (PDF). Bản gốc (PDF) lưu trữ ngày 13 tháng 6 năm 2011. Truy cập ngày 17 tháng 11 năm 2009. Đã bỏ qua tham số không rõ
|=(trợ giúp)Quản lý CS1: bản lưu trữ là tiêu đề (liên kết) - ^ “Rucaparib shows clinical benefit in pancreatic cancer patients with BRCA mutation: Results suggest a potential -- and much-needed -- treatment option for some pancreatic cancer patients”. sciencedaily.com.
- ^ "Clovis Oncology Presents Data from Phase 2 Studies of Rucaparib in Advanced Ovarian Cancer and Pancreatic Cancer at 2016 ASCO Annual Meeting",http://www.businesswire.com/news/home/20160606005594/en/Clovis-Oncology-Presents-Data-Phase-2-Studies
- ^ "Rucaparib", https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm533891.htm
- ^ "CURRENT CLOVIS CLINICAL TRIALS INVESTIGATING RUCAPARIB Lưu trữ 2018-04-13 tại Wayback Machine", http://clovisoncology.com/files/Clovis_Oncology_Clinical_Trial_Fact_Sheet_FINAL_1.pdf Lưu trữ 2018-04-13 tại Wayback Machine
- ^ Coleman, Robert L.; Oza, Amit M.; Lorusso, Domenica; và đồng nghiệp (2017). “Rucaparib maintenance treatment for recurrent ovarian carcinoma after response to platinum therapy (ARIEL3): A randomised, double-blind, placebo-controlled, phase 3 trial” (PDF). The Lancet. 390 (10106): 1949–1961. doi:10.1016/S0140-6736(17)32440-6. PMC 5901715. PMID 28916367.
- ^ "CLOVIS ONCOLOGY TO PRESENT COMPREHENSIVE DATASET FROM SUCCESSFUL ARIEL3 CLINICAL TRIAL PROGRAM AT 2017 ESMO CONGRESS[liên kết hỏng]",http://ir.clovisoncology.com/phoenix.zhtml?c=247187&p=irol-newsArticle&ID=2297323[liên kết hỏng]
- ^ "Rucaparib: First Global Approval",Drugs, Yahiya Y. Syed, 2017, Volume 77, P. 585
- ^ "Delivering the right treatment to the right patient is the future of cancer therapy Lưu trữ 2018-04-13 tại Wayback Machine",http://clovisoncology.com/files/Clovis_Oncology_Clinical_Trial_Fact_Sheet_FINAL_1.pdf Lưu trữ 2018-04-13 tại Wayback Machine
- ^ "Clovis Oncology (CLVS)FORM 10-Q",https://www.sec.gov/Archives/edgar/data/1466301/000155837017005797/clvs-20170630x10q.htm
- ^ "Financial Reports SEC Filings Lưu trữ 2017-09-12 tại Wayback Machine",http://phx.corporate-ir.net/phoenix.zhtml?c=247187&p=irol-sec Lưu trữ 2017-09-12 tại Wayback Machine
- ^ "What is the patent landscape for Rubraca, and what generic Rubraca alternatives are available?",https://www.drugpatentwatch.com/p/tradename/RUBRACA
- ^ "CLOVIS ONCOLOGY, INC. filed this Form S-3ASR on 01/03/2017[liên kết hỏng]",http://ir.clovisoncology.com/mobile.view?c=247187&v=202&d=3&id=aHR0cDovL2FwaS50ZW5rd2l6YXJkLmNvbS9maWxpbmcueG1sP2lwYWdlPTExMzAxODk1JkRTRVE9MSZTRVE9NyZTUURFU0M9U0VDVElPTl9QQUdFJmV4cD0mc3Vic2lkPTU3[liên kết hỏng]
Liên kết ngoài
[sửa | sửa mã nguồn]- Rubraca (rucaparib) Trang web chính thức Lưu trữ 2019-08-17 tại Wayback Machine
 GIẢM
50%
GIẢM
50%
 GIẢM
26%
GIẢM
26%
 GIẢM
16%
GIẢM
16%
 GIẢM
19%
GIẢM
19%
 GIẢM
2%
GIẢM
2%




