Ceruloplazmin
Ceruloplazmin jest feroksidazni enzim koji je kod ljudi kodiran genom CP sa hromosoma 3.[5][6][7]
Ceruloplazmin je glavni protein koji prenosi bakar u krvi, a osim toga ima ulogu u metabolizmu željeza. Prvi put je opisan 1948.[8] Drugi protein, hefestin, poznat je po svojoj homologiji sa ceruloplazminom, a takođe učestvuje u metabolizmu gvožđa i verovatno bakra.
Aminokiselinska sekvenca
[uredi | uredi izvor]Dužina polipeptidnog lanca je 1.065 aminokiselina, a molekulska težina 122.205 Da.
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MKILILGIFL | FLCSTPAWAK | EKHYYIGIIE | TTWDYASDHG | EKKLISVDTE | ||||
| HSNIYLQNGP | DRIGRLYKKA | LYLQYTDETF | RTTIEKPVWL | GFLGPIIKAE | ||||
| TGDKVYVHLK | NLASRPYTFH | SHGITYYKEH | EGAIYPDNTT | DFQRADDKVY | ||||
| PGEQYTYMLL | ATEEQSPGEG | DGNCVTRIYH | SHIDAPKDIA | SGLIGPLIIC | ||||
| KKDSLDKEKE | KHIDREFVVM | FSVVDENFSW | YLEDNIKTYC | SEPEKVDKDN | ||||
| EDFQESNRMY | SVNGYTFGSL | PGLSMCAEDR | VKWYLFGMGN | EVDVHAAFFH | ||||
| GQALTNKNYR | IDTINLFPAT | LFDAYMVAQN | PGEWMLSCQN | LNHLKAGLQA | ||||
| FFQVQECNKS | SSKDNIRGKH | VRHYYIAAEE | IIWNYAPSGI | DIFTKENLTA | ||||
| PGSDSAVFFE | QGTTRIGGSY | KKLVYREYTD | ASFTNRKERG | PEEEHLGILG | ||||
| PVIWAEVGDT | IRVTFHNKGA | YPLSIEPIGV | RFNKNNEGTY | YSPNYNPQSR | ||||
| SVPPSASHVA | PTETFTYEWT | VPKEVGPTNA | DPVCLAKMYY | SAVDPTKDIF | ||||
| TGLIGPMKIC | KKGSLHANGR | QKDVDKEFYL | FPTVFDENES | LLLEDNIRMF | ||||
| TTAPDQVDKE | DEDFQESNKM | HSMNGFMYGN | QPGLTMCKGD | SVVWYLFSAG | ||||
| NEADVHGIYF | SGNTYLWRGE | RRDTANLFPQ | TSLTLHMWPD | TEGTFNVECL | ||||
| TTDHYTGGMK | QKYTVNQCRR | QSEDSTFYLG | ERTYYIAAVE | VEWDYSPQRE | ||||
| WEKELHHLQE | QNVSNAFLDK | GEFYIGSKYK | KVVYRQYTDS | TFRVPVERKA | ||||
| EEEHLGILGP | QLHADVGDKV | KIIFKNMATR | PYSIHAHGVQ | TESSTVTPTL | ||||
| PGETLTYVWK | IPERSGAGTE | DSACIPWAYY | STVDQVKDLY | SGLIGPLIVC | ||||
| RRPYLKVFNP | RRKLEFALLF | LVFDENESWY | LDDNIKTYSD | HPEKVNKDDE | ||||
| EFIESNKMHA | INGRMFGNLQ | GLTMHVGDEV | NWYLMGMGNE | IDLHTVHFHG | ||||
| HSFQYKHRGV | YSSDVFDIFP | GTYQTLEMFP | RTPGIWLLHC | HVTDHIHAGM | ||||
| ETTYTVLQNE | DTKSG |
Funkcija
[uredi | uredi izvor]Ceruloplazmin (CP) je enzim (EC 1.16.3.1) sintetiziran u jetri i u svojoj strukturi sadrži 6 atoma bakra.[9] U zdravoj ljudskoj plazmi, ceruloplazmin nosi više od 95% ukupnog bakra.[10] Ostatak čine makroglobulini. Ceruloplazmin pokazuje aktivnost oksidaze zavisnu od bakra, koja je povezana sa mogućom oksidacijom Fe2+ (fero gvožđe) u Fe3+ (feri gvožđe), stoga pomaže u njegovom transportu u plazmi u kombinaciji sa transferinom, koji može prenositi željezo samo u feri stanju.[11] Izvještava se da je molekularna težina ljudskog ceruloplazmina 151 kDa.
Uprkos opsežnim istraživanjima, još uvijek se mnogo toga ne zna o tačnim funkcijama CP, većina funkcija se pripisuje fokusu CP na prisutnost Cu centara. To uključuje transport bakra za isporuku Cu u vanjetrena tkiva, aktivnost amin-oksidaze koja kontrolira nivo biogenih amina u crijevnim tekućinama i plazmi, uklanjanje kisika i drugih slobodnih radikala iz plazme i eksport željeza iz ćelija za transport kroz transferin.[12]
Poznato je da mutacije ometaju vezivanje bakra za CP i poremete metabolizam gvožđa i uzrokuju preopterećenje gvožđem.
Ceruloplazmin je relativno veliki enzim (~10 nm); veća veličina sprečava da se vezani bakar izgubi u mokraći osobe tokom transporta.
Struktura aktivnog mjesta
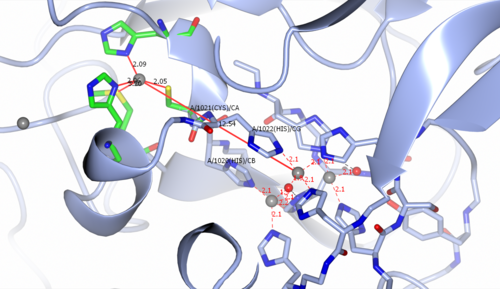
[uredi | uredi izvor]Višebakarno aktivno mjesto CP sadrži tip I (T1) mononuklearnog bakra[12] mjesto i trinuklearni centar bakra udaljen ~ 12-13 Å (vidi sliku 2). Tribakarni centar se sastoji od dva tipa III (T3) bakra i jednog tipa II (T2) iona bakra. Dva T3 bakrena iona su premoštena hidroksidnim ligandom dok drugi hidroksidni ligand povezuje T2 bakreni ion sa proteinom. T1 centar je premošten sa tribakarnim centrom sa dva histidinska (His1020, His1022) ostatka i jednim ostatkom Cys(1021). Supstrat se vezuje u blizini T1 centra i oksidira se T1 Cu2+ ionom, formirajući redukovano Cu+ oksidacijsko stanje. Redukovani T1 Cu+ zatim prenosi elektron kroz jedan Cys i dva His, premoštavajuća ostatka do tribakarnog centra. Nakon što su četiri elektrona prebačena sa supstrata u centre bakra, O2 se veže na centar tribakra i podliježe redukciji od četiri elektrona kako bi se formirale dvije molekule vode.[12]
Regulacija
[uredi | uredi izvor]Cis-regulacijaki element koji se zove GAIT element uključen je u selektivno translacijsko utišavanje transkripta ceruloplazmina.[13] Utišavanje zahtijeva vezivanje kompleksa citosolnog inhibitora koji se naziva IFN-gama-aktivirani inhibitor translacije (GAIT) za GAIT element.[14]
Klinički značaj
[uredi | uredi izvor]Kao i svaki drugi protein u plazmi, nivoi se smanjuju kod pacijenata sa oboljenjem jetre zbog smanjene sposobnosti sinteze.
Mehanizmi niskog nivoa ceruloplazmina:
- Ekspresija gena genetički niska (aceruloplazminemija)
- Nivo bakra je općenito nizak
- Neuhranjenost/nedostatak metala u tragovima u izvoru hrane
- Otrovnost cinka, zbog induciranog nedostatka bakra
- Bakar ne prolazi crijevnu barijeru zbog nedostatka ATP7A (Menkesova bolest i sindrom potiljačog roga)
- Isporuka bakra u lumen ER-Golgijeve mreže je odsutna u hepatocitima, zbog odsustva ATP7B (Wilsonova bolest)
Dostupnost bakra ne utiče na translaciju proteina u nastajanju. Međutim, apoenzim bez bakra je nestabilan. Apoceruloplazmin se u velikoj mjeri unutarćelijski razgrađuje u hepatocitima i mala količina koja se oslobađa ima kratko poluvrijeme cirkulacije od 5 sati u poređenju sa 5,5 dana za holoceruloplazmin.
Ceruloplazmin se može izmjeriti analizom krvi;[15] ovo se može uraditi pomoću imunoeseja . Uzorak se centrifugira i odvaja; čuva se tri dana na temperaturi od oko 4 °C. Ovim testom se utvrđuje postoje li znaci Wilsonove bolesti. Drugi test koji se može uraditi je test nivoa bakra u urinu; pokazalo se da je to manje precizno od testa krvi. Može se uraditi i test jetrenog tkiva.
Mutacije u genu za ceruloplazmin (CP), koje su vrlo rijetke, mogu dovesti do genetičke bolesti aceruloplazminemija, koju karakterizira hiperferitinemija sa preopterećenjem željezom. U mozgu, ovo preopterećenje gvožđem može dovesti do karakterističnih neuroloških znakova i simptoma, kao što su cerebellumska ataksija, progresivna demencija i ekstrapiramidni znaci. Višak gvožđa se također može taložiti u jetri, pankreasu i mrežnjačama, što dovodi do ciroza€ciroze, endokrinih abnormalnosti i gubitka vida.
Referentni rasponi
[uredi | uredi izvor]Normalna koncentracija ceruloplazmina u krvi kod ljudi je 20–50 mg/dL.

Reference
[uredi | uredi izvor]- ^ a b c GRCh38: Ensembl release 89: ENSG00000047457 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000003617 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Takahashi N, Ortel TL, Putnam FW (Jan 1984). "Single-chain structure of human ceruloplasmin: the complete amino acid sequence of the whole molecule". Proceedings of the National Academy of Sciences of the United States of America. 81 (2): 390–4. Bibcode:1984PNAS...81..390T. doi:10.1073/pnas.81.2.390. PMC 344682. PMID 6582496.
- ^ Koschinsky ML, Funk WD, van Oost BA, MacGillivray RT (Jul 1986). "Complete cDNA sequence of human preceruloplasmin". Proceedings of the National Academy of Sciences of the United States of America. 83 (14): 5086–90. Bibcode:1986PNAS...83.5086K. doi:10.1073/pnas.83.14.5086. PMC 323895. PMID 2873574.
- ^ Royle NJ, Irwin DM, Koschinsky ML, MacGillivray RT, Hamerton JL (maj 1987). "Human genes encoding prothrombin and ceruloplasmin map to 11p11-q12 and 3q21-24, respectively". Somatic Cell and Molecular Genetics. 13 (3): 285–92. doi:10.1007/BF01535211. PMID 3474786. S2CID 45686258.
- ^ Holmberg CG, Laurell CB (1948). "Investigations in serum copper. II. Isolation of the Copper containing protein, and a description of its properties". Acta Chem Scand. 2: 550–56. doi:10.3891/acta.chem.scand.02-0550.
- ^ O'Brien PJ, Bruce WR (2009). Endogenous Toxins: Targets for Disease Treatment and Prevention, 2 Volume Set. John Wiley & Sons. str. 405–6. ISBN 978-3-527-32363-0.
- ^ Hellman NE, Gitlin JD (2002). "Ceruloplasmin metabolism and function". Annual Review of Nutrition. 22: 439–58. doi:10.1146/annurev.nutr.22.012502.114457. PMID 12055353.
- ^ Song D, Dunaief JL (2013). "Retinal iron homeostasis in health and disease". Frontiers in Aging Neuroscience. 5: 24. doi:10.3389/fnagi.2013.00024. PMC 3695389. PMID 23825457.
- ^ a b c Bertini, Ivano (2007). Biological Inorganic Chemistry (jezik: English). California, USA: University Science Books. str. 426–442. ISBN 978-1-891389-43-6.CS1 održavanje: nepoznati jezik (link)
- ^ Sampath P, Mazumder B, Seshadri V, Fox PL (Mar 2003). "Transcript-selective translational silencing by gamma interferon is directed by a novel structural element in the ceruloplasmin mRNA 3' untranslated region". Molecular and Cellular Biology. 23 (5): 1509–19. doi:10.1128/MCB.23.5.1509-1519.2003. PMC 151701. PMID 12588972.
- ^ Mazumder B, Sampath P, Fox PL (Oct 2005). "Regulation of macrophage ceruloplasmin gene expression: one paradigm of 3'-UTR-mediated translational control". Molecules and Cells. 20 (2): 167–72. PMID 16267389.
- ^ "Ceruloplasmin Test: MedlinePlus Medical Test". medlineplus.gov (jezik: engleski). Pristupljeno 10. 12. 2021.
Dopunska literatura
[uredi | uredi izvor]- Hellman NE, Gitlin JD (2002). "Ceruloplasmin metabolism and function". Annual Review of Nutrition. 22: 439–58. doi:10.1146/annurev.nutr.22.012502.114457. PMID 12055353.
- Mazumder B, Seshadri V, Fox PL (Feb 2003). "Translational control by the 3'-UTR: the ends specify the means". Trends in Biochemical Sciences. 28 (2): 91–8. doi:10.1016/S0968-0004(03)00002-1. PMID 12575997.
- Giurgea N, Constantinescu MI, Stanciu R, Suciu S, Muresan A (Feb 2005). "Ceruloplasmin - acute-phase reactant or endogenous antioxidant? The case of cardiovascular disease". Medical Science Monitor. 11 (2): RA48-51. PMID 15668644.
- Kingston IB, Kingston BL, Putnam FW (Dec 1977). "Chemical evidence that proteolytic cleavage causes the heterogeneity present in human ceruloplasmin preparations". Proceedings of the National Academy of Sciences of the United States of America. 74 (12): 5377–81. Bibcode:1977PNAS...74.5377K. doi:10.1073/pnas.74.12.5377. PMC 431726. PMID 146197.
- Polosatov MV, Klimov PK, Masevich CG, Samartsev MA, Wünsch E (Apr 1979). "Interaction of synthetic human big gastrin with blood proteins of man and animals". Acta Hepato-Gastroenterologica. 26 (2): 154–9. PMID 463490.
- Schilsky ML, Stockert RJ, Pollard JW (Dec 1992). "Caeruloplasmin biosynthesis by the human uterus". The Biochemical Journal. 288 (2): 657–61. doi:10.1042/bj2880657. PMC 1132061. PMID 1463466.
- Walker FJ, Fay PJ (Feb 1990). "Characterization of an interaction between protein C and ceruloplasmin". The Journal of Biological Chemistry. 265 (4): 1834–6. doi:10.1016/S0021-9258(19)39903-X. PMID 2105310.
- Fleming RE, Gitlin JD (maj 1990). "Primary structure of rat ceruloplasmin and analysis of tissue-specific gene expression during development". The Journal of Biological Chemistry. 265 (13): 7701–7. doi:10.1016/S0021-9258(19)39171-9. PMID 2332446.
- Yang FM, Friedrichs WE, Cupples RL, Bonifacio MJ, Sanford JA, Horton WA, Bowman BH (Jun 1990). "Human ceruloplasmin. Tissue-specific expression of transcripts produced by alternative splicing". The Journal of Biological Chemistry. 265 (18): 10780–5. doi:10.1016/S0021-9258(18)87015-6. PMID 2355023.
- Yang F, Naylor SL, Lum JB, Cutshaw S, McCombs JL, Naberhaus KH, McGill JR, Adrian GS, Moore CM, Barnett DR (maj 1986). "Characterization, mapping, and expression of the human ceruloplasmin gene". Proceedings of the National Academy of Sciences of the United States of America. 83 (10): 3257–61. Bibcode:1986PNAS...83.3257Y. doi:10.1073/pnas.83.10.3257. PMC 323492. PMID 3486416.
- Mercer JF, Grimes A (Jul 1986). "Isolation of a human ceruloplasmin cDNA clone that includes the N-terminal leader sequence". FEBS Letters. 203 (2): 185–90. doi:10.1016/0014-5793(86)80739-6. PMID 3755405. S2CID 23472934.
- Rask L, Valtersson C, Anundi H, Kvist S, Eriksson U, Dallner G, Peterson PA (Jan 1983). "Subcellular localization in normal and vitamin A-deficient rat liver of vitamin A serum transport proteins, albumin, ceruloplasmin and class I major histocompatibility antigens". Experimental Cell Research. 143 (1): 91–102. doi:10.1016/0014-4827(83)90112-X. PMID 6337857.
- Kressner MS, Stockert RJ, Morell AG, Sternlieb I (1984). "Origins of biliary copper". Hepatology. 4 (5): 867–70. doi:10.1002/hep.1840040512. PMID 6479854. S2CID 43824397.
- Takahashi N, Bauman RA, Ortel TL, Dwulet FE, Wang CC, Putnam FW (Jan 1983). "Internal triplication in the structure of human ceruloplasmin". Proceedings of the National Academy of Sciences of the United States of America. 80 (1): 115–9. Bibcode:1983PNAS...80..115T. doi:10.1073/pnas.80.1.115. PMC 393320. PMID 6571985.
- Dwulet FE, Putnam FW (Feb 1981). "Complete amino acid sequence of a 50,000-dalton fragment of human ceruloplasmin". Proceedings of the National Academy of Sciences of the United States of America. 78 (2): 790–4. Bibcode:1981PNAS...78..790D. doi:10.1073/pnas.78.2.790. PMC 319888. PMID 6940148.
- Kingston IB, Kingston BL, Putnam FW (Apr 1980). "Primary structure of a histidine-rich proteolytic fragment of human ceruloplasmin. I. Amino acid sequence of the cyanogen bromide peptides". The Journal of Biological Chemistry. 255 (7): 2878–85. doi:10.1016/S0021-9258(19)85822-2. PMID 6987229.