Stacionarno stanje
| Dio serije članaka o |
| Kvantnoj mehanici |
|---|
Stacionarno stanje je kvantno stanje sa svim uočljivostima neovisnim o vremenu. To je specifični vektor energetskog operatora (umjesto kvantne superpozicije različitih energija). Također se naziva svojstveni vektor energije, svojstveno stanje energije, svojstvena funkcija energije ili energija svojstvene notacije. Veoma je sličano konceptu atomske orbitale i molekulske orbitale u hemiji, sa nekim malim razlikama objašnjenim u nastavku.
Uvod
[uredi | uredi izvor]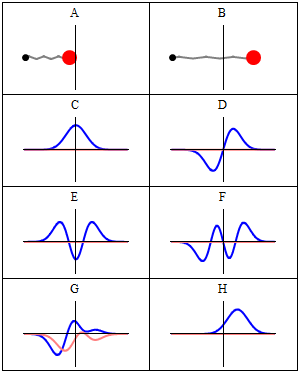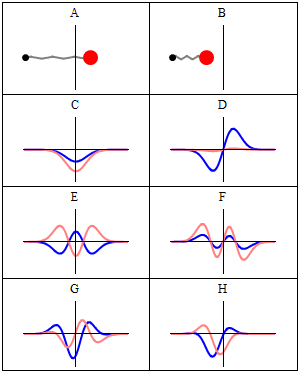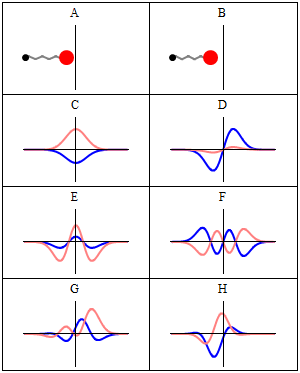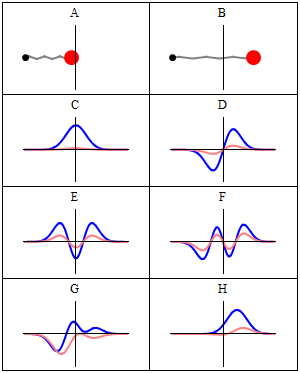
Stacionarno stanje se naziva stacionarno jer sistem ostaje u istom stanju kako vrijeme prolazi, na svaki vidljiv način. Za Hamiltonij od jedne čestice, to znači da čestica ima konstantnu distribuciju vjerovatnoće za svoj položaj, svoju brzinu, njen spin, itd..[1] (Ovo je tačno pod pretpostavkom da je okruženje čestice također statičko, tj. Hamiltonij je nepromenljiv u vremenu.) Talasna funkcija sama po sebi nije stacionarna: ona neprestano menja svoj ukupni kompleks faznog faktora, tako da formira stojeći talas. Frekvencija oscilovanja stajaćeg talasaa, puta Planckova konstanta, je energija stanja prema Planck–Einsteinovoj relaciji.
Stacionarna stanja su kvantna stanje koja su rješenja vremenski nezavisne Schrödingerove jednadžbe: gdje
- = kvantno stanje, koje je stacionarno stanje ako zadovoljava ovu jednadžbu;
- = Hamiltonovski operator;
- = realni broj, i odgovara vlastitoj vrijednosti energije stanja .
Ovo je jednadžba vlastitih vrijednosti: is a linear operator on a vector space, is an eigenvector of , a je njegova vlastita vrijednost.
Ako je stacionarno stanje uključeno u vremenski zavisnu Schrödingerovu jednačinu, rezultat je:[2]
Pod pretpostavkom da je vremenski nezavisna (nepromjenjiva u vremenu), ova jednačina vrijedi za bilo koje vrijeme t. Dakle, ovo je diferencijalna jednačina koja opisuje kako varira u vremenu. Njeno rješenje je:
Prema tome, stacionarno stanje je stojeći talas koji oscilira sa ukupnim kompleksom faznog faktota, a njegova oscilacijska ugaona frekvencija jednaka je njegovoj energiji podijeljenoj sa .
Svojstva stacionarnog stanja
[uredi | uredi izvor]
Kao što je gore prikazano, stacionarno stanje nije matematički konstantno:
Međutim, sva vidljiva svojstva stanja su u stvari konstantna u vremenu. Naprimjer, ako predstavlja jednostavnu jednodimenziijsku jednočestičnu talasnu funkciju , vjerovatnoća da je čestica na lokaciji x je: što je nezavisno od vremena t.
Heisenbergova slika je alternativa matematičke formulacija kvantne gdje su stacionarna stanja zaista matematički konstantna u vremenu.
Kao što je gore spomenuto, ove jednadžbe pretpostavljaju da je Hamiltonski vremenski neovisan. To jednostavno znači da su stacionarna stanja samo stacionarna kada je ostatak sistema fiksan i stacionaran. Naprimjer, 1s elektron u atomu vodonika je u stacionarnom stanju, ali ako atom vodika reaguje s drugim atomom, tada će elektron naravno biti poremećen.
Spontano raspadanje
[uredi | uredi izvor]Spontano raspadanje komplikuje pitanje stacionarnih stanja. Naprimjer, prema jednostavnoj (nerelativističko) kvantnoj mehanici, atom vodika ima mnogo stacionarnih stanja: 1s, 2s, 2p, i tako dalje, su sva stacionarna stanja. Ali u stvarnosti, samo osnovno stanje 1 je zaista "stacionarno": elektron na višem energetskom nivou će spontano emitovati jedan ili više fotona da se raspadne u osnovno stanje.[3] Čini se da je to u suprotnosti s idejom da stacionarna stanja trebaju imati nepromjenjive osobine.
Objašnjenje je da je hamiltonijan koji se koristi u nerelativističkoj kvantnoj mehanici samo aproksimacija hamiltonijanu iz kvantne teorije polja. Elektronska stanja više energije (2s, 2p, 3s, itd.) su stacionarna stanja prema približnom hamiltonijanu, ali ne stacionarna prema pravom hamiltonijanu, zbog vakuumskih fluktuacija. S druge strane, stanje 1s je zaista stacionarno stanje, i prema približnom i prema pravom hamiltonijanu.
Poređenje sa "orbitalom" u hemiji
[uredi | uredi izvor]Orbitala je stacionarno stanje (ili njegova aproksimacija) atoma ili molekula sa jednim elektronom; preciznije, atomska orbitala za elektron u atomu ili molekulska orbitala za elektron u molekulu.[4]
Za molekulu koja sadrži samo jedan elektron (npr. atomski vodik ili H2+), orbitala je potpuno ista kao potpuno stacionarno stanje molekule. Međutim, za molekulu s više elektrona, orbitala je potpuno drugačija od potpunog stacionarnog stanja, što je stanje sa više čestica koje zahtijeva složeniji opis (kao što je Slejterova determinanta).[5] Konkretno, u molekuli sa više elektrona, orbitala nije potpuno stacionarno stanje molekula, već stacionarno stanje jednog elektrona unutar molekule. Ovaj koncept orbitale ima smisla samo pod aproksimacijom da ako zanemarimo termine trenutnog odbijanja elektron-elektron u Hamiltonijanu kao pojednostavljujuću pretpostavku, možemo rastaviti ukupni vlastiti vektor molekule sa više elektrona na odvojene doprinose pojedinačnih stacionarnih stanja elektrona (orbitale), od kojih se svaka dobija u okviru jednoelektronske aproksimacije. (Srećom, hemičari i fizičari često (ali ne uvijek) mogu koristiti ovu "aproksimaciju jednog elektrona.") U tom smislu, u sistemu sa više elektrona, orbitala se može smatrati stacionarnim stanjem pojedinačnog elektrona u sistemu. .
U hemiji, izračunavanje molekulskih orbitala obično takođe pretpostavlja Born-Oppenheimerovu aproksimaciju.
Također pogledajte
[uredi | uredi izvor]- Tranzicija stanja
- Kvantni broj
- Kvantnomehanički vakuum ili stanje vakuuma
- Virtuelna čestica
- Stabilno stanje
Reference
[uredi | uredi izvor]- ^ Cohen-Tannoudji, Claude, Bernard Diu, and Franck Laloë. Quantum Mechanics: Volume One. Hermann, 1977. p. 32.
- ^ Quanta: A handbook of concepts, P.W. Atkins, Oxford University Press, 1974, ISBN 0-19-855493-1
- ^ Quantum Physics of Atoms, Molecules, Solids, Nuclei, and Particles (2nd Edition), R. Eisberg, R. Resnick, John Wiley & Sons, 1985, ISBN 978-0-471-87373-0
- ^ Physical chemistry, P.W. Atkins, Oxford University Press, 1978, ISBN 0-19-855148-7
- ^ Löwdin, Per-Olov (1955). "Quantum theory of many-particle systems. I. Physical interpretations by means of density matrices, natural spin-orbitals, and convergence problems in the method of configurational interaction". Physical Review. 97 (6): 1474–1489. Bibcode:1955PhRv...97.1474L. doi:10.1103/PhysRev.97.1474.
Dopunska literatura
[uredi | uredi izvor]- Stationary states, Alan Holden, Oxford University Press, 1971, ISBN 0-19-851121-3











