Cutibacterium acnes
| Cutibacterium acnes | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Cutibacterium acnes | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Cutibacterium acnes | ||||||||||||
| (Gilchrist 1900) Douglas & Gunter 1946 |
| Klassifikation nach ICD-10 | |
|---|---|
| B96.8[1] | Sonstige näher bezeichnete Bakterien als Ursache von Krankheiten, die in anderen Kapiteln klassifiziert sind |
| ICD-10 online (WHO-Version 2019) | |
| Klassifikation nach ICD-10-GM | |
|---|---|
| B95.91! | Sonstige näher bezeichnete grampositive anaerobe, nicht sporenbildende Erreger als Ursache von Krankheiten, die in anderen Kapiteln klassifiziert sind |
| ICD-10 online (GM-Version 2024) | |
Cutibacterium acnes (ehemals Propionibacterium acnes) ist ein langsam wachsendes grampositives, anaerobes Bakterium. Das Bakterium ist ein Teil der Hautflora und Kommensal, aber auch als sekundärer Faktor an der Pathogenese der Akne beteiligt. Es wurde früher als Bacillus acnes und Corynebacterium acnes bezeichnet. Von der Art C. acnes sind etwa 100 Stämme bekannt, das Genom zahlreicher Stämme wurde bereits vollständig sequenziert. Die Forschung, welche Stämme pathogen sind und z. B. an der Erkrankung Acne vulgaris beteiligt sind, ist derzeit (Stand 2013) noch nicht abgeschlossen.
Merkmale
[Bearbeiten | Quelltext bearbeiten]Erscheinungsbild
[Bearbeiten | Quelltext bearbeiten]Cutibacterium acnes ist ein grampositives kurzes, stäbchenförmiges Bakterium, auch ellipsoide Zellformen kommen vor. Eine einzelne Zelle ist 0,4–0,5 µm (Mikrometer) breit und 0,8–0,9 µm lang.[2] Im lichtmikroskopischen Bild finden sich meist paarweise angeordnete Zellen, die nicht direkt hintereinander liegen, sondern in einem Winkel. Dies führt bei weiteren Zellteilungen zur Ausbildung von V- oder Y-förmigen Ketten.[3] Das Bakterium besitzt keine Flagellen zur aktiven Bewegung und kann keine Überdauerungsformen wie Endosporen bilden.[4]
Auf festen Nährmedien, die unter anaeroben Bedingungen inkubiert werden, bilden sich nach vier bis fünf Tagen runde Kolonien. Von der Seite betrachtet sind die Kolonien erhaben, dabei erscheinen sie glatt und glänzend, ihr Durchmesser liegt bei 1,5–4,0 mm. Die Kolonien sind weiß, zeigen jedoch nach mehrtägiger Inkubation des Nährmediums eine leichte Färbung hin zu Rosa.[2]
Wachstum und Stoffwechsel
[Bearbeiten | Quelltext bearbeiten]Cutibacterium acnes ist ein anaerobes Bakterium. Ähnlich wie Milchsäurebakterien wird es als aerotolerant angesehen, dies bedeutet, dass es zwar in Anwesenheit von Sauerstoff wächst, diesen aber nicht für seinen Stoffwechsel benötigt.[4] Untersuchungen zur Kultivierung des Bakteriums zeigen jedoch, dass die Anwesenheit von Sauerstoff einen hemmenden Einfluss auf das Wachstum hat.[2] Es verfügt über das Enzym Katalase und kann Cytochrome bilden.[3] Die zur Kultivierung optimale Temperatur liegt bei etwa 37 °C. Bei 45 °C erfolgt kein Wachstum mehr, bei Raumtemperatur (ca. 20 °C) erfolgt das Wachstum nur sehr langsam. Der optimale pH-Wert des Nährmediums liegt im neutralen Bereich, also bei etwa pH 7,0. Auch unter optimalen Bedingungen verläuft das Wachstum eher langsam, erst nach 4–5 Tagen sind Kolonien zu beobachten.[2]
C. acnes betreibt einen chemoorganotrophen und heterotrophen Stoffwechsel, er benutzt organische Verbindungen als Energiequelle und ebenso zum Aufbau zelleigener Stoffe. Es kann in einer Fermentation verschiedene Substrate zur Energiegewinnung verwerten. Da ein Hauptprodukt dieser Gärung die Propionsäure ist, wird dieser Stoffwechselweg als Propionsäuregärung bezeichnet. Weitere Produkte dieser Gärung sind Essigsäure und Kohlenstoffdioxid (CO2).[4] Als Substrate können von C. acnes verschiedene Kohlenhydrate verwendet werden, beispielsweise Glucose, Fructose, Mannose und Galactose. Auch einige Zuckeralkohole, z. B. Glycerin (Glycerol) können verwertet werden.[2] Propionibacterium-Arten können üblicherweise auch Lactat – das Anion der Milchsäure – als Substrat für die Propionsäuregärung nutzen.[4] Dies trifft nicht auf C. acnes zu.[2]
Einige Enzyme, die im Stoffwechsel verwendet werden, um bestimmte Substrate abzubauen, werden im Rahmen einer „Bunten Reihe“ nachgewiesen, um ein Bakterium zu identifizieren. C. acnes verfügt über Katalase und ebenso über proteolytische Enzyme, mit denen es Gelatine abbauen kann, dies wird auch als Gelatineverflüssigung bezeichnet. Eine Nitratreduktion erfolgt durch das Enzym Nitratreduktase (NADH) (EC 1.7.1.1). Die Bildung von Indol aus Tryptophan führen nicht alle Stämme durch, daher kann das Ergebnis im Indol-Test positiv oder negativ ausfallen. Auf Nährmedien, die einen Zusatz von Blut enthalten (ein sogenannter Blutagar), ist eine Beta-Hämolyse zu beobachten.[2] Dieses Verhalten ist jedoch nicht für alle Stämme typisch. Untersuchungen von 2010 zeigen, dass vor allem Stämme, die der Gruppe I zugeordnet werden, die Fähigkeit zur Hämolyse zeigen, andere Stämme hingegen nicht.[5]
Genetik
[Bearbeiten | Quelltext bearbeiten]Das Genom zahlreicher Stämme des Bakteriums wurde bereits vollständig sequenziert. Die erste Sequenzierung erfolgte 2004 an C. acnes KPA171202.[6] Das Genom weist eine Größe von 2560 Kilobasenpaaren (kb) auf,[7] das ist etwa 55 % der Genomgröße von Escherichia coli. Der untersuchte Stamm (DSM 16379) wurde als Kommensal von der menschlichen Haut isoliert und als pathogen eingestuft, da er an der Erkrankung Acne vulgaris beteiligt war.[7] In den folgenden Jahren wurden weitere Stämme genetisch untersucht, mit ähnlichen Ergebnissen bezüglich der Genomgröße. Die untersuchten Bakterienstämme stammten ebenfalls von der menschlichen Haut. Hierbei wurden auch Stämme untersucht, die von Probanden stammten, die nicht an Akne erkrankt waren, diese Stämme wurden folglich als nicht pathogen eingestuft.[8]
Die Ergebnisse der Sequenzierungen zeigen einen GC-Gehalt (den Anteil der Nukleinbasen Guanin und Cytosin) in der Bakterien-DNA von etwa 60 Mol-Prozent.[7][9] Dies liegt innerhalb des Bereiches von 53 bis 68 Mol-Prozent, der für die Gattung Propionibacterium typisch ist, die Vertreter werden daher zu der phylogenetischen Gruppe der grampositiven Bakterien mit hohem GC-Gehalt gezählt.[4]
Pathogenität
[Bearbeiten | Quelltext bearbeiten]Cutibacterium acnes wird durch die Biostoffverordnung in Verbindung mit der TRBA (Technische Regeln für Biologische Arbeitsstoffe) 466 der Risikogruppe 2 zugeordnet.[10] Mikroorganismen in dieser Risikogruppe werden in der Biostoffverordnung definiert als „Biostoffe, die eine Krankheit beim Menschen hervorrufen können und eine Gefahr für Beschäftigte darstellen könnten […]“.[11] Allerdings wird es als Kommensal zur normalen Hautflora gezählt.[2] Auf der Haut ist er nicht nur ein harmloser Bewohner, sondern ist ein Erreger der Akne bzw. kann zu dieser Erkrankung beitragen.[4] Die Forschung, welche Stämme als pathogen anzusehen sind und welche Virulenzfaktoren sich dafür im Genom nachweisen lassen, läuft noch (Stand 2013)[8] und ist im Abschnitt Systematik näher beschrieben.
Nachweise
[Bearbeiten | Quelltext bearbeiten]Ein Nährmedium muss zahlreiche Nährstoffe aufweisen, damit C. acnes darauf kultiviert werden kann. Häufig verwendete Bestandteile umfassen Fleischextrakt, Pepton aus Casein, Hefeextrakt, Dikaliumhydrogenphosphat (KH2PO4), Cystein, Hämine und einige Vitamine. Bei der Herstellung des Mediums, der Beimpfung und Inkubation muss auf strikte Einhaltung der Anaerobentechnik geachtet werden. Inkubiert wird bei einer Temperatur von 37 °C.[12] Weitere empfohlene Zusätze im Medium sind Glucose und Thioglykolat.[2]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Das Bakterium ist ein Teil der Hautflora und Kommensal.[6] C. acnes lebt in erster Linie im Hauttalg des Haarfollikels, wurde aber auch schon im Verdauungstrakt gefunden.[13] Von einem cm² der menschlichen Haut lassen sich bis zu 100.000 Bakterien dieser Art isolieren.[14]
Systematik
[Bearbeiten | Quelltext bearbeiten]
Cutibacterium acnes ist eine von mehreren Arten in der Gattung Propionibacterium.[15] Von der Art sind etwa 100 Bakterienstämme bekannt.[16] Davon sind zahlreiche Stämme auf der menschlichen Haut nachweisbar, ohne dass sie die Erkrankung Acne vulgaris auslösen. Auf der anderen Seite findet sich bei Patienten mit Acne vulgaris eine vermehrte Anzahl dieser Bakterien.[8] Untersuchungen an diesen pathogenen Stämmen zeigen, dass sie bei den Zellen der Talgdrüsen (Sebozyten) die Produktion von Cytokinen und Chemokinen auslösen und so zu einem entzündlichen Prozess beitragen.[17]
Serologische Untersuchungen an den verschiedenen Stämmen führten dazu, diese in Gruppen einzuteilen, je nachdem, ob und welche Faktoren nachweisbar waren. So wurden die Gruppen I bis III identifiziert und zwei Untergruppen IA (I-1) and IB (I-2). Diese an phänotypischen Merkmalen orientierte Unterteilung beruht auf der Unterscheidung der in der Bakterienzellwand vorhandenen Polysaccharid-Ketten und wurde ergänzt durch Untersuchungen, bei denen sich Bakteriophagen wirtsspezifisch an Zellen anlagern (Lysotypie). Dieser Einteilung in phänotypische Gruppen folgten später auch genetische Untersuchungen. Seit 2010 erfolgt die genetische Untersuchung im Rahmen einer Multi-Locus Sequenzanalyse (MLSA), hierbei werden nur bestimmte Gene untersucht. Diese Sequenzanalyse beschränkte sich auf den Nachweis von neun Haushaltsgenen (englisch housekeeping genes, nicht-regulierte Gene, welche unabhängig von Zelltyp, Zellstadium und äußeren Einflüssen exprimiert werden) und zwei Genen (tly und camp5), die vermutlich Virulenzfaktoren codieren. Die Untersuchung umfasst 210 Isolate von C. acnes von Patienten mit Akne, Patienten mit anderen Infektionen, an denes es beteiligt ist, sowie von gesunden Menschen, bei denen es Bestandteil der normalen Hautflora ist. Als Ergebnis der MLSA lassen sich die 210 Isolate zu 57 Sequenztypen zuordnen, also 57 unterschiedlichen Populationen, wobei jeder Sequenztyp in der Multi-Locus Sequenzanalyse das gleiche Ergebnis aufweist.[5]
Mithilfe dieser Daten der MLSA kann ein phylogenetischer Baum erstellt werden, der die Einteilung in die genannten Gruppen bestätigt (vergleiche Abbildung). Innerhalb einer Gruppe des Stammbaums weisen die Sequenztypen eine ähnliche Zusammensetzung der untersuchten Gene auf. Vergleicht man die Zugehörigkeit der Isolate mit der Krankengeschichte der Patienten, so findet man die Mehrzahl der Isolate von Patienten mit starker Akne (in der Abbildung mit einem schwarzen Punkt markiert) in der Untergruppe I-1. Nur wenige Isolate finden sich in der Untergruppe I-2 oder der Gruppe II und kein einziges in der Gruppe III. Hingegen gehören die Isolate, die an sonstigen Infektionen beteiligt sind (in der Abbildung mit einem roten Kreis markiert), eher zu der Untergruppe 1–2 oder zu den Gruppen II und II als zu der mit Akne in Verbindung gebrachten Untergruppe I-1. Diese Isolate stammen u. a. aus Blut, Gehirn-Rückenmarks-Flüssigkeit (CSF, Liquor cerebrospinalis) und post-operativen Infektionen an Hüftgelenken. In diesen Fällen geht man davon aus, dass eine opportunistische Infektion mit C. acnes vorliegt.[5]
Daher ist es wahrscheinlich, dass nur eine begrenzte Anzahl von Sequenztypen – und somit eine begrenzte Anzahl von Bakterienstämmen – von C. acnes als pathogen im Hinblick auf die Erkrankung Acne vulgaris einzustufen sind und diese Stämme sehr nah miteinander verwandt sind. Für weitere MLSA-Untersuchungen wurde eine Datenbank eingerichtet, in der die Ergebnisse aller bisher durchgeführten Untersuchungen verglichen werden können.[18] Die 2012 abgeschlossene Untersuchung an 285 Isolaten bestätigen die Vermutung, dass es eine Art „Abstammungslinie“ der pathogene Stämme gibt.[19]
Etymologie
[Bearbeiten | Quelltext bearbeiten]Der ehemalige Gattungsname verweist auf die Produktion von Propionsäure in der gleichnamigen Gärung, der Artname auf die Beteiligung an der Krankheit Akne. Propionibacterium acnes wurde als Bacillus acnes 1900 von John Dow Fisher Gilchrist erstmals beschrieben.[15] Durch David Hendricks Bergey u. a. wurde es 1923 der Gattung Corynebacterium zugeordnet. Die Untersuchungen von Howard C. Douglas und Shirley E. Günter führten 1946 dazu, dass es zu der Gattung Propionibacterium gestellt wurde, vor allem begründet im Nachweis der Propionsäuregärung und das anaerobe Wachstum.[2]
Medizinische Bedeutung
[Bearbeiten | Quelltext bearbeiten]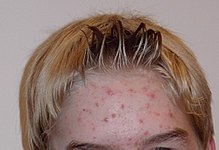
Cutibacterium acnes ist als sekundärer Faktor an der Pathogenese der Akne beteiligt und wird insbesondere mit Acne vulgaris in Verbindung gebracht. In den Komedonen kann es sich vermehren, da dort eher anaerobe Bedingungen herrschen. Es ist im Hauttalg der Haarfollikel, vor allem der Talgdrüsenfollikel zu finden. Da es über das Enzym Lipase verfügt, kann es Bestandteile des Hauttalgs der Talgdrüsen zur Energiegewinnung abbauen und sich so vermehren. Die dabei entstehenden entzündungsfördernden Stoffe bewirken durch Chemotaxis die Anhäufung von Leukozyten in dem Gewebe, bei deren Absterben mit Eiter gefüllte Pusteln entstehen, ein Symptom der Akne.[14]
Darüber hinaus wurde C. acnes mit Fällen von Keratitis[20][21] und Sarkoidose[22] in Verbindung gebracht. Im Rahmen medizinischer Behandlungen kann es postoperativ oder nach Geräteeinsatz zu Infektionen kommen. Dokumentiert sind Fälle von Discitis, Spondylodiscitis, Infektionen des zentralen Nervensystems, Endocarditis, Osteomyelitis, Endophthalmitis und Gelenkinfektion.[22] Zirkulierende Immunkomplexe, die gegen Propionibacterium-acnes-Antigen gebildet wurden, sich an Knochen oder Gelenken ablagern und dort eine Immunreaktion hervorrufen, werden als Ursache der rheumatischen Symptome im Rahmen des SAPHO-Syndroms verdächtigt.[23]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Beniamino Palmieri et al.: The long-standing history of Corynebacterium parvum, immunity, and viruses. In: Journal of Medical Virology. Band 92, Nr. 11, November 2020, S. 2429–2439, doi:10.1002/jmv.26100, PMID 32472706, PMC 7300755 (freier Volltext) – (englisch).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Eintrag zu Acne vulgaris im Flexikon, einem Wiki der Firma DocCheck
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Alphabetisches Verzeichnis zur ICD-10-WHO Version 2019. Band 3. Deutsches Institut für Medizinische Dokumentation und Information (DIMDI), Köln 2019, S. 722
- ↑ a b c d e f g h i j H. C. Douglas, S. E. Gunter: The taxonomic position of Corynebacterium acnes. In: Journal of bacteriology. Band 52, Juli 1946, S. 15–23, ISSN 0021-9193. PMID 20994865.
- ↑ a b Gunther Müller: Grundlagen der Lebensmittelmikrobiologie. 6. Auflage. Steinkopff Verlag, Darmstadt 1986, ISBN 3-7985-0673-6, S. 62.
- ↑ a b c d e f Michael T. Madigan, John M. Martinko, Jack Parker: Brock Mikrobiologie. Deutsche Übersetzung herausgegeben von Werner Goebel. 1. Auflage. Spektrum Akademischer Verlag, Heidelberg/Berlin 2000, ISBN 3-8274-0566-1, S. 572–574, 578, 693, 866–867.
- ↑ a b c d H. B. Lomholt, M. Kilian: Population genetic analysis of Propionibacterium acnes identifies a subpopulation and epidemic clones associated with acne. In: PloS one. Band 5, Nummer 8, 2010, S. e12277, ISSN 1932-6203. doi:10.1371/journal.pone.0012277. PMID 20808860. PMC 2924382 (freier Volltext).
- ↑ a b H. Brüggemann, A. Henne u. a.: The complete genome sequence of Propionibacterium acnes, a commensal of human skin. In: Science, Juli 2004, Band 305, Nummer 5684, S. 671–673, ISSN 1095-9203. doi:10.1126/science.1100330. PMID 15286373.
- ↑ a b c Propionibacterium acnes KPA171202. In: Webseite Genomes Online Database (GOLD). Abgerufen am 17. November 2013.
- ↑ a b c J. Hunyadkürti, Z. Feltóti u. a.: Complete genome sequence of Propionibacterium acnes type IB strain 6609. In: Journal of bacteriology. Band 193, Nummer 17, September 2011, S. 4561–4562, ISSN 1098-5530. doi:10.1128/JB.05372-11. PMID 21705602. PMC 3165515 (freier Volltext).
- ↑ Propionibacterium acnes 6609. In: Webseite Genomes Online Database (GOLD). Abgerufen am 17. November 2013.
- ↑ TRBA (Technische Regeln für Biologische Arbeitsstoffe) 466: Einstufung von Prokaryonten (Bacteria und Archaea) in Risikogruppen. In: Webseite der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA). 25. April 2012, abgerufen am 17. November 2013.
- ↑ Text der Biostoffverordnung - BioStoffV (2013) bei juris. Abgerufen am 17. November 2013.
- ↑ Katalog der Mikroorganismen. In: Webseite des Leibniz Institut DSMZ – Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH. Abgerufen am 17. November 2013.
- ↑ Sajeev Handa: Propionibacterium Infections. In: Website MedScape. Burke A. Cunha, 13. Juni 2012, abgerufen am 17. November 2013.
- ↑ a b Herbert Hof, Rüdiger Dörries: Duale Reihe: Medizinische Mikrobiologie. 3. Auflage. Thieme Verlag, Stuttgart 2005, ISBN 3-13-125313-4, S. 305, 335–336.
- ↑ a b Jean Euzéby, Aidan C. Parte: Genus Propionibacterium. In: List of Prokaryotic names with Standing in Nomenclature (LPSN). Archiviert vom (nicht mehr online verfügbar) am 23. Oktober 2013; abgerufen am 16. März 2024.
- ↑ Taxonomy Browser Propionibacterium acnes. In: Webseite des National Center for Biotechnology Information (NCBI). Abgerufen am 17. November 2013.
- ↑ I. Nagy, A. Pivarcsi u. a.: Propionibacterium acnes and lipopolysaccharide induce the expression of antimicrobial peptides and proinflammatory cytokines/chemokines in human sebocytes. In: Microbes and infection / Institut Pasteur, Juli 2006, Band 8, Nummer 8, S. 2195–2205, ISSN 1286-4579. doi:10.1016/j.micinf.2006.04.001. PMID 16797202.
- ↑ Propionibacterium acnes MLST Databases. In: Webseite der Public databases for molecular typing and microbial genome diversity (PubMLST). Anna Gao, Andrew McDowell, abgerufen am 17. November 2013.
- ↑ A. McDowell, E. Barnard u. a.: An expanded multilocus sequence typing scheme for propionibacterium acnes: investigation of 'pathogenic', 'commensal' and antibiotic resistant strains. In: PloS one. Band 7, Nummer 7, 2012, S. e41480, ISSN 1932-6203. doi:10.1371/journal.pone.0041480. PMID 22859988. PMC 3408437 (freier Volltext).
- ↑ J. P. Underdahl, G. J. Florakis, R. E. Braunstein, D. A. Johnson, P. Cheung, J. Briggs, D. M. Meisler: Propionibacterium acnes as a cause of visually significant corneal ulcers. In: Cornea. 19(4), Jul 2000, S. 451–454. PMID 10928755.
- ↑ B. Ovodenko, J. A. Seedor, D. C. Ritterband, M. Shah, R. Yang, R. S. Koplin: The prevalence and pathogenicity of Propionibacterium acnes keratitis. In: Cornea, Januar 2009, 28(1), S. 36–39. doi:10.1097/ICO.0b013e3181839b1a PMID 19092402.
- ↑ a b A. L. Perry, P. A. Lambert: Propionibacterium acnes. In: Letters in applied microbiology. Band 42, Nummer 3, März 2006, S. 185–188, ISSN 0266-8254. doi:10.1111/j.1472-765X.2006.01866.x. PMID 16478502. (Review).
- ↑ Ralf Gutzmer, Rudolf A. Herbst, Alexander Kapp, Jürgen Weiß: Das SAPHO-Syndrom - Fallbeschreibung von drei Patienten mit Akne conglobata und osteoartikulären Symptomen In: Der Hautarzt, 1997, 48, S. 186–190; PMID 9182090.