Tebbe-Reagenz
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tebbe-Reagenz | ||||||||||||||||||
| Andere Namen |
μ-Chlorobis(cyclopentadienyl)-(dimethylaluminium)-μ-methylentitan (IUPAC) | ||||||||||||||||||
| Summenformel | C13H18AlClTi | ||||||||||||||||||
| Kurzbeschreibung |
roter Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 284,62 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
0,93 g·cm−3[1] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Das Tebbe-Reagenz (nach Frederick Nye Tebbe, kurz Fred Tebbe) ist eine metallorganische Verbindung, die der Methylenierung von Ketonen oder Estern, der Tebbe-Methylenierung, dient.[4] Das Tebbe-Reagenz ist hochreaktiver, roter Feststoff und wird unter Schutzgas gehandhabt.[5] Kommerziell ist es meist als Lösung (zum Beispiel in Toluol) erhältlich.[6][7]
Struktur
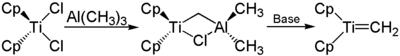
[Bearbeiten | Quelltext bearbeiten]Beim Tebbe-Reagenz handelt es sich um einen zweikernigen verbrückten Komplex mit einem Titan- und einem Aluminium-Kern. Die beiden Metallatome sind über eine Methylengruppe und über eine Chlorbrücke verbrückt. Am Titankern sind zwei Cyclopentadienyl-Reste gebunden, am Aluminiumkern zwei Methylreste.[5]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Das Tebbe-Reagenz wurde um 1974 entwickelt und die Arbeit dazu im Jahr 1978 publiziert. Es handelt sich um den ersten Vorläufer der Katalysatoren für die Olefinmetathese. Erst 2014 wurde eine detaillierte Strukturuntersuchung der Verbindung publiziert.[5]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Das Tebbe-Reagenz wird aus Titanocendichlorid (Cp2Cl2Ti) und einem leichten Überschuss Trimethylaluminium durch dreitägiges Rühren bei Raumtemperatur hergestellt, z. B. in Toluol.[5][7][8] Die Herstellung wird im Allgemeinen unter Inertgas durchgeführt und liefert eine Ausbeute von 80–90 %. Im Allgemeinen werden zusätzlich Verunreinigungen mit einer anderen, ähnlichen Verbindung erhalten, die zwei Chloridobrücken aufweist.[5] Aufbewahrt wird das Reagenz in Lösung (z. B. in Toluol) unter Inertgas.[6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Das Reagenz ist instabil. Als Lösung in Benzol oder Toluol unter Inertgas ist es lange haltbar. Als Feststoff unter Inertgas zersetzt es sich bei Raumtemperatur langsam. In Gegenwart von Sauerstoff zersetzt es sich sowohl als Feststoff als auch in Lösung schnell unter Bildung von Methan.[5][6]
Einsatzspektrum
[Bearbeiten | Quelltext bearbeiten]Das Tebbe-Reagenz dient zur Methylidenierung von Carbonylen und Carboxylen.[9] Das dazu eigentlich benötigte Schrock-Carben kann hieraus in situ durch Behandlung mit milden Basen (zum Beispiel Pyridin oder THF) erhalten werden.[6][7]
Anders als bei anderen Olefinierungen (vgl. Wittig-Reaktion, Horner-Wadsworth-Emmons-Reaktion) ist der Einsatz des Tebbe-Reagenz auf die Einführung von Methylidengruppen beschränkt. Allerdings können mit dem Tebbe-Reagenz nicht nur Carbonyle, sondern auch die meisten Carboxyle (z. B. Ester und Amide) umgesetzt werden, was mit der Wittig-Reaktion nicht gelingt. Auch ergibt sich mit dem Tebbe-Reagenz in fast allen Fällen eine bessere Ausbeute als mit Methylidentriphenylphosphoran, vor allem bei sterisch gehinderten Substraten.[6]
Ein weiteres Anwendungsgebiet des Tebbe-Reagenz liegt in der Synthese von Titanenolaten aus Carbonsäurechloriden oder Carbonsäureanhydriden. Das dabei gewonnene Oxatitanacyclobutan-Derivat zerfällt unter Abspaltung des Chloridions zum Titanenolat.[10][11]
Es ist auch ein Katalysator für Olefinmetathesen, hat aber keine Bedeutung in diesem Bereich.[9][12]
Verwandte Reagenzien
[Bearbeiten | Quelltext bearbeiten]Ein verwandtes Reagenz ist das Petasis-Reagenz, das aus Titanocendichlorid und Methylmagnesiumchlorid gewonnen wird. Es ist deutlich stabiler als das Tebbe-Reagenz und es können auch Analoga mit Nicht-Methyl-Resten erzeugt werden.[7] Andere ähnliche Verbindungen sind das Takeda-Reagenz und das Grubbs-Reagenz (das aus dem Tebbe-Reagenz mit 3,3-Dimethylbuten hergestellt wird).[13] Für weitere alternative Methylidenierungsreaktionen, siehe unter Tebbe-Methylenierung.
Es existieren Analoga des Tebbe-Reagenz mit Yttrium- oder Lanthan-Atomen, die eine ähnliche Reaktivität aufweisen.[9] Es sind auch Zirconium-Komplexe bekannt, die analoge Olefinierungsreaktionen katalysieren (d. h. auch mit Carboxylen), wobei diese auch mit anderen Resten als Methylgruppen möglich sind.[14]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt Tebbe-Reagenz bei Sigma-Aldrich, abgerufen am 6. Juni 2010 (PDF).
- ↑ a b mattmatter: µ-Chlorobis(cyclopentadienyl) (dimethylaluminum)-µ-methylenetitanium ( vom 31. Januar 2016 im Internet Archive) (PDF; 184 kB).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ F. N. Tebbe, G. W. Parshall, G. S. Reddy: Olefin homologation with titanium methylene compounds. In: Journal of the American Chemical Society. Band 100, Nr. 11, Mai 1978, S. 3611–3613, doi:10.1021/ja00479a061.
- ↑ a b c d e f Rick Thompson, Eiko Nakamaru-Ogiso, Chun-Hsing Chen, Maren Pink, Daniel J. Mindiola: Structural Elucidation of the Illustrious Tebbe Reagent. In: Organometallics. Band 33, Nr. 1, 13. Januar 2014, S. 429–432, doi:10.1021/om401108b.
- ↑ a b c d e Stanley H. Pine, Gregory S. Shen, Huan Hoang: Ketone Methylenation Using the Tebbe and Wittig Reagents - A Comparison. In: Synthesis. Band 1991, Nr. 02, 1991, S. 165–167, doi:10.1055/s-1991-26406.
- ↑ a b c d Richard C. Hartley, Gordon J. McKiernan: Titanium reagents for the alkylidenation of carboxylic acid and carbonic acid derivatives. In: Journal of the Chemical Society, Perkin Transactions 1. Nr. 24, 19. Dezember 2002, S. 2763–2793, doi:10.1039/b009709h.
- ↑ Wolfgang A. Herrmann: The Methylene Bridge. In: Advances in Organometallic Chemistry. Band 20. Elsevier, 1982, ISBN 0-12-031120-8, S. 159–263, doi:10.1016/s0065-3055(08)60522-5.
- ↑ a b c Rannveig Litlabø, Melanie Zimmermann, Kuburat Saliu, Josef Takats, Karl W. Törnroos, Reiner Anwander: A Rare-Earth Metal Variant of the Tebbe Reagent. In: Angewandte Chemie International Edition. Band 47, Nr. 49, 24. November 2008, S. 9560–9564, doi:10.1002/anie.200803856.
- ↑ John R. Stille, Robert H. Grubbs: Synthetic applications of titanocene methylene complexes: selective formation of ketone enolates and their reactions. In: Journal of the American Chemical Society. Band 105, Nr. 6, März 1983, S. 1664–1665, doi:10.1021/ja00344a048.
- ↑ Ta-Shue chou, Sung-Ben Huang: Non-wittig type reaction of tebbe reagent with acyl chloride. In: Tetrahedron Letters. Band 24, Nr. 21, 1983, S. 2169–2170, doi:10.1016/S0040-4039(00)81873-0.
- ↑ F. N. Tebbe, G. W. Parshall, D. W. Ovenall: Titanium-catalyzed olefin metathesis. In: Journal of the American Chemical Society. Band 101, Nr. 17, August 1979, S. 5074–5075, doi:10.1021/ja00511a053.
- ↑ Ian Beadham, Jason Micklefield: Reagents for Carbonyl Methylenation in Organic Synthesis. In: Current Organic Synthesis. Band 2, Nr. 2, S. 231–259, doi:10.2174/1570179053545396.
- ↑ Susan M. Clift, Jeffrey Schwartz: Control of olefination stereochemistry using long-chain zirconium alkylidene analogs of the "Tebbe" reagent. In: Journal of the American Chemical Society. Band 106, Nr. 26, Dezember 1984, S. 8300–8301, doi:10.1021/ja00338a052.