Wurmerkrankung
| Wurmerkrankung / Helminthiasis | |
|---|---|
| Medizinische Spezialität | Infektiologie |
Eine Wurmerkrankung oder Helminthiasis (von altgriechisch ἕλμινς hélmins [Genitiv ἕλμινθος hélminthos] „Wurm“) ist jede makroparasitäre Erkrankung von Mensch und Tier, bei der ein Teil des Körpers mit parasitären Würmern infiziert ist. Diese sind auch als Helminthen bekannt. Es gibt zahlreiche Arten dieser Parasiten, die grob in Bandwürmer, Egel und Spulwürmer eingeteilt sind. Sie leben oft im Magen-Darm-Trakt ihrer Wirte, aber sie können sich auch in andere Organe graben, wo sie physiologische Schäden verursachen.
Bodenübertragene Helminthiasis und Schistosomiasis sind die wichtigsten Helminthiasen und gehören zu den vernachlässigten Tropenkrankheiten.[1] Diese Gruppe von Helmianthiasen wurde im Rahmen der gemeinsamen Aktion der weltweit führenden Pharmaunternehmen und Nichtregierungsorganisationen durch ein 2012 gestartetes Projekt namens London Declaration on Neglected Tropical Diseases ins Visier genommen, das darauf abzielt, bestimmte vernachlässigte Tropenkrankheiten bis 2020 zu kontrollieren oder auszurotten.[2]
Helminthiasis führt zu einem schlechten Geburtsergebnis, einer schlechten kognitiven Entwicklung, einer schlechten Schul- und Arbeitsleistung, einer schlechten sozioökonomischen Entwicklung und Armut.[3][4] Chronische Erkrankungen, Unterernährung und Anämie sind weitere Beispiele für Nebenwirkungen.[5]
Bodenübertragene Helminthiasen sind für parasitäre Infektionen in bis zu einem Viertel der menschlichen Bevölkerung weltweit verantwortlich.[6] Ein bekanntes Beispiel für bodenübertragene Helminthiasen ist Ascariasis.
Anzeichen und Symptome
[Bearbeiten | Quelltext bearbeiten]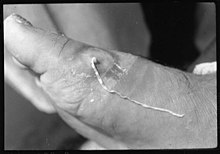

Die Anzeichen und Symptome der Helminthiasis hängen von einer Reihe von Faktoren ab, darunter: die Stelle des Befalls im Körper; die Art des beteiligten Wurms; die Anzahl der Würmer und ihr Volumen; die Art der Schäden, die die befallenden Würmer verursachen; und die immunologische Reaktion des Körpers. Wo die Belastung durch Parasiten im Körper leicht ist, gibt es möglicherweise keine Symptome.
Bestimmte Würmer können bestimmte Konstellationen von Symptomen verursachen. Zum Beispiel kann Taeniasis zu Anfällen aufgrund von Neurozystizerkose führen.[7]
Masse und Volumen
[Bearbeiten | Quelltext bearbeiten]In extremen Fällen von Darmbefall können Masse und Volumen der Würmer dazu führen, dass die äußeren Schichten der Darmwand, wie die Muskelschicht, reißen. Dies kann zu Peritonitis, Volvulus und Gangrän des Darms führen.[8]
Immunologische Reaktion
[Bearbeiten | Quelltext bearbeiten]Als Erreger im Körper induzieren Helminthen eine Immunantwort. Immunvermittelte entzündliche Veränderungen treten in Haut, Lunge, Leber, Darm, im Zentralnervensystem und in den Augen auf. Anzeichen der Immunantwort des Körpers können Eosinophilie, Ödem und Arthritis sein.[9] Ein Beispiel für die Immunantwort ist die Überempfindlichkeitsreaktion, die zu Anaphylaxie führen kann. Ein weiteres Beispiel ist die Migration von Ascaris-Larven durch die Bronchien der Lunge, die Asthma verursachen.[10]
Sekundäre Effekte
[Bearbeiten | Quelltext bearbeiten]
Immunveränderungen
[Bearbeiten | Quelltext bearbeiten]Beim Menschen reagieren T-Helferzellen und Eosinophile auf Helminthenbefall. Es ist allgemein bekannt, dass T-Helfer-2-Zellen die zentralen Akteure der schützenden Immunität gegen Helminthen sind,[11] während die Rollen für B-Zellen und Antikörper kontextabhängig sind.[12] Entzündungen führen zur Verkapselung von Eiablagerungen im ganzen Körper. Helminthen scheiden toxische Substanzen nach der Fütterung in den Darm aus. Diese Substanzen gelangen dann in das Kreislauf- und Lymphsystem des Wirtskörpers.
Chronische Immunantworten auf Helminthiasis können zu einer erhöhten Anfälligkeit für andere Infektionen wie Tuberkulose, HIV und Malaria führen.[13][14][15] Es gibt widersprüchliche Informationen darüber, ob die Entwurmung die HIV-Progression und die Viruslast reduziert und die CD4-Zahl bei antiretroviralen naiven und erfahrenen Personen erhöht, obwohl die jüngste Cochrane-Überprüfung einige Hinweise darauf ergab, dass dieser Ansatz positive Auswirkungen haben könnte.[16][17]
Chronische Krankheiten
[Bearbeiten | Quelltext bearbeiten]Chronische Helminthiasis kann schwere Morbidität verursachen.[18] Es wurde festgestellt, dass Helminthiasis zu einem schlechten Geburtsergebnis, einer schlechten kognitiven Entwicklung, einer schlechten Schul- und Arbeitsleistung, einer verminderten Produktivität, einer schlechten sozioökonomischen Entwicklung und Armut führt.[3][4][5]
Unterernährung
[Bearbeiten | Quelltext bearbeiten]Helminthiasis kann chronische Krankheiten durch Unterernährung verursachen, einschließlich Vitaminmangel, verkümmertes Wachstum, Anämie und Protein-Energie-Unterernährung. Würmer konkurrieren direkt mit ihren Wirten um Nährstoffe, aber das Ausmaß dieses Effekts ist wahrscheinlich minimal, da der Nährstoffbedarf von Würmern relativ gering ist.[19][20][21] Bei Schweinen und Menschen wurde Ascaris mit Laktoseintoleranz und Vitamin A, Aminosäure und Fett-Malassimilation in Verbindung gebracht.[3] Eine beeinträchtigte Nährstoffaufnahme kann durch direkte Schäden an der Darmschleimhautwand oder aus subtileren Veränderungen wie chemischen Ungleichgewichten und Veränderungen der Darmflora resultieren.[22] Alternativ kann die Freisetzung von Proteasehemmern durch die Würmer zur Abwehr der Verdauungsprozesse des Körpers den Abbau anderer Nährstoffe beeinträchtigen.[19][21] Darüber hinaus kann wurminduzierter Durchfall die Darmtransitzeit verkürzen und so die Aufnahme von Nährstoffen reduzieren.[3]
Unterernährung aufgrund von Würmern kann zu Magersucht führen.[20] Eine Studie mit 459 Kindern in Sansibar ergab einen spontanen Appetitanstieg nach der Entwurmung.[23] Magersucht könnte eine Folge der Immunantwort des Körpers und des Stresses bei der Bekämpfung von Infektionen sein.[21] Insbesondere wurden einige der Zytokine, die in der Immunantwort auf Wurmbefall freigesetzt werden, mit Magersucht bei Tieren in Verbindung gebracht.[19]
Anämie
[Bearbeiten | Quelltext bearbeiten]Helminthen können Eisenmangelanämie verursachen. Dies ist am schwersten bei schweren Hakenwurminfektionen, da Necator americanus und Ancylostoma duodenale sich direkt vom Blut ihrer Wirte ernähren. Obwohl der tägliche Verbrauch eines einzelnen Wurms (0,02–10,07 ml bzw. 0,14–0,26 ml) gering ist, kann der kollektive Verbrauch bei schwerer Infektion klinisch signifikant sein.[3][21] Darm-Peitschenwurm kann auch Anämie verursachen. Anämie wurde auch mit einer verringerten Ausdauer für körperliche Arbeit, einem Rückgang der Fähigkeit, neue Informationen zu lernen, und Apathie, Reizbarkeit und Müdigkeit in Verbindung gebracht.[3] Eine Studie über die Wirkung von Entwurmung und Eisenergänzung bei 47 Studenten aus der Demokratischen Republik Kongo ergab, dass die Intervention die kognitive Funktion verbesserte.[24] Eine andere Studie ergab, dass bei 159 jamaikanischen Schulkindern die Entwurmung über einen Zeitraum von neun Wochen zu einem besseren auditiven Kurzzeitgedächtnis und zum Scannen und Abrufen des Langzeitgedächtnisses führte.[25]
Kognitive Veränderungen
[Bearbeiten | Quelltext bearbeiten]Unterernährung aufgrund von Helminthen kann die kognitive Funktion beeinträchtigen, was zu einer geringen Bildungsleistung, einer verminderten Konzentration und Schwierigkeiten bei abstrakten kognitiven Aufgaben führt. Eisenmangel bei Säuglingen und Vorschulkindern ist mit „niedrigeren Punktzahlen … bei Tests der geistigen und motorischen Entwicklung … [sowie] erhöhter Angst, Unaufmerksamkeit und verminderter sozialer Reaktionsfähigkeit“ verbunden.[19] Studien auf den Philippinen und in Indonesien fanden eine signifikante Korrelation zwischen Helminthiasis und vermindertem Gedächtnis und Geläufigkeit.[26][27] Große Parasitenbelastungen, insbesondere schwere Hakenwurminfektionen, sind auch mit Fehlzeiten, Untereinschreibung und Zermürbung bei Schulkindern verbunden.[19]
Helminthentypen, die Infektionen verursachen
[Bearbeiten | Quelltext bearbeiten]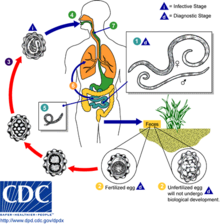

Von allen bekannten Helminthenarten sind die wichtigsten Helminthen in Bezug auf das Verständnis ihrer Übertragungswege, ihre Kontrolle, Inaktivierung und Aufzählung in Proben menschlicher Ausscheidungen aus getrocknetem Kot, Fäkalschlamm, Abwasser und Klärschlamm:[28]
- Bodenübertragene Helminthen, einschließlich Ascaris lumbricoides (die häufigste weltweit), Trichuris trichiura, Necator americanus, Strongyloides stercoralis und Ancylostoma duodenale
Helminthiasen werden wie folgt klassifiziert (die Krankheitsnamen enden mit „-sis“ und die ursächlichen Würmer sind in Klammern):
Spulwurminfektion (Nematodiasis)
[Bearbeiten | Quelltext bearbeiten]- Filariasis (Wuchereria bancrofti, Brugia malayi Infektion)
- Onchozerkose (Onchocerca volvulus-Infektion)
- Bodenübertragene Helminthiasis – dazu gehören Ascariasis (Ascaris lumbricoides-Infektion), Trichuriasis (Trichuris-Infektion) und Hakenwurminfektion (einschließlich Necatoriasis und Ancylostoma duodenale-Infektion)
- Trichostrongyliasis (Trichostrongylus Infektion)
- Dracontiasis (Medinawurm Infektion)
- Baylisascaris procyonis (Waschbärspulwurm, kann auf Haustiere, Vieh und Menschen übertragen werden)
Bandwurminfektion (Zestodiasis)
[Bearbeiten | Quelltext bearbeiten]- Echinokokkose (Echinococcus-Infektion)
- Hymenolepiasis (Hymenolepis nana-Infektion)
- Taeniasis/Zystizerkose (Taenie-Infektion)
- Coenurose (Taenia multiceps, Taenia serialis, Taenia glomerata und Taenia brauni Infektion)
Trematodeninfektion (Trematodiasis)
[Bearbeiten | Quelltext bearbeiten]- Amphistomiasis (Plagiorchiida-Infektion)
- Clonorchiasis (Clonorchis sinensis Infektion)
- Fascioliasis (Fasciola-Infektion)
- Fasciolopsiasis (Fasciolopsis buski-Infektion)
- Opisthorchiasis (Opisthorchis felineus-Infektion)
- Paragonimiasis (Paragonimus westermani-Infektion)
- Schistosomiasis/bilharziasis (Schistosoma-Infektion)
Acanthocephala-Infektion
[Bearbeiten | Quelltext bearbeiten]- Moniliformis moniliformis Infektion
Übertragung
[Bearbeiten | Quelltext bearbeiten]Helminthen werden auf verschiedene Weise an den endgültigen Wirt übertragen. Die häufigste Infektion ist die Aufnahme von kontaminiertem Gemüse, Trinkwasser und rohem oder ungekochtem Fleisch. Kontaminierte Lebensmittel können Eier von Nematoden wie Ascaris, Enterobius und Trichuris, Cestoden wie Taenia, Hymenolepis und Echinococcus sowie Trematoden wie Fasciola enthalten. Rohes oder ungekochtes Fleisch sind die Hauptquellen von Taenia (Schweinefleisch, Rindfleisch und Wild), Trichinen (Schweinefleisch und Bär), Diphyllobothrium (Fisch), Clonorchis (Fisch) und Paragonimus (Krebstiere). Schistosomen und Nematoden wie Hakenwürmer (Ancylostoma und Necator) und Strongyloides können direkt in die Haut eindringen. Schließlich werden Wuchereria, Onchocerca und Dracunculus durch Mücken und Fliegen übertragen.[18] In den Entwicklungsländern ist die Verwendung von kontaminiertem Wasser ein wichtiger Risikofaktor für Infektionen.[29] Eine Infektion kann auch durch die Praxis der Geophagie erfolgen, die in Teilen Afrikas südlich der Sahara nicht ungewöhnlich ist. Boden wird zum Beispiel von Kindern oder schwangeren Frauen gegessen, um einem realen oder wahrgenommenen Mangel an Mineralien in ihrer Ernährung entgegenzuwirken.[30]
Diagnose
[Bearbeiten | Quelltext bearbeiten]Spezifische Helminthen können durch mikroskopische Untersuchung ihrer Eier (Avas) identifiziert werden, die in Stuhlproben gefunden wurden. Die Anzahl der Eier wird in Einheiten von Eiern pro Gramm gemessen.[31] Es quantifiziert jedoch keine gemischten Infektionen und ist in der Praxis ungenau für die Quantifizierung der Eier von Schistosomen und bodenübertragenen Helminthen.[32] Anspruchsvolle Tests wie serologische Assays, Antigentests und DNA-Analysen sind ebenfalls verfügbar;[31][33] sie sind jedoch zeitaufwendig, teuer und nicht immer zuverlässig.[34]
Prävention
[Bearbeiten | Quelltext bearbeiten]Das Unterbrechen des Wurmzyklus verhindert Befall und erneuten Befall. Die Prävention von Infektionen kann weitgehend erreicht werden, indem die Probleme von WatSan – Wasser, Abwasserentsorgung und Hygiene – angegangen werden.[35][36] Die Reduzierung des offenen Stuhlgangs ist besonders erforderlich,[37][38] ebenso wie die Einstellung der Verwendung von menschlichen Abfällen als Dünger.[6]
Weitere vorbeugende Maßnahmen umfassen die Einhaltung einer angemessenen Lebensmittelhygiene, das Tragen von Schuhen, die regelmäßige Entwurmung von Haustieren und die ordnungsgemäße Entsorgung des Kotes.[3]
Wissenschaftler suchen auch nach einem Impfstoff gegen Helminthen, wie z. B. einen Hakenwurmimpfstoff.[39]
Behandlung
[Bearbeiten | Quelltext bearbeiten]Medikamente
[Bearbeiten | Quelltext bearbeiten]Breitspektrum-Benzimidazole (wie Albendazol und Mebendazol) sind die Erstlinienbehandlung von Darmspulwurm- und Bandwurminfektionen. Makrozyklische Lactone (wie Ivermectin) sind wirksam gegen erwachsene und wandernde Larvenstadien von Nematoden. Praziquantel ist das Medikament der Wahl für Schistosomiasis, Taeniasis und die meisten Arten von lebensmittelbedingten Trematodiasen. Oxamniquin wird auch häufig in Massenentwurmungsprogrammen verwendet. Pyrantel wird häufig bei der veterinärmedizinischen Nematodiasis verwendet.[40][41] Artemisinine und Derivate erweisen sich als Kandidaten als Medikamente der Wahl für Trematodiasis.[42]
Massenentwurmung
[Bearbeiten | Quelltext bearbeiten]In Regionen, in denen Helminthiasis häufig auftritt, können Massenentwurmungsbehandlungen durchgeführt werden, insbesondere bei Kindern im Schulalter, die eine Hochrisikogruppe sind.[43][44] Die meisten dieser Initiativen werden von der Weltgesundheitsorganisation (WHO) mit positiven Ergebnissen in vielen Regionen durchgeführt.[45][46] Entwurmungsprogramme können den Schulbesuch um 25 Prozent verbessern.[47] Obwohl die Entwurmung die Gesundheit eines Individuums verbessert, sind die Ergebnisse von Massenentwurmungskampagnen, wie reduzierte Todesfälle oder Erhöhung der kognitiven Fähigkeiten, des ernährungsphysiologischen Nutzens, des körperlichen Wachstums und der Leistung, unsicher oder nicht offensichtlich.[48][49][50][51]
Chirurgie
[Bearbeiten | Quelltext bearbeiten]

Wenn Komplikationen der Helminthiasis wie Darmobstruktion auftreten, kann eine Notoperation erforderlich sein.[8][52] Patienten, die eine Nicht-Notoperation benötigen, z. B. zur Entfernung von Würmern aus dem Gallensystem, können mit dem anthelmintischen Medikament Albendazol vorbehandelt werden.[8]
Epidemiologie
[Bearbeiten | Quelltext bearbeiten]Gebiete mit der höchsten Prävalenz von Helminthiasis sind tropische und subtropische Gebiete, darunter Afrika südlich der Sahara, Zentral- und Ostasien und Amerika.
Vernachlässigte Tropenkrankheiten
[Bearbeiten | Quelltext bearbeiten]Einige Arten von Helminthiasen werden als vernachlässigte Tropenkrankheiten eingestuft.[1][53] Dazu gehören:
- Bodenübertragene Helminthiasen
- Spulwurminfektionen wie lymphatische Filariose, Dracontiasis und Onchocerciasis
- Trematodeninfektionen wie Schistosomiasis und lebensmittelbedingte Trematodiasen, einschließlich Faszioliasis, Clonorchiasis, Opisthorchiasis und Paragonimiasis
- Bandwurminfektionen wie Zystizerkose, Taeniasis und Echinokokkose
Prävalenz
[Bearbeiten | Quelltext bearbeiten]Die bodenübertragenen Helminthen (A. lumbricoides, T. trichiura, N. americanus, A. duodenale), Schistosomen und filarialwürmer infizieren zusammen mehr als ein Viertel der menschlichen Bevölkerung weltweit gleichzeitig und übertreffen HIV und Malaria zusammen bei weitem.[31][33] Schistosomiasis ist die zweithäufigste parasitäre Erkrankung des Menschen nach Malaria.[54]
In den Jahren 2014–15 schätzte die WHO, dass etwa 2 Milliarden Menschen mit bodenübertragenen Helminthiasen infiziert waren,[6] 249 Millionen mit Schistosomiasis,[55] 56 Millionen Menschen mit lebensmittelbedingter Trematodiasis, 120 Millionen mit lymphatischer Filariose,[56] 37 Millionen Menschen mit Onchozerkose[57] und 1 Million Menschen mit Echinokokkose.[58] Eine andere Quelle schätzte eine viel höhere Zahl von 3,5 Milliarden, die mit einer oder mehreren bodenübertragenen Helminthen infiziert waren.[59][60]
Im Jahr 2014 wurde berichtet, dass nur 148 Menschen wegen einer erfolgreichen Ausrottungskampagne für diese bestimmte Helminthe an Dracontiasis leiden, die leichter auszurotten ist als andere Helminthen, da sie nur durch das Trinken von kontaminiertem Wasser übertragen wird.[61]
Aufgrund ihrer hohen Mobilität und niedrigeren Hygienestandards sind Kinder im Schulalter besonders anfällig für Helminthiasis.[62] Die meisten Kinder aus Entwicklungsländern werden mindestens einen Befall haben. Infektionen mit mehreren Arten sind sehr häufig.[63]
Die häufigsten Darmparasiten in den Vereinigten Staaten sind Enterobius vermicularis, Giardia lamblia, Ancylostoma duodenale, Necator americanus und Entamoeba histolytica.[64]
Variationen innerhalb der Gemeinschaften
[Bearbeiten | Quelltext bearbeiten]Selbst in Gebieten mit hoher Prävalenz ist die Häufigkeit und Schwere der Infektion innerhalb von Gemeinschaften oder Familien nicht einheitlich.[65] Ein kleiner Teil der Gemeindemitglieder beherbergt die Mehrheit der Würmer, und dies hängt vom Alter ab. Die maximale Wurmbelastung liegt im Alter von fünf bis zehn Jahren und sinkt danach rapide.[66] Es wird angenommen, dass die individuelle Veranlagung zur Helminthiasis für Menschen mit der gleichen Sanitärinfrastruktur und dem gleichen Hygieneverhalten auf unterschiedliche Immunkompetenz, Ernährungszustand und genetische Faktoren zurückzuführen ist.[65] Da Personen für eine hohe oder eine niedrige Wurmlast prädisponiert sind, ist die nach erfolgreicher Behandlung wieder erworbene Belastung proportional zu der vor der Behandlung.[65]
Verlorene, gesunde Lebensjahre
[Bearbeiten | Quelltext bearbeiten]Es wird geschätzt, dass Darmnematodeninfektionen dazu führen, dass 5 Millionen verlorene, gesunde Lebensjahre (DALYS) verloren gehen, von denen Hakenwurminfektionen mehr als 3 Millionen DALYS- und Ascaris-Infektionen mehr als 1 Million ausmachen.[67] Es gibt auch Anzeichen für Fortschritte: Die 2015 veröffentlichte Global Burden of Disease Studie schätzt eine 46-prozentige (59 Prozent, wenn das Alter standardisiert ist) der Jahre mit Behinderung (YLD) für den 23-jährigen Zeitraum von 1990 bis 2013 für alle Darm-/Nematodeninfektionen und sogar eine 74-prozentige (80 Prozent, wenn das Alter standardisiert ist) Verringerung der YLD durch Askariasis.[68]
Todesfälle
[Bearbeiten | Quelltext bearbeiten]Bis zu 135.000 Menschen sterben jährlich an bodenübertragener Helminthiasis.[3][69][70]
Die Global Burden of Disease Studie 1990–2013 schätzte 5.500 direkte Todesfälle durch Schistosomiasis,[71] während 2013 schätzungsweise mehr als 200.000 Menschen jährlich an Ursachen im Zusammenhang mit Schistosomiasis sterben.[72] Weitere 20 Millionen haben schwerwiegende Folgen der Krankheit.[73] Es ist die tödlichste der vernachlässigten Tropenkrankheiten.
| Helminth Gattungen | Allgemeiner Name | Infektionen (Millionen pro Jahr) | Direkte Todesfälle pro Jahr | Verbreitungsgebiet |
|---|---|---|---|---|
| Bodenübertragene Helminthiasis (STH) (klassifiziert als vernachlässigte Tropenkrankheit):[65] | ||||
| Ascaris lumbricoides | Rundwurm | 1000 bis 1450 / 807 bis 1.121 | 20.000 | Viele Regionen Südostasiens, Afrikas sowie Mittel- und Südamerikas[74][75][76][77][78] |
| Trichuris trichiura | Peitschenwurm | 500 604–795 |
In feuchten, warmen, tropischen Regionen Asiens, Afrikas, Mittel- und Südamerikas und der karibischen Inseln.[76][77][78][79] | |
| Ancylostoma duodenale | Hakenwurm | 900 bis 1300
576–740 (Hakenwurm im Allgemeinen) |
In tropischen und subtropischen Ländern (Subsahara-Afrika)[79] | |
| Necator americanus | ||||
| Strongyloides stercoralis | Hakenwurm | 50 bis 100 | Tausend | In feuchten Regengebieten der Tropen und Subtropen, in einigen Gebieten Süd- und Osteuropas und der Vereinigten Staaten von Amerika[77] |
| Alle STH zusammen | 1500 bis 2000 | 135.000 | Tropische und subtropische Gebiete, insbesondere Subsahara-Afrika, Amerika, China und Ostasien.[6] | |
| Nicht über den Boden übertragen, sondern als vernachlässigte Tropenkrankheit eingestuft: | ||||
| Schistosoma mansoni | Pärchenegel | Alle Arten von Schistosomazusammen: 160 bis 200
(210 „betroffen“) |
12.000–150.000 Todesfälle durch Nierenversagen 200.000 indirekte Todesfälle durch „Ursachen im Zusammenhang mit“ Schistosomiasis |
In tropischen und subtropischen Regionen[76][77][78][79] |
| Schistosoma haematobium | 112 (allein in Subsahara-Afrika) | |||
| Echinococcus granulosus | 3 | Entwicklungsländer | ||
| Nicht über den Boden übertragen und nicht als vernachlässigte Tropenkrankheit eingestuft: | ||||
| Toxocara canis | Hund Rundwurm | 50 | Viele Regionen Südostasiens, Afrikas sowie Mittel- und Südamerikas[74][75][76][77][78] | |
| Taenia solium | Schweinebandwurm | 50 | Südamerika, Südostasien, Westafrika und Ostafrika[76][77][78] | |
| Taenia saginata | Rinderbandwurm | 50 Alle Arten von „Taenia“: 40 bis 60 | ||
| Hymenolepis nana | Zwergbandwurm | 100 | ||
| Hymenolepis diminuta | Rattenbandwurm | |||
| Fasciola hepatica, Fascioloides magna |
Großer Leberegel | 50 | Groß in Süd- und Ostasien, aber auch in Mittel- und Osteuropa[77] | |
| Fasciolopsis buski | Riesendarmegel | |||
| Dracunculus medinensis | Medinawurm | Heutzutage vernachlässigbar dank Ausrottungsprogramm | Früher weit verbreitet in Indien, Westafrika und Südsudan[77] | |
| Trichostrongylus orientalis | Rundwurm | 1–3 („mehrere“) | Ländliche Gemeinden in Asien[77] | |
| Andere | 100 | Weltweit[77] | ||
| Gesamt (Anzahl der Infektionen) | Ca. 3,5 Milliarden | Weltweit | ||
Siehe auch
[Bearbeiten | Quelltext bearbeiten]- Bandwurmerkrankungen des Hundes
- Fadenwurminfektionen des Hundes
- Wurminfektionen der Katze
- Zwergfadenwurm
- Zahnwurm
- Helminthologie
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Neglected Tropical Diseases. CDC, 7. März 2022, abgerufen am 6. April 2022 (amerikanisches Englisch).
- ↑ London Declaration on Neglected Tropical Diseases. (PDF) 30. Januar 2012, abgerufen am 6. April 2022.
- ↑ a b c d e f g h Prevention and Control of Intestinal Parasitic Infections. (PDF) 1987, abgerufen am 6. April 2022.
- ↑ a b Joy Miller Del Rosso, Tonia Marek: Class Action: Improving School Performance in the Developing World Through Better Health and Nutrition. World Bank Publications, 1996, ISBN 978-0-8213-3672-4 (google.com).
- ↑ a b World Health Organization, TDR Disease Reference Group on Helminth Infections: Research priorities for helminth infections. In: World Health Organization Technical Report Series. Nr. 972, 2012, ISSN 0512-3054, S. xv–xvii, 1–174, back cover, PMID 23420950.
- ↑ a b c d Soil-transmitted helminth infections. WHO, 20. August 2012, archiviert vom am 20. August 2012; abgerufen am 6. April 2022. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Oscar H. Del Brutto: Neurocysticercosis: a review. In: TheScientificWorldJournal. Band 2012, 2012, ISSN 1537-744X, S. 159821, doi:10.1100/2012/159821, PMID 22312322, PMC 3261519 (freier Volltext).
- ↑ a b c T. E. Madiba, G. P. Hadley: Surgical management of worm volvulus. In: South African Journal of Surgery. Suid-Afrikaanse Tydskrif Vir Chirurgie. Band 34, Nr. 1, Februar 1996, ISSN 0038-2361, S. 33–35; discussion 35–36, PMID 8629187.
- ↑ P. L. Minciullo, A. Cascio, A. David, L. M. Pernice, G. Calapai: Anaphylaxis caused by helminths: review of the literature. In: European Review for Medical and Pharmacological Sciences. Band 16, Nr. 11, Oktober 2012, ISSN 1128-3602, S. 1513–1518, PMID 23111963.
- ↑ David T. John: Markell and Voge’s medical parasitology. 9th ed Auflage. Saunders Elsevier, St. Louis, Mo. 2006, ISBN 978-0-7216-4793-7.
- ↑ Alba Cortés, Carla Muñoz-Antoli, J. Guillermo Esteban, Rafael Toledo: Th2 and Th1 Responses: Clear and Hidden Sides of Immunity Against Intestinal Helminths. In: Trends in Parasitology. Band 33, Nr. 9, September 2017, ISSN 1471-5007, S. 678–693, doi:10.1016/j.pt.2017.05.004, PMID 28566191.
- ↑ Aidil Zaini, Kim L. Good-Jacobson, Colby Zaph: Context-dependent roles of B cells during intestinal helminth infection. In: PLoS neglected tropical diseases. Band 15, Nr. 5, Mai 2021, ISSN 1935-2735, S. e0009340, doi:10.1371/journal.pntd.0009340, PMID 33983946, PMC 8118336 (freier Volltext).
- ↑ Elly van Riet, Franca C. Hartgers, Maria Yazdanbakhsh: Chronic helminth infections induce immunomodulation: consequences and mechanisms. In: Immunobiology. Band 212, Nr. 6, 2007, ISSN 0171-2985, S. 475–490, doi:10.1016/j.imbio.2007.03.009, PMID 17544832.
- ↑ Zilungile L. Mkhize-Kwitshana, Musawenkosi H. L. Mabaso: Status of medical parasitology in South Africa: new challenges and missed opportunities. In: Trends in Parasitology. Band 28, Nr. 6, Juni 2012, ISSN 1471-5007, S. 217–219, doi:10.1016/j.pt.2012.03.005, PMID 22525798.
- ↑ G. Borkow, Z. Bentwich: Eradication of helminthic infections may be essential for successful vaccination against HIV and tuberculosis. In: Bulletin of the World Health Organization. Band 78, Nr. 11, 2000, ISSN 0042-9686, S. 1368–1369, PMID 11143198, PMC 2560630 (freier Volltext).
- ↑ Alexander J. Lankowski, Alexander C. Tsai, Michael Kanyesigye, Mwebesa Bwana, Jessica E. Haberer: Empiric deworming and CD4 count recovery in HIV-infected Ugandans initiating antiretroviral therapy. In: PLoS neglected tropical diseases. Band 8, Nr. 8, August 2014, ISSN 1935-2735, S. e3036, doi:10.1371/journal.pntd.0003036, PMID 25101890, PMC 4125278 (freier Volltext).
- ↑ Arianna Rubin Means, Paul Burns, David Sinclair, Judd L. Walson: Antihelminthics in helminth-endemic areas: effects on HIV disease progression. In: The Cochrane Database of Systematic Reviews. Band 4, 14. April 2016, ISSN 1469-493X, S. CD006419, doi:10.1002/14651858.CD006419.pub4, PMID 27075622, PMC 4963621 (freier Volltext).
- ↑ a b Derek Wakelin: Helminths: Pathogenesis and Defenses. In: Medical Microbiology. 4th Auflage. University of Texas Medical Branch at Galveston, Galveston (TX) 1996, ISBN 978-0-9631172-1-2, PMID 21413312 (nih.gov [abgerufen am 6. April 2022]).
- ↑ a b c d e B Levinger: Nutrition, Health, and Learning: Current Issues and Trends. (PDF) 1992, abgerufen am 6. April 2022.
- ↑ a b World Development Report 1993: Investing in Health. (PDF) Archiviert vom (nicht mehr online verfügbar) am 25. Februar 2014; abgerufen am 6. April 2022. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ a b c d W. E. Watkins, E. Pollitt: “Stupidity or worms”: do intestinal worms impair mental performance? In: Psychological Bulletin. Band 121, Nr. 2, März 1997, ISSN 0033-2909, S. 171–191, doi:10.1037/0033-2909.121.2.171, PMID 9100486.
- ↑ D. W. T. Crompton, David William Thomasson Crompton: Human Nutrition and Parasitic Infection: Volume 107, Parasitology Supplement 1993. Cambridge University Press, 1994, ISBN 978-0-521-45601-2 (google.com).
- ↑ Rebecca J. Stoltzfus, Hababu M. Chway, Antonio Montresor, James M. Tielsch, Jape Khatib Jape: Low dose daily iron supplementation improves iron status and appetite but not anemia, whereas quarterly anthelminthic treatment improves growth, appetite and anemia in Zanzibari preschool children. In: The Journal of Nutrition. Band 134, Nr. 2, Februar 2004, ISSN 0022-3166, S. 348–356, doi:10.1093/jn/134.2.348, PMID 14747671.
- ↑ M. J. Boivin, B. Giordani: Improvements in cognitive performance for schoolchildren in Zaire, Africa, following an iron supplement and treatment for intestinal parasites. In: Journal of Pediatric Psychology. Band 18, Nr. 2, April 1993, ISSN 0146-8693, S. 249–264, doi:10.1093/jpepsy/18.2.249, PMID 8492277.
- ↑ C. Nokes, S. M. Grantham-McGregor, A. W. Sawyer, E. S. Cooper, D. A. Bundy: Parasitic helminth infection and cognitive function in school children. In: Proceedings. Biological Sciences. Band 247, Nr. 1319, 22. Februar 1992, ISSN 0962-8452, S. 77–81, doi:10.1098/rspb.1992.0011, PMID 1349184.
- ↑ Amara E. Ezeamama, Jennifer F. Friedman, Luz P. Acosta, David C. Bellinger, Gretchen C. Langdon: Helminth infection and cognitive impairment among Filipino children. In: The American Journal of Tropical Medicine and Hygiene. Band 72, Nr. 5, Mai 2005, ISSN 0002-9637, S. 540–548, PMID 15891127, PMC 1382476 (freier Volltext).
- ↑ H. Sakti, C. Nokes, W. S. Hertanto, S. Hendratno, A. Hall: Evidence for an association between hookworm infection and cognitive function in Indonesian school children. In: Tropical medicine & international health: TM & IH. Band 4, Nr. 5, Mai 1999, ISSN 1360-2276, S. 322–334, doi:10.1046/j.1365-3156.1999.00410.x, PMID 10402967.
- ↑ C. Maya, F. J. Torner-Morales, E. S. Lucario, E. Hernández, B. Jiménez: Viability of six species of larval and non-larval helminth eggs for different conditions of temperature, pH and dryness. In: Water Research. Band 46, Nr. 15, 1. Oktober 2012, ISSN 1879-2448, S. 4770–4782, doi:10.1016/j.watres.2012.06.014, PMID 22794801.
- ↑ Why Water – Impact of the Global Water Crisis. Abgerufen am 6. April 2022 (englisch).
- ↑ Microbiological and health related perspectives of geophagia: an overview. 2010, abgerufen am 6. April 2022.
- ↑ a b c D. W. T. Crompton, Lorenzo Savioli: Handbook of Helminthiasis for Public Health. CRC Press, 2006, ISBN 978-1-4200-0494-6 (google.com).
- ↑ Stefanie J. Krauth, Jean T. Coulibaly, Stefanie Knopp, Mahamadou Traoré, Eliézer K. N'Goran: An in-depth analysis of a piece of shit: distribution of Schistosoma mansoni and hookworm eggs in human stool. In: PLoS neglected tropical diseases. Band 6, Nr. 12, 2012, ISSN 1935-2735, S. e1969, doi:10.1371/journal.pntd.0001969, PMID 23285307, PMC 3527364 (freier Volltext).
- ↑ a b Sara Lustigman, Roger K. Prichard, Andrea Gazzinelli, Warwick N. Grant, Boakye A. Boatin: A research agenda for helminth diseases of humans: the problem of helminthiases. In: PLoS neglected tropical diseases. Band 6, Nr. 4, 2012, ISSN 1935-2735, S. e1582, doi:10.1371/journal.pntd.0001582, PMID 22545164, PMC 3335854 (freier Volltext).
- ↑ P. W. Hunt, J. Lello: How to make DNA count: DNA-based diagnostic tools in veterinary parasitology. In: Veterinary Parasitology. Band 186, Nr. 1-2, 4. Mai 2012, ISSN 1873-2550, S. 101–108, doi:10.1016/j.vetpar.2011.11.055, PMID 22169224.
- ↑ Water, Sanitation & Hygiene. Bill & Melinda Gates Foundation, 7. November 2017, archiviert vom (nicht mehr online verfügbar) am 7. November 2017; abgerufen am 6. April 2022. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Water, Sanitation and Hygiene. UNICEF, 24. April 2015, archiviert vom (nicht mehr online verfügbar) am 24. April 2015; abgerufen am 6. April 2022. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Kathrin Ziegelbauer, Benjamin Speich, Daniel Mäusezahl, Robert Bos, Jennifer Keiser: Effect of sanitation on soil-transmitted helminth infection: systematic review and meta-analysis. In: PLoS medicine. Band 9, Nr. 1, Januar 2012, ISSN 1549-1676, S. e1001162, doi:10.1371/journal.pmed.1001162, PMID 22291577, PMC 3265535 (freier Volltext).
- ↑ Eric C. Strunz, David G. Addiss, Meredith E. Stocks, Stephanie Ogden, Jürg Utzinger: Water, sanitation, hygiene, and soil-transmitted helminth infection: a systematic review and meta-analysis. In: PLoS medicine. Band 11, Nr. 3, März 2014, ISSN 1549-1676, S. e1001620, doi:10.1371/journal.pmed.1001620, PMID 24667810, PMC 3965411 (freier Volltext).
- ↑ Peter J. Hotez, David Diemert, Kristina M. Bacon, Coreen Beaumier, Jeffrey M. Bethony: The Human Hookworm Vaccine. In: Vaccine. 31 Suppl 2, 18. April 2013, ISSN 1873-2518, S. B227–232, doi:10.1016/j.vaccine.2012.11.034, PMID 23598487, PMC 3988917 (freier Volltext).
- ↑ List of Anthelmintics (antihelminthics). Abgerufen am 7. April 2022 (englisch).
- ↑ Overview of Anthelmintics. In: Pharmacology. Abgerufen am 7. April 2022 (amerikanisches Englisch).
- ↑ Luis Pérez del Villar, Francisco J. Burguillo, Julio López-Abán, Antonio Muro: Systematic review and meta-analysis of artemisinin based therapies for the treatment and prevention of schistosomiasis. In: PloS One. Band 7, Nr. 9, 2012, ISSN 1932-6203, S. e45867, doi:10.1371/journal.pone.0045867, PMID 23029285, PMC 3448694 (freier Volltext).
- ↑ D. W. T. Crompton, World Health Organization: Preventive chemotherapy in human helminthiasis: coordinated use of anthelminthic drugs in control interventions: a manual for health professionals and programme managers. World Health Organization, Geneva, Switzerland 2006, ISBN 978-92-4154710-9.
- ↑ Roger K. Prichard, María-Gloria Basáñez, Boakye A. Boatin, James S. McCarthy, Héctor H. García: A research agenda for helminth diseases of humans: intervention for control and elimination. In: PLoS neglected tropical diseases. Band 6, Nr. 4, 2012, ISSN 1935-2735, S. e1549, doi:10.1371/journal.pntd.0001549, PMID 22545163, PMC 3335868 (freier Volltext).
- ↑ Donald A. P. Bundy, Judd L. Walson, Kristie L. Watkins: Worms, wisdom, and wealth: why deworming can make economic sense. In: Trends in Parasitology. Band 29, Nr. 3, März 2013, ISSN 1471-5007, S. 142–148, doi:10.1016/j.pt.2012.12.003, PMID 23332661.
- ↑ Marco Albonico, Henrietta Allen, Lester Chitsulo, Dirk Engels, Albis-Francesco Gabrielli: Controlling soil-transmitted helminthiasis in pre-school-age children through preventive chemotherapy. In: PLoS neglected tropical diseases. Band 2, Nr. 3, 26. März 2008, ISSN 1935-2735, S. e126, doi:10.1371/journal.pntd.0000126, PMID 18365031, PMC 2274864 (freier Volltext).
- ↑ Edward Miguel, Michael Kremer: Worms: Identifying Impacts on Education and Health in the Presence of Treatment Externalities. In: Econometrica. Band 72, Nr. 1, Januar 2004, ISSN 0012-9682, S. 159–217, doi:10.1111/j.1468-0262.2004.00481.x.
- ↑ Worm Wars: The Anthology. Abgerufen am 7. April 2022 (englisch).
- ↑ Nigel Hawkes: Deworming debunked. In: BMJ (Clinical research ed.). Band 346, 2. Januar 2012, ISSN 1756-1833, S. e8558, doi:10.1136/bmj.e8558, PMID 23284157.
- ↑ David C. Taylor-Robinson, Nicola Maayan, Sarah Donegan, Marty Chaplin, Paul Garner: Public health deworming programmes for soil-transmitted helminths in children living in endemic areas. In: The Cochrane Database of Systematic Reviews. Band 9, 11. September 2019, ISSN 1469-493X, S. CD000371, doi:10.1002/14651858.CD000371.pub7, PMID 31508807, PMC 6737502 (freier Volltext).
- ↑ When Should Governments Subsidize Health? The Case of Mass Deworming. Abgerufen am 7. April 2022.
- ↑ a b Worms in SA’s children. SuSanA, abgerufen am 7. April 2022.
- ↑ Wie dieses Buch entstanden ist und wie man es lesen kann (Vorwort und Dank). In: »... und wir gehören auch dazu«. 15. September 2015, S. XI–XIV, doi:10.13109/9783666336034.xi.
- ↑ World Health Organization: Schistosomiasis: progress report 2001–2011, strategic plan 2012–2020. World Health Organization, 2013, ISBN 978-92-4150317-4 (who.int [abgerufen am 7. April 2022]).
- ↑ Malaria. WHO, 14. Juni 2004, archiviert vom am 14. Juni 2004; abgerufen am 7. April 2022. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Lymphatic filariasis. WHO, 2. Mai 2004, archiviert vom am 2. Mai 2004; abgerufen am 7. April 2022. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ A global brief on vector-borne diseases. (PDF) März 2014, S. 22, abgerufen am 7. April 2022.
- ↑ Echinococcosis. WHO, 21. Februar 2014, archiviert vom am 21. Februar 2014; abgerufen am 7. April 2022. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Suvash Chandra Ojha, Chayannan Jaide, Natini Jinawath, Porpon Rotjanapan, Pankaj Baral: Geohelminths: public health significance. In: Journal of Infection in Developing Countries. Band 8, Nr. 1, 15. Januar 2014, ISSN 1972-2680, S. 5–16, doi:10.3855/jidc.3183, PMID 24423707.
- ↑ Under-nutrition and water, sanitation and hygiene. SuSanA, abgerufen am 7. April 2022.
- ↑ Dracunculiasis (guinea-worm disease). WHO, 30. Juli 2013, archiviert vom am 30. Juli 2013; abgerufen am 7. April 2022. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ A. Montresor: Helminth control in school-age children: a guide for managers of control programmes. World Health Organization, Geneva 2002, ISBN 1-4175-3106-1.
- ↑ Jeffrey Bethony, Simon Brooker, Marco Albonico, Stefan M. Geiger, Alex Loukas: Soil-transmitted helminth infections: ascariasis, trichuriasis, and hookworm. In: The Lancet. Band 367, Nr. 9521, 6. Mai 2006, S. 1521–1532, doi:10.1016/S0140-6736(06)68653-4, PMID 16679166.
- ↑ Corry Jeb Kucik, Gary L. Martin, Brett V. Sortor: Common intestinal parasites. In: American Family Physician. Band 69, Nr. 5, 1. März 2004, ISSN 0002-838X, S. 1161–1168, PMID 15023017.
- ↑ a b c d Alan J. Magill: Hunter’s tropical medicine and emerging infectious disease. 9. Auflage. Elsevier Health Sciences, London 2012, ISBN 978-1-4557-4043-7.
- ↑ Alan J. Magill: Hunter’s tropical medicine and emerging infectious disease. 9th ed Auflage. Elsevier Health Sciences, London 2012, ISBN 978-1-4557-4043-7.
- ↑ Peter J. Hotez, Miriam Alvarado, María-Gloria Basáñez, Ian Bolliger, Rupert Bourne: The global burden of disease study 2010: interpretation and implications for the neglected tropical diseases. In: PLoS neglected tropical diseases. Band 8, Nr. 7, Juli 2014, ISSN 1935-2735, S. e2865, doi:10.1371/journal.pntd.0002865, PMID 25058013, PMC 4109880 (freier Volltext).
- ↑ Global Burden of Disease Study 2013 Collaborators: Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013. In: The Lancet. Band 386, Nr. 9995, 22. August 2015, S. 743–800, doi:10.1016/S0140-6736(15)60692-4, PMID 26063472, PMC 4561509 (freier Volltext).
- ↑ Sara Lustigman, Roger K. Prichard, Andrea Gazzinelli, Warwick N. Grant, Boakye A. Boatin: A research agenda for helminth diseases of humans: the problem of helminthiases. In: PLoS neglected tropical diseases. Band 6, Nr. 4, 2012, ISSN 1935-2735, S. e1582, doi:10.1371/journal.pntd.0001582, PMID 22545164, PMC 3335854 (freier Volltext).
- ↑ Peiling Yap, Thomas Fürst, Ivan Müller, Susi Kriemler, Jürg Utzinger: Determining soil-transmitted helminth infection status and physical fitness of school-aged children. In: Journal of Visualized Experiments: JoVE. Nr. 66, 22. August 2012, ISSN 1940-087X, S. e3966, doi:10.3791/3966, PMID 22951972, PMC 3486755 (freier Volltext).
- ↑ GBD 2013 Mortality and Causes of Death Collaborators: Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013. In: The Lancet. Band 385, Nr. 9963, 10. Januar 2015, S. 117–171, doi:10.1016/S0140-6736(14)61682-2, PMID 25530442, PMC 4340604 (freier Volltext).
- ↑ Sophie A.-L. Thétiot-Laurent, Jérôme Boissier, Anne Robert, Bernard Meunier: Schistosomiasis chemotherapy. In: Angewandte Chemie (International Ed. in English). Band 52, Nr. 31, 29. Juli 2013, ISSN 1521-3773, S. 7936–7956, doi:10.1002/anie.201208390, PMID 23813602.
- ↑ M. M. Kheir, I. A. Eltoum, A. M. Saad, M. M. Ali, O. Z. Baraka: Mortality due to schistosomiasis mansoni: a field study in Sudan. In: The American Journal of Tropical Medicine and Hygiene. Band 60, Nr. 2, Februar 1999, ISSN 0002-9637, S. 307–310, doi:10.4269/ajtmh.1999.60.307, PMID 10072156.
- ↑ a b Irrigation in developing countries using Wastewater. (PDF) 2006, S. 229–250, archiviert vom ; abgerufen am 7. April 2022.
- ↑ a b B. Jimenez: Helminth ova removal from wastewater for agriculture and aquaculture reuse. In: Water Science & Technology. Band 55, Nr. 1-2, 1. Juli 2015, S. 485–493 (archive.org [abgerufen am 7. April 2022]).
- ↑ a b c d e I. Navarro et al.: Application of Helminth ova infection dose curve to estimate the risks associated with biosolid application on soil. In: Journal of Water and Health. Band 07, Nr. 1, 19. März 2015, S. 31–44 (archive.org [abgerufen am 7. April 2022]).
- ↑ a b c d e f g h i j Water for People Water for Life. (PDF) 2003, abgerufen am 7. April 2022.
- ↑ a b c d e WHO Model Prescribing Information: Drugs Used in Parasitic Diseases. Second Edition. 8. Mai 2009, archiviert vom am 11. Dezember 2014; abgerufen am 7. April 2022. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ a b c WHO Guidelines for the Safe Use of Wastewater, Excreta and Greywater. SuSanA, 17. Oktober 2014, archiviert vom am 17. Oktober 2014; abgerufen am 7. April 2022. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
