Taquicardia ventricular polimórfica catecolaminérgica
| Taquicardia ventricular polimórfica catecolaminérgica | ||
|---|---|---|
 Taquicardia ventricular bidireccional en un paciente con TVPC | ||
| Especialidad | Cardiología | |
| Síntomas | Desvanecimientos, muerte súbita cardiaca | |
| Causas | Genética | |
| Factores de riesgo | Antecedentes familiares | |
| Diagnóstico | Electrocardiograma (ECG), pruebas genéticas, provocación con adrenalina, pruebas de esfuerzo | |
| Diagnóstico diferencial | Síndrome de QT largo, síndrome de Brugada, síndrome de Andersen-Tawil, síndrome de repolarización precoz | |
| Tratamiento | Evitar el ejercicio extenuante, medicación, desfibrilador cardioversor implantable | |
| Medicación | Bloqueantes beta-adrenoceptores, Verapamilo, Flecainida | |
| Pronóstico | 13-20% arritmias potencialmente mortales en 7-8 años | |
| Frecuencia | 1:10,000 | |
| Sinónimos | ||
| TVPC | ||
La taquicardia ventricular polimórfica catecolaminérgica (TVPC) es un trastorno genético hereditario que predispone a los afectados a sufrir ritmos cardíacos anormales o arritmias potencialmente mortales. Las arritmias observadas en la TVPC suelen producirse durante el ejercicio o en momentos de estrés emocional, y adoptan clásicamente la forma de taquicardia ventricular bidireccional o fibrilación ventricular. Los afectados pueden ser asintomáticos, pero también pueden sufrir desvanecimientos o incluso muerte súbita cardiaca.
La TVPC está causada por mutaciones genéticas que afectan a proteínas que regulan las concentraciones de calcio en el interior de las células musculares cardiacas. El gen más comúnmente identificado es el RYR2, que codifica una proteína incluida en un canal iónico conocido como receptor de rianodina; este canal libera calcio del almacén interno de calcio de la célula, el retículo sarcoplásmico, durante cada latido cardíaco.
La TVPC suele diagnosticarse a partir de un ECG registrado durante una prueba de tolerancia al ejercicio, pero también puede diagnosticarse con una prueba genética. La enfermedad se trata con fármacos como los bloqueantes beta-adrenoceptores o la flecainida, o con procedimientos quirúrgicos como la denervación simpática y la implantación de un desfibrilador. Se cree que afecta a una de cada diez mil personas y se calcula que causa el 15% de todas las muertes cardiacas súbitas inexplicadas en jóvenes. La enfermedad se definió por primera vez en 1978[1] y la genética subyacente se describió en 2001.[2]
Señales y síntomas
[editar]Aunque es posible que las personas con TVPC no presenten ningún síntoma, los síntomas más frecuentes son los desmayos o la pérdida repentina del conocimiento, conocidos como síncopes.[3] Estos desmayos suelen producirse durante el ejercicio o como respuesta al estrés emocional, situaciones en las que se liberan en el organismo mensajeros químicos conocidos como catecolaminas, como la adrenalina. Los desmayos pueden interpretarse erróneamente como simples desvanecimientos o epilepsia, lo que a menudo retrasa el diagnóstico correcto.[4] En un tercio de los afectados, la primera manifestación de la enfermedad puede ser una parada cardiaca, que puede conducir a la muerte súbita.[5] Esto puede ocurrir en niños muy pequeños, en forma de síndrome de muerte súbita del lactante o «muerte súbita del lactante».[3] Aproximadamente el 30% de las personas con TVPC tendrán un familiar que haya sufrido desmayos, convulsiones o muerte súbita en respuesta al ejercicio o al estrés.[4]
En las personas con TVPC, la liberación de catecolaminas puede provocar un ritmo cardiaco anormal o arritmia conocida como taquicardia ventricular.[6] La taquicardia ventricular puede adoptar una forma característica conocida como taquicardia ventricular bidireccional. Esta forma de taquicardia ventricular se produce con relativa poca frecuencia, pero si se observa es indicativa de un diagnóstico subyacente de TVPC o de la afección relacionada con el síndrome de Andersen-Tawil.[5][7] Estas arritmias ventriculares en algunos casos terminan por sí solas, provocando un desmayo del que la persona se recupera. Sin embargo, si el ritmo cardiaco anormal continúa, puede degenerar en una arritmia más peligrosa conocida como fibrilación ventricular que causa una parada cardiaca y, si no se trata, la muerte súbita.[8]

Las personas con TVPC suelen presentar muy pocos signos anormales en la exploración clínica. Sin embargo, las personas con TVPC pueden desarrollar una alteración menos grave del ritmo cardiaco denominada fibrilación auricular, que puede detectarse en la exploración como un pulso irregular.[5] Además, aproximadamente el 20% de las personas con TVPC presentan una frecuencia cardiaca lenta en reposo conocida como bradicardia sinusal.[6]
Mecanismo
[editar]Acoplamiento excitación-contracción
[editar]Las arritmias que padecen los pacientes con TVPC se deben a anomalías en el modo en que las células musculares cardiacas controlan sus niveles de calcio.[9] El calcio interactúa con las fibras proteicas o miofibrillas del interior de la célula que permiten que ésta se contraiga, y la concentración de calcio en el interior de cada célula debe estar estrechamente regulada. Durante cada latido, la concentración de calcio debe aumentar para permitir que el músculo se contraiga y, a continuación, disminuir para permitir que el músculo se relaje, un proceso que se consigue utilizando un almacén dentro de la célula conocido como retículo sarcoplásmico.[10]

Al comienzo de cada latido, el retículo sarcoplásmico libera calcio a través de unos canales especializados denominados receptores de rianodina,[10] que se abren cuando aumenta la concentración de calcio cerca del canal. Esto ocurre cuando, en respuesta a una señal eléctrica procedente de la membrana celular denominada potencial de acción, una pequeña cantidad de calcio fluye a través de la membrana celular hacia el interior de la célula a través de canales de calcio de tipo L, muchos de los cuales están situados en bolsas interiores especializadas de la membrana denominadas túbulos T, diseñadas para acercar estos canales iónicos superficiales al retículo sarcoplásmico.[11]
El aumento de la concentración de calcio provoca que los receptores de rianodina del retículo sarcoplásmico liberen un chorro de calcio conocido como chispa de calcio. Cada chispa desencadena la liberación de más chispas de los receptores de rianodina vecinos para crear un aumento organizado de calcio en toda la célula conocido como transitorio de calcio. Al final de cada latido, el calcio es bombeado de vuelta por una proteína llamada ATPasa de Ca2+ del retículo sarco-endoplásmico (SERCA) junto con su proteína reguladora fosfolamban. A continuación, una proteína llamada calsequestrina retiene el calcio en el retículo sarcoplásmico.[10]
El ajuste fino de este proceso puede lograrse fosforilando estas proteínas. Por ejemplo, durante el ejercicio, las catecolaminas activan los beta-adrenoceptores en la superficie celular, lo que desencadena que la proteína quinasa A fosforile el canal de calcio de tipo L, aumentando el flujo de calcio en la célula. Al mismo tiempo, la fosforilación de la proteína reguladora fosfolamban hace que entre más calcio en el retículo sarcoplásmico. El efecto global de todo esto es generar un transitorio de calcio mayor con cada latido, lo que provoca una contracción más enérgica.[11]
Arritmias dependientes del calcio
[editar]Las alteraciones de las proteínas implicadas en el acoplamiento excitación-contracción pueden alterar este proceso cuidadosamente regulado. En las personas con TVPC, la regulación normalmente estricta del calcio puede alterarse y provocar arritmias.[9] Aunque el calcio suele liberarse del retículo sarcoplásmico en respuesta a un potencial de acción, también pueden producirse chispas de calcio de forma espontánea. En un corazón sano, una chispa de calcio espontánea suele ser un acontecimiento aislado y no va más allá, pero si los receptores de rianodina o las proteínas que los regulan son anormales, estas chispas pueden desencadenar liberaciones de los receptores de rianodina vecinos que se propagan por toda la célula en forma de una onda de calcio.[9] Estas ondas de calcio son mucho más probables cuando las células musculares cardíacas son estimuladas por catecolaminas como la adrenalina, que aumentan la concentración de calcio en el retículo sarcoplásmico y sensibilizan los receptores de rianodina.[12] La onda incontrolada de calcio puede ser expulsada a través de la membrana celular por el intercambiador sodio-calcio, provocando una corriente eléctrica conocida como posdespolarización retardada. Las posdespolarizaciones, si son lo suficientemente grandes, pueden desencadenar potenciales de acción adicionales, contracciones ventriculares prematuras o arritmias sostenidas.[13]
Causas
[editar]La TVPC puede estar causada por mutaciones en varios genes, todos ellos responsables de regular las concentraciones de calcio dentro de las células musculares cardiacas. La mutación genética más comúnmente identificada en la TVPC es una mutación en el gen RYR2, que codifica el receptor de rianodina cardiaco, responsable de liberar calcio del retículo sarcoplásmico.[14] También se han identificado mutaciones asociadas a la TVPC en el gen CASQ2, que codifica la calsequestrina,[15] una proteína que fija el calcio en el retículo sarcoplásmico. Otros genes asociados a formas más raras y atípicas de TVPC[14] son TECRL, que codifica la proteína enoil-CoA hidratasa (ECH) o crotonasa, CALM1, CALM2 y CALM3, que codifican la Calmodulina, y TRDN, que codifica la Triadina.[16]
| Tipo | OMIM | Gen | Lugar | Herencia | Notas |
|---|---|---|---|---|---|
| CPVT1 | 604772 | RYR2 | 1q42.1-q43 | AD | El receptor de rianodina libera calcio del retículo sarcoplásmico |
| CPVT2 | 611938 | CASQ2 | 1p13.3-p11 | AR | Tampón de calcio-calsequestrina en el retículo sarcoplásmico[5] |
| CPVT3 | 614021 | TECRL | 7p22-p14 | AR | La proteína trans-2,3-enoil-CoA reductasa interactúa con los receptores de rianodina y la calsequestrina. |
| CPVT4 | 614916 | CALM1 | 14q32.11 | AD | La calmodulina estabiliza los receptores de rianodina |
| CPVT5 | 615441 | TRDN | 6q22.31 | AR | La triadina forma un complejo con la calsequestrina para interactuar con los receptores de rianodina. |
CPVT1: Mutaciones RYR2
[editar]Las mutaciones genéticas más comúnmente identificadas en las personas con TVPC se producen en el gen RYR2, que codifica el receptor de rianodina cardiaco.[9] Las mutaciones en este gen dan lugar a una forma autosómica dominante de TVPC típica conocida como TVPC1.[14] Aunque el efecto exacto difiere entre las mutaciones específicas de este gen, muchas mutaciones del RYR2 hacen que el receptor de rianodina se abra en respuesta a concentraciones más bajas de calcio: el umbral para la liberación de calcio es más bajo.[9] Como resultado, el retículo sarcoplásmico libera calcio espontáneamente a través de estos receptores de rianodina anormales cuando aumenta la concentración de calcio en el retículo sarcoplásmico, un proceso conocido como liberación de calcio inducida por sobrecarga de almacenamiento.[8] El contenido de calcio del retículo sarcoplásmico aumenta en respuesta a la estimulación de las catecolaminas, lo que explica por qué las arritmias en las personas con TVPC se producen en momentos en los que los niveles de catecolaminas son elevados. Algunos sugieren que el aumento de la sensibilidad al calcio se produce sólo cuando el receptor de rianodina es fosforilado por la proteína quinasa A, mientras que otros sugieren que el aumento de la sensibilidad también se produce en condiciones de reposo.[9]
Se han propuesto dos teorías para el mecanismo subyacente por el que las mutaciones en el RYR2 promueven la liberación de calcio inducida por sobrecarga de almacenamiento: el desdoblamiento del dominio y la desvinculación de FKBP12.6.[8] El desdoblamiento del dominio se refiere a la separación de dos regiones importantes del receptor de rianodina, el N-terminal y el dominio central. A través de este mecanismo, una mutación podría desestabilizar el estado cerrado del receptor de rianodina y aumentar su sensibilidad al calcio.[8] Un segundo mecanismo potencial implica a la proteína reguladora FKBP12.6, una proteína que se une al receptor de rianodina y lo estabiliza. La unión de FKBP12.6 al receptor de rianodina está regulada por fosforilación. La fosforilación por la proteína quinasa A conduce a la disociación de FKBP12.6, lo que hace que el receptor de rianodina sea más sensible al calcio citosólico. Las mutaciones de RYR2 pueden interferir en la unión de FKB12.6 al receptor de rianodina y aumentar así la sensibilidad al calcio. Es probable que FKBP12.6 desempeñe un papel en algunas mutaciones de CPVT pero no en otras.[8]
Las mutaciones de RYR2 responsables de la TVPC se encuentran principalmente en los cuatro dominios principales del gen.[8] Las mutaciones que afectan a los dominios III y IV del gen (correspondientes a la región N-terminal de la proteína y al enlazador citosólico, respectivamente) se dan en el 46% de los casos. Las mutaciones que afectan a los dominios I y II, que codifican secciones de la región N-terminal de la proteína, se observan con menor frecuencia.[8] Las mutaciones de RYR2 asociadas a la TVPC que se producen fuera de estos cuatro dominios son muy raras, siendo responsables de tan sólo el 10% de los casos notificados. Las mutaciones de RYR2 suelen ser mutaciones sin sentido, como sustituciones de un solo nucleótido que provocan la sustitución de un aminoácido por otro, aunque también se han descrito sustituciones dentro del marco y duplicaciones. No se han descrito mutaciones sin sentido más perjudiciales asociadas a la TVPC, potencialmente porque estas variantes pueden dar lugar a diferentes enfermedades cardiacas, como las miocardiopatías.[8]
CPVT2: mutaciones CASQ2
[editar]Las mutaciones en el gen CASQ2 se asocian a una forma autosómica recesiva de TVPC típica conocida como TVPC2.[14] Este gen codifica la calsequestrina, la principal proteína de unión del calcio y amortiguador del calcio en el retículo sarcoplásmico.[17][18] Las mutaciones en CASQ2 representan sólo el 3-5% de los casos de TVPC.[14] Se han identificado catorce mutaciones en CASQ2 asociadas a la TVPC. Dos de ellas son mutaciones sin sentido que provocan que la proteína sea anormalmente corta, y dos son mutaciones de deleción, mientras que diez son mutaciones sin sentido que sustituyen un aminoácido por otro en la cadena que forma la proteína.[9] Las mutaciones en CASQ2 provocan una disminución de la capacidad de amortiguación del calcio del retículo sarcoplásmico. Esto significa que los cambios bruscos en el calcio total sarcoplásmico se amortiguarán menos y, por lo tanto, se traducirán en mayores cambios en el calcio libre. Los picos más altos de calcio libre tienen un mayor potencial para provocar la liberación de calcio del retículo sarcoplásmico inducida por sobrecarga de almacenamiento, lo que conduce a posdespolarizaciones.[8]
Además de su papel como amortiguador del calcio, la calsequestrina también regula la liberación de calcio del retículo sarcoplásmico modulando directamente los receptores de rianodina. Cuando la concentración de calcio es baja, los monómeros de calsecuestrina forman un complejo con las proteínas triadina y junctina, que inhiben los receptores de rianodina.[17] Sin embargo, a concentraciones elevadas de calcio, la calsecuestrina forma polímeros que se disocian del complejo del canal del receptor de rianodina, eliminando la respuesta inhibidora y aumentando la sensibilidad del receptor de rianodina a la liberación espontánea de calcio.[8]
La disminución de CASQ2 también se asocia con altos niveles de calreticulina, una proteína que, entre otras funciones, regula la recaptación de calcio en el retículo sarcoplásmico por SERCA.[19] En ausencia de CASQ2, los niveles de calreticulina aumentan y proporcionan cierta fijación compensatoria de calcio dentro del retículo sarcoplásmico. Es posible que la calreticulina contribuya a la generación de arritmias asociadas a mutaciones de CASQ2.[19]
Diagnóstico
[editar]
La TVPC puede ser difícil de diagnosticar, ya que la estructura del corazón parece normal en las personas afectadas por esta enfermedad cuando se evalúa mediante un ecocardiograma, una resonancia magnética cardiaca o una tomografía computarizada cardiaca, mientras que la función eléctrica del corazón también parece normal en reposo cuando se evalúa mediante un ECG estándar de 12 derivaciones.[3][20] Sin embargo, en respuesta al ejercicio o a catecolaminas como la adrenalina, pueden observarse ritmos cardiacos anormales como taquicardia ventricular bidireccional o frecuentes latidos ectópicos ventriculares polimórficos.[21]
Electrocardiograma de 12 derivaciones
[editar]El ECG de 12 derivaciones en reposo es una prueba útil para diferenciar la TVPC de otras enfermedades eléctricas del corazón que pueden causar ritmos cardíacos anormales similares. A diferencia de afecciones como el síndrome de QT largo y el síndrome de Brugada, el ECG de 12 derivaciones en reposo de los afectados por TVPC suele ser normal.[5] Sin embargo, aproximadamente el 20% de los afectados presentan una frecuencia cardiaca en reposo lenta o bradicardia sinusal.[5]
Ejercicio y otras pruebas de provocación
[editar]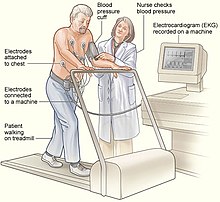
Las pruebas de esfuerzo, que suelen realizarse en una cinta de correr o en una bicicleta estática, pueden ayudar a diagnosticar la TVPC. Durante la prueba, las personas con TVPC suelen experimentar latidos ectópicos, que pueden evolucionar a taquicardia ventricular bidireccional y luego polimórfica a medida que aumenta la intensidad del ejercicio.[22] Algunas de las personas sospechosas de TVPC, como los niños pequeños, pueden no ser capaces de realizar una prueba de tolerancia al ejercicio. En estos casos, las formas alternativas de prueba incluyen la prueba de provocación con adrenalina, durante la cual se infunde adrenalina en una vena en dosis gradualmente crecientes bajo estrecha supervisión y monitorización ECG. [20]Además, puede realizarse una monitorización ECG a largo plazo o Holter, aunque esta forma de prueba tiene menos probabilidades de detectar una arritmia. Los estudios electrofisiológicos invasivos no proporcionan información útil para ayudar a diagnosticar la TVPC o para evaluar el riesgo de arritmias potencialmente mortales.[20][21]
Pruebas genéticas
[editar]La TVPC también puede diagnosticarse identificando una mutación causante de la enfermedad en un gen asociado a la TVPC mediante pruebas genéticas.[20][21] Esta técnica puede ser la única forma de identificar la afección en alguien sospechoso de padecer TVPC que ha fallecido, y en este caso puede conocerse como autopsia molecular.[23]
Tratamiento
[editar]El objetivo de los tratamientos de la TVPC es evitar que se produzcan ritmos cardíacos anormales letales y restablecer rápidamente un ritmo normal en caso de que se produzcan. Dado que las arritmias de la TVPC suelen producirse cuando el corazón está expuesto a altos niveles de adrenalina u otros mensajeros químicos similares (catecolaminas), muchos tratamientos de la TVPC tienen como objetivo reducir los niveles de catecolaminas a los que está expuesto el corazón o bloquear sus efectos en el corazón.[5] El tratamiento de primera línea para quienes padecen TVPC consiste en consejos sobre el estilo de vida. Esto incluye evitar los deportes de competición, el ejercicio muy extenuante y los entornos muy estresantes, ya que en estos entornos pueden producirse altos niveles de adrenalina, lo que puede provocar arritmias.[20]
Medicación
[editar]Varios medicamentos pueden ser útiles para los afectados de TVPC. Los pilares del tratamiento son los betabloqueantes, que bloquean los efectos de la adrenalina y otras catecolaminas en el corazón, reduciendo la posibilidad de que se produzcan ritmos cardíacos anormales.[20] De todos los betabloqueantes, el nadolol ha demostrado ser el más eficaz para tratar la TVPC.[24] Este fármaco reduce la frecuencia cardíaca en mayor medida que otros betabloqueantes y sólo debe tomarse una vez al día, lo que reduce el riesgo de omisión de dosis. El nadolol puede ser difícil de obtener y no está disponible en todos los países, y un betabloqueante alternativo adecuado para su uso en la TVPC puede ser el propranolol, que sin embargo tiene un régimen de dosificación más complejo.[24] Los datos publicados recientemente sugieren que el uso de betabloqueantes selectivos, como el atenolol, el bisoprolol o el metoprolol, se asocia a tasas de fracaso terapéutico muy elevadas.[24] La flecainida es un fármaco antiarrítmico de clase 1c que se recomienda a los pacientes con TVPC que experimentan ritmos cardíacos anormales a pesar de tomar un betabloqueante.[20] La flecainida reduce el riesgo de arritmias en los pacientes con TVPC, pero aún no se sabe con certeza cómo lo consigue. Algunos han sugerido que la flecainida interactúa directamente con el receptor de rianodina cardiaco, que suele ser anormal en los pacientes con TVPC, mientras que otros sugieren que los efectos antiarrítmicos de la flecainida se basan por completo en sus efectos bloqueantes de los canales de sodio.[25]
El verapamilo es un antagonista de los canales de calcio que, combinado con un betabloqueante, puede reducir el riesgo de arritmias en pacientes con TVPC.[26] La propafenona es otro antiarrítmico que puede reducir el riesgo de arritmias, potencialmente a través de efectos directos sobre el receptor de rianodina.[25]
Denervación simpática
[editar]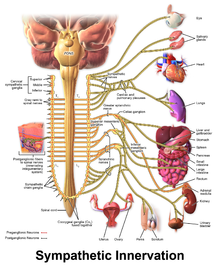
Algunas personas con TVPC siguen experimentando arritmias potencialmente mortales a pesar del tratamiento farmacológico. En este caso, puede utilizarse un procedimiento quirúrgico para afectar a los nervios que irrigan el corazón y que se comunican mediante catecolaminas.[20] Un conjunto de nervios conocido como sistema nervioso simpático irriga el corazón, así como otros órganos. El sistema nervioso simpático utiliza noradrenalina, una catecolamina, como mensajero químico o neurotransmisor, que puede favorecer las arritmias en las personas con TVPC.[20] Para evitarlo, se puede dañar intencionadamente una región del sistema nervioso simpático en una operación conocida como denervación simpática cardiaca o simpatectomía[27]. Aunque el sistema nervioso simpático alimenta al corazón desde ambos lados, durante la simpatectomía sólo se suelen atacar los nervios del lado izquierdo, aunque puede ser necesaria la destrucción de los nervios de ambos lados.[27] Mediante este proceso, la simpatectomía es eficaz para disminuir, aunque no eliminar, el riesgo de nuevas arritmias potencialmente mortales.[6]
Desfibrilador cardioversor implantable
[editar]
Mientras que la medicación y la simpatectomía tienen por objeto evitar que se produzcan ritmos cardiacos anormales, puede utilizarse un desfibrilador implantable (DAI) para tratar las arritmias que la medicación no ha podido evitar y restablecer un ritmo cardiaco normal.[20] Estos dispositivos, que suelen implantarse bajo la piel en la parte anterior del tórax, por debajo del hombro, pueden monitorizar continuamente el corazón para detectar ritmos cardiacos anormales. Si se detecta una arritmia potencialmente mortal, el dispositivo puede administrar una pequeña descarga eléctrica para detener el ritmo anormal y reiniciar el corazón.[4] Los desfibriladores implantables se recomiendan a menudo a las personas con TVPC que han sufrido desvanecimientos, arritmias ventriculares o paradas cardiacas a pesar de tomar la medicación adecuada.[20] Estos dispositivos salvan vidas, ya que se ha demostrado que su uso confiere un beneficio de supervivencia significativo en pacientes con TVPC.[24] Se ha sugerido que la oleada de adrenalina resultante causada por el dolor de una descarga eléctrica del dispositivo podría provocar teóricamente un ciclo de arritmias y descargas recurrentes conocido como tormenta eléctrica,[6] por lo que se recomienda encarecidamente que las personas con un DAI implantado por TVPC tomen un betabloqueante para amortiguar los efectos de la adrenalina.[6]
Pronóstico
[editar]Una proporción significativa de las personas con TVPC experimentarán un ritmo cardiaco anormal potencialmente mortal, con estimaciones de este riesgo que oscilan entre el 13 y el 20% en el transcurso de 7-8 años.[28] Es más probable que se produzcan arritmias potencialmente mortales si la TVPC se ha diagnosticado en la infancia, si una persona con TVPC no toma betabloqueantes y si se producen arritmias en las pruebas de esfuerzo a pesar de tomar betabloqueantes.[20] Durante el tratamiento con nadolol, el betabloqueante preferido para el tratamiento de la TVPC, las tasas de eventos se han estimado en un 0,8% anual. En los pacientes tratados con betabloqueantes, las arritmias potencialmente mortales son más probables si la persona ya ha sobrevivido a una parada cardiaca, ha sufrido un síncope o es portadora de mutaciones causantes de la enfermedad que afectan a la porción terminal altamente conservada del gen RYR2,[24] denominada dominio C-terminal (aminoácidos 4889-4969).[29]
Epidemiología
[editar]Se calcula que la TVPC afecta a 1 de cada 10.000 personas.[6] Los síntomas de la TVPC suelen aparecer por primera vez en la primera o segunda década de la vida,[24] y más del 60% de las personas afectadas experimentan su primer episodio de síncope o parada cardiaca a los 20 años.[3] El síncope durante el ejercicio o una emoción fuerte debe considerarse una señal de alarma,[24] ya que es una característica de la enfermedad. Por último, un pequeño número de pacientes puede presentar la enfermedad más tarde en la vida, y las pruebas genéticas en estos pacientes no suelen identificar un gen causante.[6]
Historia
[editar]En 1960, el cardiólogo noruego Knut Berg publicó un informe sobre tres hermanas que sufrían desvanecimientos durante el ejercicio o el estrés emocional en lo que hoy se reconoce como la primera descripción de la TVPC.[5] La taquicardia ventricular bidireccional asociada a esta afección se describió en 1975.[3] El término «taquicardia ventricular polimórfica catecolaminérgica» se utilizó por primera vez en 1978.[1] En 1999, se localizó en el cromosoma 1q42-q43 la primera mutación genética causante de la TVPC,[30] que en 2001 resultó ser una variante del gen RYR2.[2] Las investigaciones en curso tienen como objetivo identificar mejores tratamientos para la TVPC, aumentar el conocimiento de los mecanismos de la arritmia e identificar otros genes causantes de la enfermedad.[31]
Referencias
[editar]- ↑ a b Coumel, Philippe; Fidelle, J; Lucet, V; Attuel, P; Bouvrain, Y (1978). «"Catecholamine-induced severe ventricular arrhythmias with Adams-Stokes syndrome in children: report of four cases"». British Heart Journal.
- ↑ a b Priori, Silvia G.; Napolitano, Carlo; Tiso, Natascia; Memmi, Mirella; Vignati, Gabriele; Bloise, Raffaella; Sorrentino, Vincenzo; Danieli, Gian Antonio (16 de enero de 2001). «Mutations in the Cardiac Ryanodine Receptor Gene ( hRyR2 ) Underlie Catecholaminergic Polymorphic Ventricular Tachycardia». Circulation (en inglés) 103 (2): 196-200. ISSN 0009-7322. doi:10.1161/01.CIR.103.2.196. Consultado el 9 de septiembre de 2024.
- ↑ a b c d e Liu N, Napolitano C, Priori S (2013). «Chapter 31: Catecholaminergic Polymorphic Ventricular Tachycardia. In: Electrical diseases of the heart. Volume 2, Diagnosis and treatment». Arthur Wilde, Ihor Gussak, Michael J. Ackerman, Win-Kuang Shen, and Charles Antzelevitch (2nd ed.). London: Springer. ISBN 978-1-4471-4978-1. OCLC 846445829.
- ↑ a b c Liu N, Colombi B, Raytcheva-Buono EV, Bloise R, Priori SG (2007). «"Catecholaminergic polymorphic ventricular tachycardia"». Herz. PMID 17497254. doi:10.1007/s00059-007-2975-2.
- ↑ a b c d e f g h Lieve, Krystien V.; van der Werf, Christian; Wilde, Arthur A. (2016). «Catecholaminergic Polymorphic Ventricular Tachycardia». Circulation Journal 80 (6): 1285-1291. doi:10.1253/circj.CJ-16-0326. Consultado el 9 de septiembre de 2024.
- ↑ a b c d e f g Obeyesekere, Manoj N.; Antzelevitch, Charles; Krahn, Andrew D. (2015-02). «Management of Ventricular Arrhythmias in Suspected Channelopathies». Circulation: Arrhythmia and Electrophysiology (en inglés) 8 (1): 221-231. ISSN 1941-3149. doi:10.1161/CIRCEP.114.002321. Consultado el 9 de septiembre de 2024.
- ↑ Tristani-Firouzi M, Etheridge SP (2013). «"Chapter 32 - Andersen-Tawil and Timothy Syndromes"». In Gussak I, Antzelevitch C (eds.). Electrical diseases of the heart. Volume 1, Basic foundations and primary electrical diseases (2nd ed.). London: Springer. ISBN 978-1-4471-4881-4. OCLC 841465583.
- ↑ a b c d e f g h i j Priori, Silvia G; Chen, S. R. Wayne (1 de abril de 2011). «Inherited dysfunction of Sarcoplasmic Reticulum Ca2+ Handling and Arrhythmogenesis». Circulation research 108 (7): 871-883. ISSN 0009-7330. PMC 3085083. PMID 21454795. doi:10.1161/CIRCRESAHA.110.226845. Consultado el 9 de septiembre de 2024.
- ↑ a b c d e f g Venetucci L, Denegri M, Napolitano C, Priori SG (2012). «"Inherited calcium channelopathies in the pathophysiology of arrhythmias"». Nature Reviews Cardiology. PMID 22733215. doi:10.1038/nrcardio.2012.93.
- ↑ a b c Bers, DM (2001). «Excitation-contraction coupling and cardiac contractile force (2nd ed.)». Dordrecht: Kluwer Academic Publishers. ISBN 978-0-7923-7157-1. OCLC 47659382.
- ↑ a b Eisner, David A.; Caldwell, Jessica L.; Kistamás, Kornél; Trafford, Andrew W. (7 de julio de 2017). «Calcium and Excitation-Contraction Coupling in the Heart». Circulation Research 121 (2): 181-195. ISSN 0009-7330. PMC 5497788. PMID 28684623. doi:10.1161/CIRCRESAHA.117.310230. Consultado el 9 de septiembre de 2024.
- ↑ Bers, Donald M. (11 de enero de 2002). «Calcium and Cardiac Rhythms: Physiological and Pathophysiological». Circulation Research (en inglés) 90 (1): 14-17. ISSN 0009-7330. doi:10.1161/res.90.1.14. Consultado el 10 de septiembre de 2024.
- ↑ Pogwizd SM, Bers DM (2004). «"Cellular basis of triggered arrhythmias in heart failure".». Trends in Cardiovascular Medicine. PMID 15030791. doi:10.1016/j.tcm.2003.12.002.
- ↑ a b c d e Priori, Silvia G.; Mazzanti, Andrea; Santiago, Demetrio J.; Kukavica, Deni; Trancuccio, Alessandro; Kovacic, Jason C. (25 de mayo de 2021). «Precision Medicine in Catecholaminergic Polymorphic Ventricular Tachycardia: JACC Focus Seminar 5/5». Journal of the American College of Cardiology 77 (20): 2592-2612. ISSN 0735-1097. doi:10.1016/j.jacc.2020.12.073. Consultado el 10 de septiembre de 2024.
- ↑ Lahat, Hadas; Pras, Elon; Olender, Tsviya; Avidan, Nili; Ben-Asher, Edna; Man, Orna; Levy-Nissenbaum, Etgar; Khoury, Asad et al. (2001-12). «A Missense Mutation in a Highly Conserved Region of CASQ2 Is Associated with Autosomal Recessive Catecholamine-Induced Polymorphic Ventricular Tachycardia in Bedouin Families from Israel». American Journal of Human Genetics 69 (6): 1378-1384. ISSN 0002-9297. PMC 1235548. PMID 11704930. Consultado el 10 de septiembre de 2024.
- ↑ Roux-Buisson, Nathalie; Cacheux, Marine; Fourest-Lieuvin, Anne; Fauconnier, Jeremy; Brocard, Julie; Denjoy, Isabelle; Durand, Philippe; Guicheney, Pascale et al. (15 de junio de 2012). «Absence of triadin, a protein of the calcium release complex, is responsible for cardiac arrhythmia with sudden death in human». Human Molecular Genetics 21 (12): 2759-2767. ISSN 0964-6906. PMC 3363337. PMID 22422768. doi:10.1093/hmg/dds104. Consultado el 10 de septiembre de 2024.
- ↑ a b Faggioni, Michela; Kryshtal, Dmytro O.; Knollmann, Björn C. (2012-08). «Calsequestrin Mutations and Catecholaminergic Polymorphic Ventricular Tachycardia». Pediatric Cardiology 33 (6): 959-967. ISSN 0172-0643. PMC 3393815. PMID 22421959. doi:10.1007/s00246-012-0256-1. Consultado el 11 de septiembre de 2024.
- ↑ Liu N, Priori SG. «"Disruption of calcium homeostasis and arrhythmogenesis induced by mutations in the cardiac ryanodine receptor and calsequestrin"». Cardiovascular Research. doi:10.1093/cvr/cvm004. Consultado el 11 de septiembre de 2024.
- ↑ a b Landstrom, Andrew P.; Dobrev, Dobromir; Wehrens, Xander H.T. (9 de junio de 2017). «Calcium Signaling and Cardiac Arrhythmias». Circulation research 120 (12): 1969-1993. ISSN 0009-7330. PMC 5607780. PMID 28596175. doi:10.1161/CIRCRESAHA.117.310083. Consultado el 11 de septiembre de 2024.
- ↑ a b c d e f g h i j k l Priori, Silvia G.; Blomström-Lundqvist, Carina; Mazzanti, Andrea; Blom, Nico; Borggrefe, Martin; Camm, John; Elliott, Perry Mark; Fitzsimons, Donna et al. (29 de agosto de 2015). «2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death». European Heart Journal 36 (41): 2793-2867. ISSN 0195-668X. doi:10.1093/eurheartj/ehv316. Consultado el 11 de septiembre de 2024.
- ↑ a b c Silvia G. Priori, M. D.; Arthur A. Wilde, M. D.; Minoru Horie, M. D.; Yongkeun Cho, M. D.; Elijah R. Behr, M. A.; Charles Berul, M. D.; Nico Blom, M. D.; Josep Brugada, M. D. et al. (1 de febrero de 2014). HRS/EHRA/APHRS Expert Consensus Statement on the Diagnosis and Management of Patients with Inherited Primary Arrhythmia Syndromes (en inglés). doi:10.1016/j.joa.2013.07.002. Consultado el 11 de septiembre de 2024.
- ↑ Obeyesekere, Manoj N.; Klein, George J.; Modi, Simon; Leong-Sit, Peter; Gula, Lorne J.; Yee, Raymond; Skanes, Allan C.; Krahn, Andrew D. (2011-12). «How to Perform and Interpret Provocative Testing for the Diagnosis of Brugada Syndrome, Long-QT Syndrome, and Catecholaminergic Polymorphic Ventricular Tachycardia». Circulation: Arrhythmia and Electrophysiology (en inglés) 4 (6): 958-964. ISSN 1941-3149. doi:10.1161/CIRCEP.111.965947. Consultado el 11 de septiembre de 2024.
- ↑ Semsarian, Christopher; Ingles, Jodie (2016-10). «Molecular autopsy in victims of inherited arrhythmias». Journal of Arrhythmia 32 (5): 359-365. ISSN 1880-4276. PMC 5063264. PMID 27761159. doi:10.1016/j.joa.2015.09.010. Consultado el 11 de septiembre de 2024.
- ↑ a b c d e f g Mazzanti, Andrea; Kukavica, Deni; Trancuccio, Alessandro; Memmi, Mirella; Bloise, Raffaella; Gambelli, Patrick; Marino, Maira; Ortíz-Genga, Martín et al. (1 de mayo de 2022). «Outcomes of Patients With Catecholaminergic Polymorphic Ventricular Tachycardia Treated With β-Blockers». JAMA Cardiology 7 (5): 504-512. ISSN 2380-6583. doi:10.1001/jamacardio.2022.0219. Consultado el 11 de septiembre de 2024.
- ↑ a b Lieve, Krystien VV; Wilde, Arthur A; van der Werf, Christian (2016-05). «The Role of Flecainide in the Management of Catecholaminergic Polymorphic Ventricular Tachycardia». Arrhythmia & Electrophysiology Review 5 (1): 45-49. ISSN 2050-3369. PMC 4939313. PMID 27403293. doi:10.15420/aer.2016.3.3. Consultado el 11 de septiembre de 2024.
- ↑ Rosso R, Kalman JM, Rogowski O, Diamant S, Birger A, Biner S, Belhassen B, Viskin S (2007). «"Calcium channel blockers and beta-blockers versus beta-blockers alone for preventing exercise-induced arrhythmias in catecholaminergic polymorphic ventricular tachycardia"». Heart Rhythm. PMID 17765612. doi:10.1016/j.hrthm.2007.05.017.
- ↑ a b Schwartz PJ, De Ferrari GM, Pugliese L (2017). «"Cardiac sympathetic denervation 100years later: Jonnesco would have never believed it"». International Journal of Cardiology. PMID 28318666. doi:10.1016/j.ijcard.2017.03.020.
- ↑ Hayashi, Meiso; Denjoy, Isabelle; Extramiana, Fabrice; Maltret, Alice; Buisson, Nathalie Roux; Lupoglazoff, Jean-Marc; Klug, Didier; Hayashi, Miyuki et al. (12 de mayo de 2009). «Incidence and Risk Factors of Arrhythmic Events in Catecholaminergic Polymorphic Ventricular Tachycardia». Circulation (en inglés) 119 (18): 2426-2434. ISSN 0009-7322. doi:10.1161/CIRCULATIONAHA.108.829267. Consultado el 11 de septiembre de 2024.
- ↑ Dhindwal, Sonali; Lobo, Joshua; Cabra, Vanessa; Santiago, Demetrio J.; Nayak, Ashok R.; Dryden, Kelly; Samsó, Montserrat (23 de mayo de 2017). «A cryo-EM–based model of phosphorylation- and FKBP12.6-mediated allosterism of the cardiac ryanodine receptor». Science Signaling (en inglés) 10 (480). ISSN 1945-0877. doi:10.1126/scisignal.aai8842. Consultado el 11 de septiembre de 2024.
- ↑ Swan, Heikki; Piippo, Kirsi; Viitasalo, Matti; Heikkilä, Päivi; Paavonen, Timo; Kainulainen, Katariina; Kere, Juha; Keto, Pekka et al. (1 de diciembre de 1999). «Arrhythmic disorder mapped to chromosome 1q42–q43 causes malignant polymorphic ventricular tachycardia in structurally normal hearts». Journal of the American College of Cardiology 34 (7): 2035-2042. ISSN 0735-1097. doi:10.1016/S0735-1097(99)00461-1. Consultado el 11 de septiembre de 2024.
- ↑ Behere, Shashank P; Weindling, Steven N (2016). «Catecholaminergic polymorphic ventricular tachycardia: An exciting new era». Annals of Pediatric Cardiology 9 (2): 137-146. ISSN 0974-2069. PMC 4867798. PMID 27212848. doi:10.4103/0974-2069.180645. Consultado el 11 de septiembre de 2024.