Cancer des voies aérodigestives supérieures
| Médicament | Vinblastine, méthotrexate, carboplatine, docétaxel, pilocarpine, cisplatine, hydroxyurée, 5-Fluorouracile et chlorhydrate de doxorubicine (en) |
|---|---|
| Spécialité | Oncologie |
| CIM-10 |
C07-C14 C32-C33 |
|---|---|
| CIM-9 | 140-149 |
| MeSH | D006258 |
| Patient UK | Pharyngeal-Cancer |
Un cancer des voies aérodigestives supérieures (ou improprement cancer de la tête et du cou) est un cancer localisé au niveau des voies aérodigestives supérieures, ce qui regroupe les sinus, les fosses nasales, le pharynx (composé du nasopharynx, de l'oropharynx et de l'hypopharynx), la cavité buccale et le larynx. Outre la localisation, ce type de cancer partage, pour un certain nombre, plusieurs éléments : survenue liée à la consommation importante d'alcool et de tabac, type histologique de carcinome épidermoïde, exploration médicale ORL stéréotypée.
On distingue notamment parmi eux :
- le cancer de la bouche,
- le cancer du larynx,
- le cancer du nasopharynx.
Épidémiologie
[modifier | modifier le code]Les carcinomes épidermoïdes des voies aérodigestives supérieures sont le principal type de tumeur maligne de la région de la tête et du cou et le septième cancer le plus répandu dans le monde, représentant près d'un million de nouveaux cas et 470 000 décès en 2020 [1]. L'incidence des carcinomes épidermoïdes des voies aérodigestives supérieures continue d'augmenter et devrait atteindre un taux d'incidence annuel de 1,37 million de nouveaux cas d'ici 2040 [2],[3].
En France ,en 2023, il y a eu 9810 cas de cancer des voies aérodigestives supérieures[4].
Les principaux facteurs de risque externes associés à l'incidence du cancer des voies aérodigestives supérieures sont l'exposition à une consommation excessive d'alcool, à des agents cancérigènes liés au tabac, ou aux deux. Le carcinomes épidermoïdes de l'oropharynx sont associées à une infection antérieure par des souches oncogènes du papillomavirus humain avec plus de 70 % des cancers de l'oropharynx sont positifs au papillomavirus humain. Des études révèlent une tendance mondiale à la hausse des cancers liés au papillomavirus humain et à la diminution des cancers non liés au papillomavirus humain. Au cours des deux prochaines décennies, la majorité des cas de cancer des voies aérodigestives supérieures devraient être positifs pour le papillomavirus humain, certains pays comme le Royaume-Uni connaissant une incidence plus élevée de cancer de l'oropharynx que de cancer de la cavité buccale [5],[6].
Rôle du papillomavirus dans la survenue de cancer des voies aérodigestives supérieures
[modifier | modifier le code]L'infection à papillomavirus est l’infection sexuellement transmissible la plus répandue dans le monde et a des implications sociales importantes. Les femmes et les hommes sexuellement actifs sont sensibles à l’infection par le papillomavirus [7], même si tous les individus ne développeront pas les mêmes problèmes. L’infection au papillomavirus reste répandue dans le monde entier et constitue l’une des principales causes de cancer [8], en particulier chez les femmes, ce qui en fait une préoccupation majeure pour la santé publique.
Le papillomavirus a différentes souches, chacune identifiée par un numéro. Les souches sont classées en deux catégories : les papillomavirus à faible risque responsables de verrues anogénitales et cutanées, et les papillomavirus à haut risque responsables de cancers oropharyngés et anogénitaux [9],[10],[11],[12]. Le papillomavirus 16 est la souche à risque le plus élevé, représentant plus de 90 % des Cancer des voies aérodigestives supérieures associés au papillomavirus , tandis que d'autres souches de papillomavirus telles que les papillomavirus 18, 31, 33 et 52 ont été détectées chez une petite proportion de patients [13],[14],[15].
Mécanismes moléculaires
[modifier | modifier le code]
Le papillomavirus est un petit virus à ADN double brin non enveloppé (50 à 60 nm de diamètre) appartenant à la famille des Papillomaviridae. La transcription unidirectionnelle d'un brin de l'ADN génomique circulaire de 7 à 8 kb code pour huit protéines fonctionnelles précoces (E1 à E8), deux protéines structurelles tardives (L1 et L2) et une longue région de contrôle non codante également connue sous le nom de séquence régulatrice supérieure (upstream regulatory region ou URR) [16].
Le papillomavirus cible spécifiquement les cellules épithéliales basales, hébergées dans les couches profondes indifférenciées des épithéliums pavimenteux et/ou des muqueuses et possède une capacité mitotique élevée. Pour atteindre ces cellules cibles, la présence du virus sur la surface apicale externe de ces tissus s’appuie sur des microlésions qui surviennent lors d’événements traumatiques. En atteignant les cellules épithéliales basales, le virus est internalisé par endocytose. Il est ensuite transporté dans de petites vésicules à travers le réticulum endoplasmique et l'appareil de Golgi. Au cours de ce voyage, une série d'interactions et de changements structurels dans les vésicules se produisent, conduisant à l'élimination de la capside virale et à la libération du génome viral à proximité de la membrane nucléaire [17].
Le génome viral pénètre dans le noyau via les pores nucléaires et reste sous la forme d'un épisome (c'est-à-dire extrachromosomique) tandis que le processus de réplication virale se produit via l'expression et la fonction des gènes E1, E2, E5, E6 et E7 [18],[19]. Parmi les gènes transcrits au début du cycle de vie viral, E2, E5, E6 et E7 jouent un rôle crucial dans le détournement de l'environnement cellulaire propice à la réplication de l'ADN viral [20],[21]. La chronologie et le niveau d'expression du gène du papillomavirus progressent des cellules épithéliales basales aux cellules épithéliales suprabasales avec un assemblage ultime de virus dans les cellules différenciées en phase terminale. Il convient de noter que E6 et E7 interfèrent avec la fonction cellulaire en inhibant deux gènes suppresseurs de tumeurs importants, à savoir p53 et Rb, afin de favoriser la prolifération des cellules infectées. E6 provoque la dégradation de la protéine p53 en médiant son interaction avec la protéine associée à E6 (E6-AP) E3-ubiquitine ligase [22]. De même, Rb1 subit une séquestration et une protéolyse dues à la protéine E7 [23].
La régulation transcriptionnelle de tous les gènes fonctionnels et structurels du papilloma virus est modulée via la région régulatrice en amont (URR). L'URR induit la transcription des gènes en aval pour démarrer la réplication du génome viral lors de la liaison des protéines virales E1 et E2. Ce processus est également activé par des facteurs de transcription de la cellule hôte, tels que le neurofibromine 1, la protéine activatrice 1 , le transporteur cationique organique 1 (Organic anion transporter 1 Oct-1), le facteur d'élongation de traduction 1 (Eukaryotic translation elongation factor 1 TEF-1) et la protéine de spécificité 1 (Transcription factor Sp1 SP1) [24]. En plus du rôle transcriptionnel de l'URR, le site d'origine de la réplication (Ori) se situe dans cette région. Le site d'origine de la réplication joue un rôle essentiel dans la réplication du papillomavirus et est hautement homologue aux séquences conservées à réplication autonome des mammifères [25]. Chaque génome du papillomavirus ne contient qu'un seul site d'origine de la réplication nécessaire à la réplication de l'ADN viral [26].
Pronostic
[modifier | modifier le code]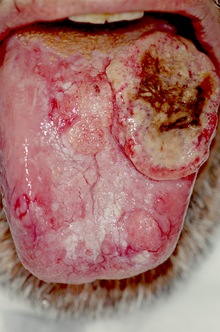
Le pronostic est variable selon la localisation, l'avancement et le type de cancer (atteinte locale pure, ganglionnaire et/ou métastatique). Au , la survie nette à 5 ans est de 37 % chez les hommes et de 50 % chez les femmes et à 10 ans de 18 % pour les hommes et de 22 % chez les femmes.
Sources de l'article
[modifier | modifier le code]*La section Rôle du papillomavirus dans la survenue de cancer des voies aérodigestives supérieures est une traduction incomplète de Tabatabaeian, H., Bai, Y., Huang, R. et al. Navigating therapeutic strategies: HPV classification in head and neck cancer. Br J Cancer (2024). https://doi.org/10.1038/s41416-024-02655-1 paru sous license Creative Commons Attribution 4.0 International
Notes et références
[modifier | modifier le code]- ↑ (en) Hyuna Sung, Jacques Ferlay, Rebecca L. Siegel et Mathieu Laversanne, « Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries », CA: A Cancer Journal for Clinicians, vol. 71, no 3, , p. 209–249 (ISSN 0007-9235 et 1542-4863, DOI 10.3322/caac.21660, lire en ligne, consulté le )
- ↑ WHO. Internation Agency for Research on Cancer. Lyon: WHO; 2023.
- ↑ (en) J. Ferlay, M. Colombet, I. Soerjomataram et C. Mathers, « Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods », International Journal of Cancer, vol. 144, no 8, , p. 1941–1953 (ISSN 0020-7136 et 1097-0215, DOI 10.1002/ijc.31937, lire en ligne, consulté le )
- ↑ Institut National du Cancer, « Panorama des cancers en France 2023 », (consulté le )
- ↑ (en) Mark Gormley, Grant Creaney, Andrew Schache et Kate Ingarfield, « Reviewing the epidemiology of head and neck cancer: definitions, trends and risk factors », British Dental Journal, vol. 233, no 9, , p. 780–786 (ISSN 1476-5373, PMID 36369568, PMCID PMC9652141, DOI 10.1038/s41415-022-5166-x, lire en ligne, consulté le )
- ↑ Karly S. Louie, Hisham Mehanna et Peter Sasieni, « Trends in head and neck cancers in England from 1995 to 2011 and projections up to 2025 », Oral Oncology, vol. 51, no 4, , p. 341–348 (ISSN 1368-8375, DOI 10.1016/j.oraloncology.2015.01.002, lire en ligne, consulté le )
- ↑ (en) Harrell W. Chesson, Eileen F. Dunne, Susan Hariri et Lauri E. Markowitz, « The Estimated Lifetime Probability of Acquiring Human Papillomavirus in the United States », Sexually Transmitted Diseases, vol. 41, no 11, , p. 660–664 (ISSN 0148-5717, PMID 25299412, PMCID PMC6745688, DOI 10.1097/OLQ.0000000000000193, lire en ligne, consulté le )
- ↑ Catherine de Martel, Damien Georges, Freddie Bray et Jacques Ferlay, « Global burden of cancer attributable to infections in 2018: a worldwide incidence analysis », The Lancet Global Health, vol. 8, no 2, , e180–e190 (ISSN 2214-109X, DOI 10.1016/s2214-109x(19)30488-7, lire en ligne, consulté le )
- ↑ Catherine de Martel, Jacques Ferlay, Silvia Franceschi et Jérôme Vignat, « Global burden of cancers attributable to infections in 2008: a review and synthetic analysis », The Lancet Oncology, vol. 13, no 6, , p. 607–615 (ISSN 1470-2045, DOI 10.1016/s1470-2045(12)70137-7, lire en ligne, consulté le )
- ↑ David Forman, Catherine de Martel, Charles J. Lacey et Isabelle Soerjomataram, « Global Burden of Human Papillomavirus and Related Diseases », Vaccine, vol. 30, , F12–F23 (ISSN 0264-410X, DOI 10.1016/j.vaccine.2012.07.055, lire en ligne, consulté le )
- ↑ (en) Asia Asiaf, Shiekh T. Ahmad, Sheikh O. Mohammad et Mohammad A. Zargar, « Review of the current knowledge on the epidemiology, pathogenesis, and prevention of human papillomavirus infection », European Journal of Cancer Prevention, vol. 23, no 3, , p. 206–224 (ISSN 0959-8278, DOI 10.1097/CEJ.0b013e328364f273, lire en ligne, consulté le )
- ↑ (en) Catherine de Martel, Martyn Plummer, Jerome Vignat et Silvia Franceschi, « Worldwide burden of cancer attributable to HPV by site, country and HPV type », International Journal of Cancer, vol. 141, no 4, , p. 664–670 (ISSN 0020-7136 et 1097-0215, PMID 28369882, PMCID PMC5520228, DOI 10.1002/ijc.30716, lire en ligne, consulté le )
- ↑ (en) Andrew P. Stein, Sandeep Saha, Jennifer L. Kraninger et Adam D. Swick, « Prevalence of Human Papillomavirus in Oropharyngeal Cancer: A Systematic Review », The Cancer Journal, vol. 21, no 3, , p. 138–146 (ISSN 1528-9117, PMID 26049691, PMCID PMC4459520, DOI 10.1097/PPO.0000000000000115, lire en ligne, consulté le )
- ↑ (en) Tatyana Isayeva, Yufeng Li, Daniel Maswahu et Margaret Brandwein-Gensler, « Human Papillomavirus in Non-Oropharyngeal Head and Neck Cancers: A Systematic Literature Review », Head and Neck Pathology, vol. 6, no 1, , p. 104–120 (ISSN 1936-0568, PMID 22782230, PMCID PMC3394168, DOI 10.1007/s12105-012-0368-1, lire en ligne, consulté le )
- ↑ (en) Dominique S. Michaud, Scott M. Langevin, Melissa Eliot et Heather H. Nelson, « High‐risk HPV types and head and neck cancer », International Journal of Cancer, vol. 135, no 7, , p. 1653–1661 (ISSN 0020-7136 et 1097-0215, DOI 10.1002/ijc.28811, lire en ligne, consulté le )
- ↑ (en) Harald zur Hausen, « Papillomaviruses and cancer: from basic studies to clinical application », Nature Reviews Cancer, vol. 2, no 5, , p. 342–350 (ISSN 1474-1768, DOI 10.1038/nrc798, lire en ligne, consulté le )
- ↑ (en) Lorena Urbanelli, Sandra Buratta, Brunella Tancini et Krizia Sagini, « The Role of Extracellular Vesicles in Viral Infection and Transmission », Vaccines, vol. 7, no 3, , p. 102 (ISSN 2076-393X, PMID 31466253, PMCID PMC6789493, DOI 10.3390/vaccines7030102, lire en ligne, consulté le )
- ↑ (en) Inci Aydin, Susanne Weber, Berend Snijder et Pilar Samperio Ventayol, « Large Scale RNAi Reveals the Requirement of Nuclear Envelope Breakdown for Nuclear Import of Human Papillomaviruses », PLOS Pathogens, vol. 10, no 5, , e1004162 (ISSN 1553-7374, PMID 24874089, PMCID PMC4038628, DOI 10.1371/journal.ppat.1004162, lire en ligne, consulté le )
- ↑ (en) Wei Zhang, Teymur Kazakov, Andreea Popa et Daniel DiMaio, « Vesicular Trafficking of Incoming Human Papillomavirus 16 to the Golgi Apparatus and Endoplasmic Reticulum Requires γ-Secretase Activity », mBio, vol. 5, no 5, (ISSN 2161-2129 et 2150-7511, DOI 10.1128/mBio.01777-14, lire en ligne, consulté le )
- ↑ Scott B. Vande Pol et Aloysius J. Klingelhutz, « Papillomavirus E6 oncoproteins », Virology, special Issue: The Papillomavirus Episteme, vol. 445, no 1, , p. 115–137 (ISSN 0042-6822, PMID 23711382, PMCID PMC3783570, DOI 10.1016/j.virol.2013.04.026, lire en ligne, consulté le )
- ↑ Ann Roman et Karl Munger, « The papillomavirus E7 proteins », Virology, special Issue: The Papillomavirus Episteme, vol. 445, no 1, , p. 138–168 (ISSN 0042-6822, PMID 23731972, PMCID PMC3783579, DOI 10.1016/j.virol.2013.04.013, lire en ligne, consulté le )
- ↑ Bharadwaj M, Hussain S, Tripathi R, Singh N, Mehrotra R. Human papillomavirus (HPV): diagnosis and treatment. In: Verma AS, Singh A, editors. Animal biotechnology. Amsterdam: Elsevier; 2014. p. 95–120.
- ↑ Kwang-Jin Oh, Anna Kalinina et Srilata Bagchi, « Destabilization of Rb by human papillomavirus E7 is cell cycle dependent: E2-25K is involved in the proteolysis », Virology, vol. 396, no 1, , p. 118–124 (ISSN 0042-6822, PMID 19906396, PMCID PMC2796474, DOI 10.1016/j.virol.2009.10.018, lire en ligne, consulté le )
- ↑ O’Connor M, Chan S-Y, Bernard H-U. Transcription factor binding sites in the long control region of genital HPVs. Hum Papillomaviruses. 1995;21–40.
- ↑ (en) Ningning Li, Wai Hei Lam, Yuanliang Zhai et Jiaxuan Cheng, « Structure of the origin recognition complex bound to DNA replication origin », Nature, vol. 559, no 7713, , p. 217–222 (ISSN 1476-4687, DOI 10.1038/s41586-018-0293-x, lire en ligne, consulté le )
- ↑ (en) Lulu Yu, Vladimir Majerciak et Zhi-Ming Zheng, « HPV16 and HPV18 Genome Structure, Expression, and Post-Transcriptional Regulation », International Journal of Molecular Sciences, vol. 23, no 9, , p. 4943 (ISSN 1422-0067, PMID 35563334, PMCID PMC9105396, DOI 10.3390/ijms23094943, lire en ligne, consulté le )
Liens externes
[modifier | modifier le code]
- Ressources relatives à la santé :
- [PDF]Les traitements des cancers des voies aérodigestives supérieures, institut national du cancer, 2012
