Syndrome hépatorénal
| Médicament | Terlipressine |
|---|---|
| Spécialité | Gastro-entérologie, infectiologie, hépatologie et médecine d'urgence |
| MedlinePlus | 000489 |
|---|---|
| MeSH | D006530 |
| Patient UK | Hepatorenal-Syndrome |
Le syndrome hépatorénal[1],[2],[3] (SHR en abrégé) est une affection médicale grave consistant en une détérioration rapide de la fonction rénale chez des individus atteints de cirrhose ou d'une insuffisance hépatique fulminante. Elle est généralement mortelle en l'absence de transplantation hépatique, bien que divers traitements, comme la dialyse, puissent aider le patient à court terme.
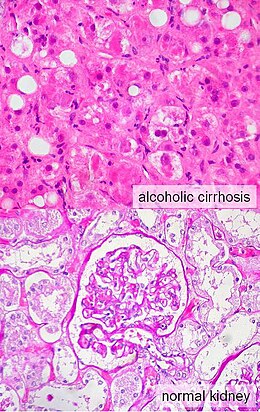
Il peut affecter des individus atteints de cirrhose (quelle qu'en soit la cause), d'hépatite alcoolique grave, ou d'une insuffisance hépatocellulaire fulminante et se produit généralement lorsque la fonction hépatique se détériore rapidement en raison d'une atteinte aiguë comme une infection, de saignements dans le tractus gastro-intestinal ou de quantités excessives de médicaments diurétiques. C'est une complication relativement fréquente des cirrhoses, survenant pour 18 % des malades dans l'année suivant leur diagnostic et dans 39 % dans les cinq ans.
On estime que la détérioration de la fonction hépatique provoque des changements dans la circulation sanguine intestinale, avec une diminution de la circulation sanguine et une baisse de pression dans les vaisseaux sanguins rénaux. L'insuffisance rénale du SHR est une conséquence de ces changements et ne résulte pas de lésions rénales : les reins eux-mêmes apparaissent normaux tant à l'œil nu qu'au microscope et ils fonctionnent même normalement s'ils sont placés dans un environnement sain (par exemple s'ils sont transplantés chez une personne avec un foie sain). Le diagnostic de syndrome hépatorénal est basé sur des tests en laboratoire.
On en définit deux formes :
- le type 1 entraîne une baisse rapidement progressive de la fonction rénale, tandis que
- le type 2 est associé à une ascite (accumulation de liquide dans l'abdomen) qui ne s'améliore pas malgré les diurétiques.
Le risque de décès est très élevé, la mortalité des individus atteints du type 1 étant de plus de 50 % à court terme, le seul traitement efficace sur un long terme étant la greffe de foie. Dans l'attente d'une transplantation, les gens reçoivent souvent des traitements d'appoints qui améliorent les anomalies du tonus des vaisseaux sanguins, avec des médicaments, ou la création d'un shunt intrahépatique par voie transjugulaire (en anglais Transjugular intrahepatic portosystemic shunt ou TIPS), avec mise en place d'une petite prothèse trans-hépatique reliant la veine porte à une veine sus-hépatique ayant pour but de faire chuter la pression veineuse dans la veine porte. Certains patients ont besoin d'une hémodialyse pour améliorer leur fonction rénale, ou d'une technique plus récente, appelée dialyse hépatique, qui utilise un circuit de dialyse avec des membranes imperméables à l'albumine pour éliminer les toxines normalement éliminées par le foie jusqu'à une possible transplantation hépatique.
Critères de diagnostic
[modifier | modifier le code]Des individus atteints de cirrhose ou d'hépatite fulminante peuvent avoir de nombreuses raisons de faire une insuffisance rénale et il est souvent difficile de distinguer le SHR des autres entités qui entraînent une insuffisance rénale dans le cadre d'une maladie hépatique avancée. Aussi des critères majeurs et mineurs ont été développés pour aider au diagnostic[4].
- Les critères majeurs sont :
- une insuffisance hépatocellulaire avec hypertension portale,
- une atteinte de la fonction rénale malgré une absence de choc, d'infection, de traitement récent par des médicaments néphrotoxiques et de pertes anormales de fluide (avec absence d'amélioration soutenue de la fonction rénale malgré un arrêt des diurétiques et un traitement par remplissage avec 1,5 litre de solution saline par voie intraveineuse),
- une protéinurie inférieure à 0,5 g/24h,
- une absence de maladie rénale ou d'obstruction des voies urinaires confirmée par échographie[4].
- Les critères mineurs sont les suivants :
- une oligurie (volume d'urine faible, inférieur à 500 ml par jour),
- une faible concentration en sodium dans les urines (inférieure à 10 mmol/L),
- une osmolalité urinaire supérieure à celle du plasma,
- une absence d'hématurie (inférieure à 50 hématies par millimètre cube) et
- une natrémie inférieure à 130 mmol/L[4].
Classification
[modifier | modifier le code]Le syndrome hépatorénal est un type particulier d'insuffisance rénale qui touche des personnes souffrant d'une cirrhose ou, plus rarement, d'une insuffisance hépatique fulminante[5]. Le syndrome implique la contraction des vaisseaux sanguins rénaux par suite de la chute de la pression sanguine en aval du foie, le sang s'accumulant dans le système porte qui reçoit le sang des veines des intestins[6]. La classification du syndrome hépatorénal identifie deux catégories d'insuffisance rénale aiguë qui se produisent tous deux chez les personnes ayant soit une cirrhose soit une insuffisance hépatique aigüe. Dans les deux cas, la détérioration de la fonction rénale est quantifiée, soit par une élévation de la concentration de la créatinine dans le sang, soit par diminution de la clairance de la créatinine[4].
Type 1
[modifier | modifier le code]Le type 1 se caractérise par une insuffisance rénale rapidement progressive, avec un doublement de la créatinine sérique pour arriver à un niveau supérieur à 221 µmol/L (25 mg·l-1) ou une diminution de moitié de la clairance de la créatinine pour arriver à une clairance inférieure à 20 mL/min sur une période de moins de deux semaines. Ces patients ont habituellement une pression artérielle basse et peuvent avoir besoin d'un traitement médicamenteux pour améliorer la force de contraction du muscle cardiaque (médicaments inotropes) ou pour maintenir la pression artérielle (médicaments vasopresseurs)[7].
Type 2
[modifier | modifier le code]En revanche, le type 2 est d'apparition et de progression plus lentes. Il se définit par une atteinte de la fonction rénale avec une concentration sérique de la créatinine supérieure à 133 µmol/L (15 mg/L) ou une clairance de la créatinine inférieure à 40 mL/min et une teneur en sodium des urines inférieure à 10 mmol/L[8]. Il offre également une perspective pauvre, avec une survie médiane d'environ six mois, sauf si la personne touchée bénéficie d'une transplantation hépatique. Il va s'accompagner d'un certain nombre de maladies associées à l'augmentation de pression dans la veine porte, qui va commencer par le développement de liquide dans l'abdomen (ascite). La maladie évolue avec une ascite devenant résistante aux diurétiques et où les reins vont être incapables d'excréter suffisamment de sodium malgré l'utilisation de diurétiques. La plupart des individus de type 2 ont une ascite-résistante aux diurétiques avant de développer une détérioration de la fonction rénale[9].
Signes et symptômes
[modifier | modifier le code]Les deux types de syndrome hépatorénal sont la résultante de trois composantes principales: l'altération de la fonction hépatique, des anomalies dans la circulation et une insuffisance rénale. Étant donné que ces phénomènes ne produisent pas forcément de symptômes avant la fin de leur cours, les individus qui en sont atteints ne sont habituellement diagnostiqués que si les résultats de laboratoire sont modifiés.
La plupart des gens qui développent ce syndrome ont une cirrhose et peuvent avoir aussi d'autres symptômes comme une jaunisse, une altération des facultés mentales, une perte de l'appétit et la présence d'ascite[6]. Plus précisément, une ascite qui résiste à l'utilisation de diurétiques est caractéristique d'un SHR de type 2. une oligurie (une diminution du volume des urines) peut être la conséquence de l'insuffisance rénale, mais certaines personnes continuent de produire une quantité normale d'urine[4]. Comme ces signes et symptômes ne se rencontrent pas nécessairement dans le syndrome, ils ne sont pas inclus dans les critères de diagnostic de cette affection, diagnostic fait seulement sur les résultats de tests de laboratoire, à l'exclusion de toute autre cause[4].
Causes
[modifier | modifier le code]Un syndrome hépatorénal affecte habituellement les personnes atteintes de cirrhose et de pression élevée dans le système porte (appelée hypertension portale). Alors que ce syndrome peut se développer dans n'importe quel type de cirrhose, il est plus fréquent chez les individus atteints de cirrhose alcoolique, surtout s'il ya une hépatite alcoolique concomitante identifiable sur des biopsies hépatiques[10]. Ce syndrome peut également se produire chez des individus sans cirrhose, mais avec l'apparition brutale d'un dérèglement aigu appelé hépatite fulminante[4],[10].
On a identifié certains facteurs déclenchants chez des personnes vulnérables ayant une cirrhose ou une insuffisance hépatique fulminante. Il s'agit notamment d'une infection bactérienne, d'une hépatite alcoolique aiguë ou des saignements dans le tractus gastro-intestinal supérieur. Une infection du liquide d'ascite (péritonite aigüe) est le facteur déclenchant le plus courant chez les individus atteints de cirrhose. Ils peuvent parfois être déclenchés par des traitements pour des complications hépatiques comme l'utilisation à trop forte dose de diurétiques ou des prélèvements de trop grands volumes d'ascite par ponction de la cavité abdominale sans compenser les pertes par administration d'un fluide de remplacement par voie intraveineuse[10].
Diagnostic différentiel
[modifier | modifier le code]Beaucoup d'autres maladies du rein sont associées à une maladie du foie et doivent être éliminées avant d'établir un diagnostic de SHR.
- Les personnes porteuses d'une atteinte pré-rénale (sténose d'une artère rénale, ..) n'ont pas de lésions au niveau des reins mais, comme les individus avec SHR, souffrent de dysfonction rénale en raison d'une diminution du flux sanguin vers les reins. Aussi, une défaillance prérénale entraîne la formation d'une urine qui a une très faible concentration en sodium. Cependant, contrairement au SHR, la pré-défaillance rénale répond habituellement bien au traitement par des perfusions intraveineuses, entraînant une diminution de la créatinine sérique et une excrétion accrue du sodium[4].
- La nécrose tubulaire aiguë (NTA) est due à des lésions des tubules rénaux et peut être une complication, chez les sujets atteints de cirrhose, de l'emploi de médicaments néphrotoxiques ou d'une diminution de la pression artérielle. En raison des lésions tubulaires, les reins sont généralement incapables de réabsorber suffisamment de sodium dans l'urine pour conserver une natrémie normale. En conséquence, la NTA se distingue du SHR par des bilans sanguins et urinaires, les individus ayant une NTA auront une natriurie beaucoup plus élevée que ceux ayant un SHR, mais cela n'est pas toujours le cas chez les cirrhotiques[7]. Les personnes atteintes d'une NTA peuvent en avoir éventuellement la preuve par la présence dans l'urine observée au microscope de cylindres hyalins alors que l'urine de personnes ayant un SHR est généralement dépourvue de matériau cellulaire car les reins ne sont pas directement lésés[4].
- Certaines infections virales hépatiques, comme l'hépatite B et l'hépatite C peuvent également entraîner une inflammation des glomérules rénaux[11],[12].
- Les autres causes d'insuffisance rénale chez les personnes atteintes de maladie hépatique incluent les atteintes par médicaments néphrotoxiques (notamment la gentamicine) ou les néphropathies aux produits de contraste, causée par l'administration intraveineuse d'agents de contraste utilisés pour les tests d'imagerie médicale[4].
Physiopathologie
[modifier | modifier le code]

L'insuffisance rénale du SHR est censée résulter d'anomalies du tonus des vaisseaux sanguins dans les reins[6]. La théorie prédominante (dite « théorie du sous-remplissage ») admet que les vaisseaux sanguins amenant le sang aux reins se contractent en raison d'un débit sanguin insuffisant par suite de la dilatation des vaisseaux de la circulation splanchnique (qui fournit le sang aux intestins) médiée par des facteurs libérés par le foie malade[13],[14].
On a émis l'hypothèse que le monoxyde d'azote[15], les prostaglandines[6],[16] et d'autres substances vaso-actives[6] étaient de puissants médiateurs de la vasodilatation splanchnique dans la cirrhose[6]. Il s'ensuit une diminution du volume sanguin « efficace » détecté par l'appareil juxtaglomérulaire, conduisant à une augmentation de la sécrétion de rénine et à l'activation du système rénine-angiotensine ce qui entraîne une vasoconstriction des vaisseaux systémiques dont ceux des reins en particulier[6]. Toutefois, cet effet est insuffisant pour contrebalancer les médiateurs vasodilatateurs de la circulation splanchnique, conduisant à la persistance d'un « sous-remplissage » sanguin rénal et une vasoconstriction rénale entraînant une insuffisance rénale[14].
Des études visant à vérifier cette théorie ont montré qu'il existait une diminution globale de la résistance vasculaire systémique dans le SHR et que le débit sanguin était augmenté dans les artères fémorales et diminué dans les artères rénales ce qui suggère que la vasodilatation splanchnique est impliquée dans l'insuffisance rénale[17]. On a supposé que de nombreuses substances chimiques vasoactives étaient impliquées dans les modifications hémodynamiques systémiques, comme le facteur natriurétique auriculaire[18], la prostacycline, le thromboxane A2[19] et des endotoxines[13]. En plus, on a constaté que l'administration de médicaments pour contrer la vasodilatation splanchnique (comme l'ornipressine[18], la terlipressine[20] et l'octréotide[21]) conduisaient à une amélioration du taux de filtration glomérulaire (qui est une mesure quantitative objective de la fonction rénale), chez les patients présentant un syndrome hépatorénal, fournissant une preuve supplémentaire que la vasodilatation splanchnique était un élément clé de sa pathogenèse.
La théorie du sous-remplissage implique l'activation du système rénine-angiotensine-aldostérone, qui conduit à une augmentation de la réabsorption du sodium au niveau du tubule rénal régulée par l'aldostérone, qui agit sur le récepteur des minéralocorticoïdes dans le tubule contourné distal[9],[14]. Cela semble être une étape clé dans la pathogenèse de l'ascite chez les cirrhotiques. On a émis l'hypothèse que l'ascite et le SHR sont la conséquence de la vasodilatation splanchnique qui entraine à la fois un échappement de l'ascite aux médicaments diurétiques (ce qu'on retrouve dans le SHR de type 2) et l'apparition d'une vasoconstriction rénale (tel que décrite ci-dessus)[9].
Prévention
[modifier | modifier le code]
Le risque de décès dans le SHR est très élevé et, par conséquent, il faut faire un effort particulier pour identifier les patients à risque et prévenir l'apparition de facteurs déclenchants.
Comme les infections (et plus spécifiquement les péritonites bactériennes spontanées (PBS)) et les hémorragies gastro-intestinales sont des complications courantes, souvent associées chez les sujets atteints de cirrhose et pouvant déclencher un SHR, on veillera à les prévenir ou les traiter précocement[7]. En cas de PBS, un essai contrôlé randomisé a révélé que l'administration intraveineuse d'albumine le jour de l'admission et au troisième jour d'hôpital réduisait à la fois les taux d'insuffisance rénale et de mortalité[22].
Un SHR peut être induit par des traitements inadaptés de l'ascite qui devront donc être évités. On évitera ainsi l'utilisation agressive de diurétiques. En outre, de nombreux médicaments employés pour traiter les complications des cirrhoses (comme certains antibiotiques) ou d'autres pathologies peuvent entraîner une altération de la fonction rénale[13],[7]. De même pour les ponctions d'ascite trop volumineuses faites pour soulager l'inconfort du patient et qui peuvent provoquer une altération hémodynamique suffisante pour déclencher un SHR. La perfusion concomitante d'albumine pour maintenir la pression osmotique peut éviter un dysfonctionnement du système circulatoire qui survient après une paracentèse de grand volume et prévenir le SHR[23]. Inversement, chez les individus présentant une ascite très tendue, on a émis l'hypothèse que l'élimination du liquide d'ascite pouvait améliorer la fonction rénale en diminuant la pression sur les veines rénales[24].
Traitement
[modifier | modifier le code]La greffe du foie
[modifier | modifier le code]Le traitement du syndrome hépatorénal est la greffe de foie orthotopique et toutes les autres thérapeutiques ne peuvent être considérées que comme des préparations à la transplantation[5],[25]. Bien que la greffe du foie soit de loin la meilleure option disponible pour le traitement du SHR, il faut savoir que la mortalité atteint 25 % dans le premier mois après la transplantation[26]. Les individus avec un SHR et une insuffisance hépatique documentée sévère (avec un score MELD supérieur à 36) sont considérés comme les sujets les plus à risque de mortalité précoce après transplantation hépatique[26]. On a démontré dans plusieurs études une aggravation transitoire de la fonction rénale après transplantation due à l'utilisation de médicaments toxiques pour les reins, comme les immunosuppresseurs tels que le tacrolimus et la ciclosporine qui sont connus pour aggraver la fonction rénale[6]. À long terme, toutefois, les personnes avec SHR bénéficiaires de greffes du foie récupèrent presque toujours une fonction rénale normale et les études montrent que leur taux de survie à trois ans est similaire à ceux qui ont reçu une greffe de foie pour des raisons autres qu'un SHR[5],[6].
Dans l'attente d'une transplantation hépatique (qui peut nécessiter un temps d'attente considérable), plusieurs autres stratégies ont été jugées bénéfiques pour préserver la fonction rénale. Elles comprennent l'utilisation de perfusions intraveineuses d'albumine, des médicaments (essentiellement les analogues de la vasopressine, qui entraînent une vasoconstriction splanchnique), les shunts hépatiques qui réduisent la pression dans la veine porte, la dialyse rénale et la dialyse hépatique[6].
Traitement médical
[modifier | modifier le code]Beaucoup d'études démontrant une amélioration de la fonction rénale chez les patients présentant un syndrome hépatorénal ont employé de l'albumine par voie intraveineuse (IV) pour augmenter le volume plasmatique[6],[27],[28]. La quantité d'albumine administrée par voie IV varie selon les études: une schéma classique est de 1 gramme d'albumine par kilogramme de poids corporel le premier jour, suivi de 20 à 40 grammes par jour les jours suivants[29]. Des études ont montré cependant que le traitement avec de l'albumine seule donne des résultats inférieurs à un traitement y associant d'autres médicaments. La plupart des études évaluant les thérapies avant transplantation pour SHR impliquent l'utilisation d'albumine en liaison avec un traitement médical ou autre[6],[30].
La midodrine est un alpha-agoniste et l'octréotide est un analogue de la somatostatine, une hormone impliquée dans la régulation de la tonicité des vaisseaux sanguins du tractus gastro-intestinal. Ces deux médicaments qui sont respectivement vasoconstricteur systémique et inhibiteur de la vasodilatation splanchnique n'avaient pas montré d'efficacité lorsqu'utilisés individuellement dans le traitement du syndrome hépatorénal[5],[6],[31]. Toutefois, une étude sur 13 patients présentant un SHR a montré une amélioration significative de la fonction rénale lorsque les deux étaient utilisés de concert (la midodrine étant administrée par voie orale, l'octréotide par voie sous-cutanée, les deux à des doses fonction de la tension artérielle), avec trois patients survivant après traitement[32]. Une autre étude non randomisée sur des patients traités avec les deux produits a montré une augmentation de la survie de 30 jours[5],[33].
L'ornipressine, un analogue de la vasopressine, a montré dans un certain nombre d'études son utilité dans l'amélioration de la fonction rénale chez les patients présentant un syndrome hépatorénal[5],[27],[34], mais ses possibilités d'utilisation sont limitées par le risque de provoquer une ischémie sévère de gros organes[5],[27]. La terlipressine est un autre analogue de la vasopressine qui a prouvé son efficacité dans une vaste étude sur l'amélioration de la fonction rénale chez les patients présentant un SHR avec une incidence moindre des ischémies[5],[28]. Une des principales critiques de l'ensemble de ces traitements médicaux est l'hétérogénéité des populations examinées et l'utilisation de la fonction rénale, au lieu de la mortalité, comme mesure des résultats[35].
D'autres agents ont été étudiés pour une utilisation dans le traitement du SHR notamment la pentoxifylline[36], l'acétylcystéine[37] et le misoprostol[5],[38]. Les éléments de preuve pour l'ensemble de ces thérapies se fondent soit sur des séries de cas, soit, dans le cas de la pentoxifylline, sur une extrapolation faite à partir d'un sous-ensemble de patients traités pour une hépatite alcoolique[5].
Autres traitements d'appoints
[modifier | modifier le code]- Le shunt intrahépatique par voie transjugulaire (TIPS) obtenu en plaçant un petit stent entre la veine porte et une veine sus-hépatique entraine une baisse de pression dans la circulation porte. La pose du stent se fait par cathétérisme sous contrôle radiologique avec voie d'abord par la veine jugulaire interne ou la veine fémorale. Il s'ensuit théoriquement, du fait d'une diminution de la pression porte, une inversion des phénomènes hémodynamiques qui conduisent finalement à l'apparition du SHR. L'emploi du TIPS a montré une amélioration de la fonction rénale chez es patients atteints de SHR[9],[39],[40]. Les complications de cette méthode sont une aggravation d'une encéphalopathie hépatique (car le procédé crée un shunt porto-cave, court-circuitant la détoxification du sang par le foie), une impossibilité de parvenir à une réduction suffisante de la pression porte et des hémorragies[9],[39].
- La dialyse hépatique est une technique de dialyse extracorporelle pour éliminer les toxines normalement éliminées par le foie. Elle se fait généralement par l'ajout dans le dialysat de grandes quantités d'albumine chargées de fixer les toxines ayant une forte affinité pour les protéines, l'albumine étant ensuite régénérée par passage sur résine échangeuse d'ions. Ces techniques de recirculation (procédé MARS) ont montré une certaine utilité dans l'attente d'une transplantation mais elles sont encore naissantes[9],[41].
Les méthodes de substitution rénale peuvent être nécessaires pour permettre à des individus d'attendre une transplantation hépatique, l'état du patient pouvant dicter la modalité utilisée[42]. La dialyse, cependant, ne conduit pas à une récupération ou une préservation de la fonction rénale mais est essentiellement utilisée pour éviter les complications de l'insuffisance rénale jusqu'à la transplantation. Chez les patients hémodialysés, il y a même peut-être un risque accru de mortalité due à l'hypotension induite par la méthode mais des études appropriées sont encore nécessaires. En conséquence, le rôle de la substitution rénale chez des patients avec SHR reste encore flou[6].
Épidémiologie
[modifier | modifier le code]Comme la majorité des personnes atteintes du SHR ont une cirrhose, la plupart des données épidémiologiques viennent d'une population cirrhotique.
Il s'agit d'une condition très répandue: environ 10 % des personnes admises à l'hôpital avec une ascite ont un SHR[10]. Une série rétrospective de cas de patients cirrhotiques traités par terlipressine suggère que 20,0 % des cas d'insuffisance rénale aiguë chez des malades cirrhotiques étaient dus au SHR de type 1 et 6,6 % au type 2[20]. On estime que 18 % des personnes ayant une cirrhose et une ascite développeront un SHR dans l'année suivant le diagnostic de cirrhose et 39 % dans les cinq ans suivant le diagnostic[10]. Trois facteurs de risque indépendants intervenant sur le développement d'un SHR chez les cirrhotiques ont été identifiés: la taille du foie, l'activité rénine plasmatique et la natrémie (concentration sérique en sodium)[10].
Le pronostic vital de ces patients est sombre, les patients non traités ayant un taux de survie extrêmement court[13],[10],[25]. La sévérité de la cirrhose mesurée au score de MELD se révèle être un facteur déterminant du résultat[26],[43]. Selon une étude chez des patients souffrant d'une hépatite alcoolique, 20 % d'entre eux développent un SHR sans cirrhose[36].
Références
[modifier | modifier le code]- « hépatorénal (syndrome) l.m. », sur Dictionnaire médical de l'Académie de Médecine – version 2024 (consulté le ).
- « Définition de ascitique », sur Le Robert (consulté le ).
- Richard Moreau, « Le syndrome hépatorénal », sur FMC-HGE (consulté le ).
- (en) V. Arroyo, P. Ginès, A. L. Gerbes et al., « Definition and diagnostic criteria of refractory ascites and hepatorenal syndrome in cirrhosis. International Ascites Club », Hepatology, vol. 23, no 1, , p. 164–76 (PMID 8550036, DOI 10.1002/hep.510230122)
- (en) CK Ng, MH ChanH, MH Tai MH, CW Lam, « Hepatorenal syndrome », Clin Biochem Rev, vol. 28, no 1, , p. 11–7 (PMID 17603637, PMCID 1904420)
- (en) P. Ginès et V. Arroyo, « Hepatorenal syndrome », J. Am. Soc. Nephrol., vol. 10, no 8, , p. 1833–9 (PMID 10446954, lire en ligne, consulté le )
- (en) Mukherjee, S. « Hepatorenal syndrome » emedicine.com. Retrieved on 2009-08-02
- (en) P. Ginés, V. Arroyo, E. Quintero, et al., « Comparison of paracentesis and diuretics in the treatment of cirrhotics with tense ascites. Results of a randomized study », Gastroenterology, vol. 93, no 2, , p. 234–41 (PMID 3297907)
- (en) L. Blendis, F. Wong, « The natural history and management of hepatorenal disorders: from pre-ascites to hepatorenal syndrome », Clin Med, vol. 3, no 2, , p. 154–9 (PMID 12737373, lire en ligne)
- (en) A. Ginès, A. Escorsell, P. Ginès et al., « Incidence, predictive factors, and prognosis of the hepatorenal syndrome in cirrhosis with ascites », Gastroenterology, vol. 105, no 1, , p. 229–36 (PMID 8514039)
- (en) S. H. Han, « Extrahepatic manifestations of chronic hepatitis B », Clin Liver Dis, vol. 8, no 2, , p. 403–18 (PMID 15481347, DOI 10.1016/j.cld.2004.02.003)
- (en) M. Philipneri, B. Bastani, « 'Kidney disease in patients with chronic hepatitis C », Curr Gastroenterol Rep, vol. 3, no 1, , p. 79–83 (PMID 11177699, DOI 10.1007/s11894-001-0045-0)
- (en) V. Arroyo, M. Guevara, P. Ginès, « Hepatorenal syndrome in cirrhosis: pathogenesis and treatment », Gastroenterology, vol. 122, no 6, , p. 1658–76 (PMID 12016430, DOI 10.1053/gast.2002.33575, lire en ligne)
- (en) R. Schrier, V. Arroyo, M. Bernardi, M. Epstein, J. Henriksen, J. Rodés, « Peripheral arterial vasodilation hypothesis: a proposal for the initiation of renal sodium and water retention in cirrhosis », Hepatology, vol. 8, no 5, , p. 1151–7 (PMID 2971015, DOI 10.1002/hep.1840080532)
- (en) P. Y. Martin, P. Ginès, R. Schrier, « Nitric oxide as a mediator of hemodynamic abnormalities and sodium and water retention in cirrhosis », N. Engl. J. Med., vol. 339, no 8, , p. 533–41 (PMID 9709047, DOI 10.1056/NEJM199808203390807)
- (en) M. Epstein, « Hepatorenal syndrome: emerging perspectives of pathophysiology and therapy », J. Am. Soc. Nephrol., vol. 4, no 10, , p. 1735–53 (PMID 8068872)
- (en) J. Fernandez-Seara, J. Prieto, J. Quiroga, et al., « Systemic and regional hemodynamics in patients with liver cirrhosis and ascites with and without functional renal failure », Gastroenterology, vol. 97, no 5, , p. 1304–12 (PMID 2676683)
- (en) K. Lenz, H. Hörtnagl, W. Druml, et al., « Ornipressin in the treatment of functional renal failure in decompensated liver cirrhosis. Effects on renal hemodynamics and atrial natriuretic factor », Gastroenterology, vol. 101, no 4, , p. 1060–7 (PMID 1832407)
- (en) K. Moore, P. Ward, G. Taylor, R. Williams, « Systemic and renal production of thromboxane A2 and prostacyclin in decompensated liver disease and hepatorenal syndrome », Gastroenterology, vol. 100, no 4, , p. 1069–77 (PMID 2001805)
- (en) R. Moreau, F. Durand, T. Poynard, C. Duhamel, et al., « Terlipressin in patients with cirrhosis and type 1 hepatorenal syndrome: a retrospective multicenter study », Gastroenterology, vol. 122, no 4, , p. 923–30 (PMID 11910344, DOI 10.1053/gast.2002.32364)
- (en) F. Kaffy, C. Borderie, C. Chagneau et al., « Octreotide in the treatment of the hepatorenal syndrome in cirrhotic patients », J. Hepatol., vol. 30, no 1, , p. 174 (PMID 9927168)
- (en) P. Sort, M. Navasa, V. Arroyo et al., « Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis », N Engl J Med, vol. 341, no 6, , p. 403–9 (PMID 10432325, DOI 10.1056/NEJM199908053410603, lire en ligne)
- (en) P. Velamati, H. Herlong, « Treatment of refractory ascites », Curr Treat Options Gastroenterol, vol. 9, no 6, , p. 530–7 (PMID 17081486, DOI 10.1007/s11938-006-0009-4)
- (en) S. Sherlock et J. Dooley, Diseases of the liver and biliary system, Wiley-Blackwell, , 728 p. (ISBN 978-0-632-05582-1), chap. 9.
- (en) F. Wong, L. Blendis, « New challenge of hepatorenal syndrome: prevention and treatment », Hepatology, vol. 34, no 6, , p. 1242–51 (PMID 11732014, DOI 10.1053/jhep.2001.29200)
- (en) X. Xu, Q. Ling, M. Zhang, et al., « Outcome of patients with hepatorenal syndrome type 1 after liver transplantation: Hangzhou experience », Transplantation, vol. 87, no 10, , p. 1514–9 (PMID 19461488, DOI 10.1097/TP.0b013e3181a4430b)
- (en) M. Guevara, P. Ginès, G. Fernández-Esparrach, et al., « Reversibility of hepatorenal syndrome by prolonged administration of ornipressin and plasma volume expansion », Hepatology, vol. 27, no 1, , p. 35–41 (PMID 9425914, DOI 10.1002/hep.510270107)
- (en) R. Ortega, P. Ginès, J. Uriz, et al., « Terlipressin therapy with and without albumin for patients with hepatorenal syndrome: results of a prospective, nonrandomized study », Hepatology, vol. 36, no 4 Pt 1, , p. 941–8 (PMID 12297842, DOI 10.1053/jhep.2002.35819)
- (en) P. Ginès, A. Cárdenas, V. Arroyo, J. Rodés, « Management of cirrhosis and ascites », N. Engl. J. Med., vol. 350, no 16, , p. 1646–54 (PMID 15084697, DOI 10.1056/NEJMra035021)
- (en) M. Martín-Llahí, M. Pépin, M. Guevara, et al., « Terlipressin and albumin vs albumin in patients with cirrhosis and hepatorenal syndrome: a randomized study », Gastroenterology, vol. 134, no 5, , p. 1352–9 (PMID 18471512, DOI 10.1053/j.gastro.2008.02.024)
- (en) G. Pomier-Layrargues, S. Paquin, Z. Hassoun, M. Lafortune, A. Tran, « Octreotide in hepatorenal syndrome: a randomized, double-blind, placebo-controlled, crossover study », Hepatology, vol. 38, no 1, , p. 238–43 (PMID 12830007, DOI 10.1053/jhep.2003.50276)
- (en) P. Angeli, R. Volpin, G. Gerunda, et al., « Reversal of type 1 hepatorenal syndrome with the administration of midodrine and octreotide », Hepatology, vol. 29, no 6, , p. 1690–7 (PMID 10347109, DOI 10.1002/hep.510290629)
- (en) E. Esrailian, E. Pantangco, N. KyuloL, K. Hu, B. Runyon, « Octreotide/Midodrine therapy significantly improves renal function and 30-day survival in patients with type 1 hepatorenal syndrome », Dig. Dis. Sci., vol. 52, no 3, , p. 742–8 (PMID 17235705, DOI 10.1007/s10620-006-9312-0)
- (en) V. Gülberg, M. Bilzer, A. L. Gerbes, « Long-term therapy and retreatment of hepatorenal syndrome type 1 with ornipressin and dopamine », Hepatology, vol. 30, no 4, , p. 870–5 (PMID 10498636, DOI 10.1002/hep.510300430)
- (en) P. Tandon, V. Bain, R. Tsuyuki, S. Klarenbach, « Systematic review: renal and other clinically relevant outcomes in hepatorenal syndrome trials », Aliment. Pharmacol. Ther., vol. 25, no 9, , p. 1017–28 (PMID 17439502, DOI 10.1111/j.1365-2036.2007.03303.x)
- (en) E. Akriviadis, R. Botla, W. Briggs, et al., « Pentoxifylline improves short-term survival in severe acute alcoholic hepatitis: a double-blind, placebo-controlled trial », Gastroenterology, vol. 119, no 6, , p. 1637–48 (PMID 11113085, DOI 10.1053/gast.2000.20189, lire en ligne)
- (en) S. Holt, D. Goodier, R. Marley, et al., « Improvement in renal function in hepatorenal syndrome with N-acetylcysteine », Lancet, vol. 353, no 9149, , p. 294–5 (PMID 9929029, DOI 10.1016/S0140-6736(05)74933-3)
- (en) J. Clewell, P. Walker-Renard, « Prostaglandins for the treatment of hepatorenal syndrome », Ann Pharmacother, vol. 28, no 1, , p. 54–5 (PMID 8123962)
- (en) F. Wong, L. Pantea, K. Sniderman, « Midodrine, octreotide, albumin, and TIPS in selected patients with cirrhosis and type 1 hepatorenal syndrome », Hepatology, vol. 40, no 1, , p. 55–64 (PMID 15239086, DOI 10.1002/hep.20262)
- (en) M. Guevara, J. Rodés, « Hepatorenal syndrome », Int. J. Biochem. Cell Biol., vol. 37, no 1, , p. 22–6 (PMID 15381144, DOI 10.1016/j.biocel.2004.06.007)
- (en) S. Mitzner, J. Stange, S. Klammt, et al., « Improvement of hepatorenal syndrome with extracorporeal albumin dialysis MARS: results of a prospective, randomized, controlled clinical trial », Liver Transpl., vol. 6, no 3, , p. 277–86 (PMID 10827226, DOI 10.1053/lv.2000.6355)
- (en) O. Witzke, M. Baumann, D. Patschan, et al., « Which patients benefit from hemodialysis therapy in hepatorenal syndrome? », J. Gastroenterol. Hepatol., vol. 19, no 12, , p. 1369–73 (PMID 15610310, DOI 10.1111/j.1440-1746.2004.03471.x)
- (en) C. Alessandria, O. Ozdogan, M. Guevara, et al., « MELD score and clinical type predict prognosis in hepatorenal syndrome: relevance to liver transplantation », Hepatology, vol. 41, no 6, , p. 1282–9 (PMID 15834937, DOI 10.1002/hep.20687)
Liens externes
[modifier | modifier le code]
- Ressources relatives à la santé :
- Notice dans un dictionnaire ou une encyclopédie généraliste :