Cấu trúc bậc hai của protein

Cấu trúc bậc hai của protein là cấu trục ba chiều của các phân đoạn địa phương (chứ không phải toàn bộ) của protein. Hai yếu tố cấu trúc bậc hai phổ biến nhất là xoắn alpha và phiến gấp beta, mặc dù điểm ngoặt beta và vòng omega cũng có thể có mặt. Các yếu tố cấu trúc bậc hai thường hình thành một cách tự nhiên như một dạng trung gian trước khi protein cuộn gấp thành cấu trúc bậc ba của nó.
Cấu trúc bậc hai được xác định bởi mô hình liên kết hydro giữa các nguyên tử hydro và oxy trong gốc carboxyl của amino acid trong mạch "xương sống" peptide. Cấu trúc bậc hai có thể được xác định theo một cách khác là dựa trên mô hình thường xuyên của các góc nhị diện trên mạch "xương sống" trong một khu vực cụ thể của mô hình Ramachandran bất kể nó có liên kết hydro chính xác hay không.
Khái niệm cấu trúc bậc hai lần đầu tiên được giới thiệu bởi Kaj Ulrik Linderstrøm-Lang tại Stanford năm 1952.[1][2] Các loại hơp chất sinh học khác, chẳng hạn như axit nucleic, cũng có cấu trúc bậc hai đặc trưng.
Phân loại
[sửa | sửa mã nguồn]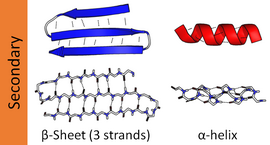

Cấu trúc bậc hai phổ biến nhất là xoắn alpha và phiến gấp beta. Các dạng xoắn khác, chẳng hạn như xoắn 310 và xoắn Pi, được tính toán để có các mô hình liên kết hydro thuận lợi, nhưng hiếm khi được quan sát thấy trong protein tự nhiên ngoại trừ ở các đầu của xoắn α do đóng gói mạch "xương sống" không thuận lợi ở vị trí giữa xoắn. Các cấu trúc mở rộng khác như xoắn polyproline và phiến gấp alpha là hiếm thấy trong protein ở trạng thái tự nhiên nhưng thường được giả thuyết là dạng cuộn gấp trung gian protein quan trọng. Các "vòng" chặt và các mối nối vòng lỏng, linh động có vẻ là các cấu trúc bậc hai "thường xuyên" hơn. Cuộn ngẫu nhiên (random coil) không phải là một cấu trúc bậc hai thực sự, mà là một dạng sắp xếp cho thấy sự vắng mặt của cấu trúc bậc hai bình thường.
amino acid có nhiều khả năng khác nhau để hình thành các yếu tố khác nhau cho cấu trúc bậc hai. Proline và glycine đôi khi được gọi là "phần ngắt xoắn" vì chúng phá vỡ tính đồng nhất của cấu trúc xoắn α trên mạch "xương sống"; tuy nhiên, cả hai đều có khả năng cấu trúc bất thường và thường được tìm thấy trong các điểm ngoặt. amino acid thích áp dụng sự phù hợp cho cấu trúc xoắn trong protein bao gồm methionine, alanine, leucine, glutamate và lysine ("MALEK" theo mã 1-chữ cái cho tên axitt amin); Ngược lại, các chuỗi bên có vòng thơm lớn (ở tryptophan, tyrosine và phenylalanine) và các amino acid phân nhánh Cβ (isoleucine, valine và threonine) lại thích hợp hơn với phiến gấp beta. Tuy nhiên, nếu chỉ dựa vào những thông tin này thì không đủ mạnh để tạo ra một phương pháp đáng tin cậy giúp dự đoán cấu trúc bậc hai.
Chú thích
[sửa | sửa mã nguồn]- ^ Linderstrøm-Lang KU (1952). Lane Medical Lectures: Proteins and Enzymes. Stanford University Press. tr. 115. ASIN B0007J31SC.
- ^ Schellman JA, Schellman CG (1997). “Kaj Ulrik Linderstrøm-Lang (1896–1959)”. Protein Sci. 6 (5): 1092–100. doi:10.1002/pro.5560060516. PMC 2143695. PMID 9144781.
He had already introduced the concepts of the primary, secondary, and tertiary structure of proteins in the third Lane Lecture (Linderstram-Lang, 1952)
 GIẢM
18%
GIẢM
18%
 GIẢM
22%
GIẢM
22%
 GIẢM
24%
GIẢM
24%
 GIẢM
50%
GIẢM
50%
![[Review sách] Cân bằng cảm xúc cả lúc bão giông](https://down-spe-vn.img.susercontent.com/3d596d5e3b0931abe3992652454f58a7.webp) GIẢM
25%
GIẢM
25%




