Asparagin
| Asparagin | |
|---|---|
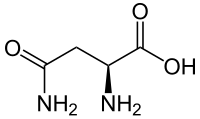 Strukturní vzorec | |
| Obecné | |
| Systematický název | (S)-2,4-diamino-4-oxobutanová kyselina |
| Triviální název | Asparagin |
| Ostatní názvy | 2-amino-3-karbamoylpropanová kyselina |
| Anglický název | Asparagine |
| Sumární vzorec | C4H8N2O3 |
| Vzhled | bílé krystaly |
| Identifikace | |
| Registrační číslo CAS | 70-47-3 |
| SMILES | C(C(C(=O)O)N)C(=O)N |
| InChI | InChI=1S/C4H8N2O3/c5-2(4(8)9)1-3(6)7/h2H,1,5H2,(H2,6,7)(H,8,9)/t2-/m0/s1 |
| Vlastnosti | |
| Molární hmotnost | 132,11 g/mol |
| Teplota tání | 234–235 °C |
| Disociační konstanta pKa | 2,02 |
| Disociační konstanta pKb | 8,80 |
| Bezpečnost | |
| NFPA 704 |  |
| Teplota vzplanutí | °C |
| Teplota hoření | °C |
| Teplota vznícení | °C |
Některá data mohou pocházet z datové položky. | |
Asparagin (značka Asn nebo N) je neesenciální proteinogenní aminokyselina. Jedná se o amid kyseliny asparagové (Asp, D). Řadí se mezi polární aminokyseliny (aminokyseliny s polárním postranním řetězcem).
V potravinách upravených smažením či pečením vzniká Maillardovou reakcí mezi asparaginem a redukujícími sacharidy akrylamid.[1] I když akrylamid nevzniká v toxickém množství, existuje podezření, že vznikající množství může mít rakovinotvorné účinky.[2]
Historie
[editovat | editovat zdroj]Asparagin byl poprvé izolován roku 1806 Vauquelinem a Robiquetem[3] poté, co Robiquet v laboratoři zapomněl přes víkend na stole šťávu z chřestu (asparagus), ve které vznikly krystalky látky obsahující dusík. Látku bylo obtížné chemicky zařadit, později vyšlo najevo, že se jedná o první identifikovanou aminokyselinu.[4] Protože se asparagin při izolaci z proteinů snadno přeměňuje na kyselinu asparagovou, jako součást proteinů byl identifikován až v roce 1932.[5]
Funkce
[editovat | editovat zdroj]Asparagin je polární, proto se častěji vyskytuje na povrchu proteinů. Boční řetězec asparaginu není nabitý, ale může být donorem či akceptorem vodíkové vazby. Protože může tímto způsobem interagovat i s peptidovou kostrou, vyskytuje se často na začátku a konci alfa-helixů a ve smyčkách beta-listů, kde asparagin tyto strukturní motivy svou vodíkovou vazbou uzavírá. Jinak relativně podobný glutamin tuto funkci zastává méně často pro svou vyšší konformační entropii. Polární postranní řetězec asparaginu interaguje s polárními nebo nabitými sloučeninami, proto je často využíván k protein-proteinovým interakcím a v aktivních místech enzymů.[6]
Přes dusík amidové skupiny se v endoplasmatickém retikulu na asparagin v sekvenci Asn-Xaa-Ser/Thr (kde Xaa může být jakákoliv aminokyselina kromě prolinu) vážou N-glykosidovou vazbou oligosacharidy za tvorby N-glykoproteinů.
Zdroje
[editovat | editovat zdroj]Biosyntéza
[editovat | editovat zdroj]Savci jsou schopní si asparagin syntetizovat pomocí enzymu asparagin syntetázy, který za spotřeby energie (z ATP) katalyzuje reakci aspartát + glutamin → asparagin + glutamát. Ve většině případů je exprese genu pro asparagin syntetázu jenom nízká a zvyšuje se při nedostatku asparaginu nebo některých typech buněčného stresu. Ne všechny buňky lidského těla jsou schopny si asparagin syntetizovat samy, proto musí být roznášen krví, jedná se především o buňky nervového systému[7] nebo buňky akutní lymfoblastické leukémie a některých nádorů, čehož se využívá při asparaginázové terapii.[8][9]
U bakterií se vyskytují dva typy asparagin syntetázy, první využívá jako zdroj dusíku amoniak, druhý typ využívá mechanismus obdobný savčímu.[8]
Degradace
[editovat | editovat zdroj]Asparagin patří mezi glukogenní aminokyseliny, může být tedy vstupní molekulou pro vznik glukózy, vstupuje také do cyklu kyseliny citrónové (podobně jako asparagová kyselina je mezikrokem oxalacetát). Degradaci začíná enzym asparagináza, který hydrolyzuje asparagin na asparagovou kyselinu, která je následně transaminována reakcí: kyselina asparagová + α-ketoglutarát → oxalacetát + glutamát.
Protože buňky akutní lymfoblastické leukémie (ALL) a některých nádorů si nejsou schopny asparagin syntetizovat, využívá se asparaginázová terapie, při které se do krve či svalu vpraví enzym asparagináza štěpící asparagin dostupný v krvi, čímž se zabrání růstu buněk ALL.[8][9] Asparaginázu je také možné použít k odstranění asparaginu z jídla upravovaného smažením, což snižuje množství vznikajícího akrylamidu.[10]
Reference
[editovat | editovat zdroj]- ↑ ZHANG, Y.; ZHANG, Y. Formation and reduction of acrylamide in Maillard reaction: a review based on the current state of knowledge.. Crit Rev Food Sci Nutr. 2007, roč. 47, čís. 5, s. 521–42. DOI 10.1080/10408390600920070. PMID 17558658.
- ↑ FAO/WHO Consultation on the Health Implications of Acrylamide in Food [online]. FAO/WHO [cit. 2014-12-15]. Dostupné v archivu pořízeném z originálu. (anglicky)
- ↑ VAUQUELIN, L. N.; ROBIQUET, P. J. La découverte d'un nouveau principe végétal dans le suc des asperges. Annales de Chimie. 1806, roč. 57, čís. 88, s. 88–93. (francouzsky)
- ↑ VICKERY, Hubert. The History of the Discovery of the Amino Acids. Chemical reviews. 1931, roč. 9, čís. 2, s. 169–318.
- ↑ DAMODARAN, M. The isolation of asparagine from an enzymic digest of edestin.. Biochem J. 1932, roč. 26, čís. 1, s. 235–47. Dostupné online. PMID 16744807.
- ↑ BARNES, Michael R. Bioinformatics for Geneticists: A Bioinformatics Primer for the Analysis of Genetic Data. [s.l.]: Wiley, 2007. 576 s. ISBN 978-0470026205. Kapitola 14: Amino Acid Properties and Consequences of Substitutions, s. en. (anglicky)
- ↑ RUZZO, EK.; CAPO-CHICHI, JM.; BEN-ZEEV, B., et al. Deficiency of asparagine synthetase causes congenital microcephaly and a progressive form of encephalopathy.. Neuron. Oct 2013, roč. 80, čís. 2, s. 429–41. DOI 10.1016/j.neuron.2013.08.013. PMID 24139043.
- ↑ a b c BALASUBRAMANIAN, MN.; BUTTERWORTH, EA.; KILBERG, MS. Asparagine synthetase: regulation by cell stress and involvement in tumor biology.. Am J Physiol Endocrinol Metab. Apr 2013, roč. 304, čís. 8, s. E789–99. DOI 10.1152/ajpendo.00015.2013. PMID 23403946.
- ↑ a b KUMAR, K.; KAUR, J.; WALIA, S., et al. L-asparaginase: an effective agent in the treatment of acute lymphoblastic leukemia.. Leuk Lymphoma. Feb 2014, roč. 55, čís. 2, s. 256–62. DOI 10.3109/10428194.2013.803224. PMID 23662993.
- ↑ HENDRIKSEN, HV.; KORNBRUST, BA.; ØSTERGAARD, PR., et al. Evaluating the potential for enzymatic acrylamide mitigation in a range of food products using an asparaginase from Aspergillus oryzae.. J Agric Food Chem. May 2009, roč. 57, čís. 10, s. 4168–76. DOI 10.1021/jf900174q. PMID 19388639.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu asparagin na Wikimedia Commons
Obrázky, zvuky či videa k tématu asparagin na Wikimedia Commons